第四章 非晶体结构
- 格式:ppt
- 大小:1.36 MB
- 文档页数:89


非晶体材料的结构分析非晶体材料是一类无定形或准无定形结构的材料,其最大的特点是其内部结构无法被经典的晶体学方法所描述。
这种材料结构的复杂性带来了其特殊的力学、导电、光学、热学、磁学等性质,因此成为物理化学、材料科学、化学等领域中研究的重要热点之一。
本文将围绕非晶体材料的结构分析展开,提供一些基础知识和研究方法。
一、非晶体材料的发现和分类非晶体材料的研究可以追溯到20世纪初期,迅速发展至今,可以分为金属非晶体材料和无机非晶体材料两大类。
前者包括金属玻璃、非晶合金等材料,而后者包括硅氧烷、硼烷、硫化物等材料。
这两大类材料在构成和性质方面存在很多差异,因此在研究方法和应用上也有所不同。
二、非晶体材料的结构分析方法1. X射线衍射X射线衍射是最常用的晶体学方法,其原理是当入射的X射线碰到材料后,由于其特殊的电磁性质而发生散射,并形成特征的衍射图案。
由此可得出晶体的位置、取向、原子间距和晶胞参数等信息。
但是对于非晶体材料,X射线衍射的方法并不适用。
这是因为非晶体结构较为复杂,其原子间距离和同一平面上原子的相对位置不易固定,导致传统的晶体学方法无法正确反映其内部结构。
但是,非晶体材料的偏晶性可以允许X射线的部分散射,通过分析衍射图案的形成特征可以发现非晶体特殊的结构。
因此X射线衍射仍是了解非晶体材料内部结构的重要手段之一。
2. 电子衍射电子衍射是一种比较新的物理手段,其基本思想是利用电子在材料中的散射来分析其内部结构。
相对于传统的X射线衍射,电子的波长更短,可以穿透更深的材料厚度,因此可以用于对非晶体材料的结构分析。
同时,由于电子的散射强度与离子电荷数的平方成正比,所以电子衍射在轻原子的结构分析中更为有效。
现有的电子衍射仪器在设计上也与X射线衍射有很多相似之处,例如退火等处理技术、角度测量等方法。
3. 热分析热分析主要是对非晶体材料的热稳定性进行测试。
随着温度的升高,该材料逐渐失去非晶蜕变的能力,转变为晶体,同时,可以从体积、焓、熵、固相分析等方面进行分析、研究了解非晶体细微结构的转变。

第四章⾮晶态结构与性质第四章⾮晶态结构与性质内容提要熔体和玻璃体是物质另外两种聚集状态。
相对于晶体⽽⾔,熔体和玻璃体中质点排列具有不规则性,⾄少在长距离范围结构具有⽆序性,因此,这类材料属于⾮晶态材料。
从认识论⾓度看,本章将从晶体中质点的周期性规则形排列过渡到质点微观排列的⾮周期性、⾮规则性来认识⾮晶态材料的结构和性质。
熔体特指加热到较⾼温度才能液化的物质的液体,即较⾼熔点物质的液体。
熔体快速冷却则变成玻璃体。
因此,熔体和玻璃体是相互联系、性质相近的两种聚集状态,这两种聚集状态的研究对理解⽆机材料的形成和性质有着重要的作⽤。
传统玻璃的整个⽣产过程就是熔体和玻璃体的转化过程。
在其他⽆机材料(如陶瓷、耐⽕材料、⽔泥等)的⽣产过程中⼀般也都会出现⼀定数量的⾼温熔融相,常温下以玻璃相存在于各晶相之间,其含量及性质对这些材料的形成过程及制品性能都有重要影响。
如⽔泥⾏业,⾼温液相的性质(如粘度、表⾯张⼒)常常决定⽔泥烧成的难易程度和质量好坏。
陶瓷和耐⽕材料⾏业,它通常是强度和美观的有机结合,有时希望有较多的熔融相,⽽有时⼜希望熔融相含量较少,⽽更重要的是希望能控制熔体的粘度及表⾯张⼒等性质。
所有这些愿望,都必须在充分认识熔体结构和性质及其结构与性质之间的关系之后才能实现。
本章主要介绍熔体的结构及性质,玻璃的通性、玻璃的形成、玻璃的结构理论以及典型玻璃类型等内容,这些基本知识对控制⽆机材料的制造过程和改善⽆机材料性能具有重要的意义。
4.1 熔体的结构⼀、对熔体的⼀般认识⾃然界中,物质通常以⽓态、液态和固态三种聚集状态存在。
这些物质状态在空间的有限部分则称为⽓体、液体和固体。
固体⼜分为晶体和⾮晶体两种形式。
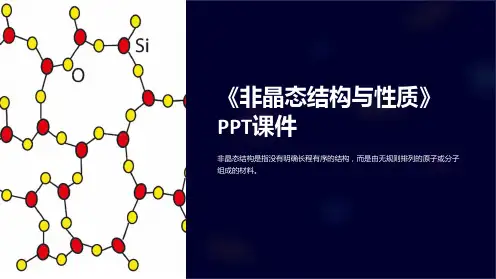
晶体的结构特点是质点在三维空间作规则排列,即远程有序;⾮晶体包括⽤熔体过冷⽽得到的传统玻璃和⽤⾮熔融法(如⽓相沉积、真空蒸发和溅射、离⼦注⼊等)所获得的新型玻璃,也称⽆定形体,其结构特点是近程有序,远程⽆序。

第4章非晶态结构与性质一、名词解释1.熔体与玻璃体:熔体即具有高熔点的物质的液体。
熔体快速冷却形成玻璃体。
2.聚合与解聚:聚合:各种低聚物相互作用形成高聚物解聚:高聚物分化成各种低聚物3.晶子学说与无规则网络学说:晶子学说(有序、对称、具有周期性的网络结构):1硅酸盐玻璃中含有无数的晶子2晶子的互相组成取决于玻璃的化学组成3晶子不同于一般微晶,而是带有晶体变形的有序区域,在晶子中心质点排列较有规律,远离中心则变形程度增大4晶子分散于无定形物质中,两者没有明显界面无规则网络学说(无序不对称不具有周期性的网络结构)1形成玻璃态的物质与晶体结构相类似,形成三维的空间网格结构2这种网络是离子多面体通过氧桥相连进而向三维空间规则4.网络形成体与网络变性体:网络形成体:能够单独形成玻璃的氧化物网络变性体:不能单独形成玻璃的氧化物5.桥氧与非桥氧:桥氧:玻璃网络中作为两个成网多面体所共有顶角的氧非桥氧:玻璃网络中只与一个成网多面体相连的氧二、填空与选择1.玻璃的通性为:各向同性、介稳性、由熔融态向玻璃态转化是可逆与渐变的,无固定熔点、由熔融态向玻璃态转化时,物理、化学性质随温度的变化连续性和物理化学性质随成分变化的连续性。
2.氧化物的键强是形成玻璃的重要条件。
根据单键强度的大小可把氧化物中的正离子分为三类:网络形成体、网络中间体和网络改变体;其单键强度数值范围分别为单键强度>335KJ/mol、单键强度介于250~335KJ/mol 和单键强度<250~335KJ/mol。
3.聚合物的形成可分为三个阶段,初期:石英颗粒的分化;中期:缩聚与变形;后期:在一定时间内分化与缩聚达到平衡。
4.熔体结构的特点是:近程有序、远程无序。
5.熔体是物质在液相温度以上存在的一种高能量状态,在冷却的过程中可以出现结晶化、玻璃化和分相三种不同的相变过程。
6.在玻璃性质随温度变化的曲线上有二个特征温度Tg(脆性温度)和Tf (软化温度),与这二个特征温度相对应的粘度分别为1012Pa·s和108Pa·s。

知识点065. 玻璃形成的条件
玻璃化和分相后的状态都有向晶体转化的倾向
析晶放出的能量与形成玻璃放出的能量较为接近的体系,从玻璃向晶体转化的驱动力很小,形成玻璃后可以长时间稳定存在,因此更容易形成玻璃
从熔体中形成晶体时,成核、生长速率与过冷度的关系
u
Iv
u
u
ΔT Iv
更容易析晶 更容易形成玻璃
A
B C
10-4 10-2 102 104 106 108 1010
1
120
100 80 60
40 20 过冷度(K )
时间(s )
V β/V ≈(π/3)I v u 3t 4
析晶区 玻璃区
过冷度越大,析晶需要的冷却时间越短
过冷度过大,析晶需要的冷却时间却变长
A
B C
10-4 10-2 102 104 106 108 1010
1
120
100 80 60
40 20 过冷度(K )
时间(s )
析晶区 玻璃区
析晶的最短时间t n 析晶的过冷度ΔT n
临界冷却速率 ΔT n / t n
聚合物结构理论的解释
离子键化合物
金属键物质
纯粹共价键化合物
离子键和金属键向共价键过渡
极性共价键
近程有序。
远程无序
金属共价键
近程有序。
远程无序
形成玻璃必须具有离子键或金属键向共价键过渡的混合键型
随堂练习:答:
随堂练习:答:
课后习题:P202-204 4.5, 4.14, 4.21, 4.23。



知识点066. 玻璃的结构理论
学说要点:
520℃-590 ℃实验依据
100 T(℃)
200 400
300 500
玻璃的网络是不规则的、非周期性的,因此玻璃的内能比晶体的内能要大
缺乏对称性和周期性的重复
石英玻璃
0 0.04 0.08 0.12 0.16 0.20 0.24 λ
方石英
λ
硅胶
sinθ
优点:缺陷:
优点:均匀性、连续性及无序性
缺陷:
硼硅酸盐玻璃分相与不均匀
光学玻璃氟化物与磷酸盐玻璃分相
•两大学说的相同点:
•两大学说的不同点:
近程有序远程无序
本章知识点回顾:
知识点060. 液体的一般性状与结构
知识点061. 硅酸盐熔体的聚合物结构理论知识点062. 熔体的粘度及变化
知识点063. 熔体的表面张力及变化
知识点064. 玻璃的通性、玻璃的形成与转变知识点065. 玻璃形成的条件
知识点066. 玻璃的结构理论。

高中物理晶体非晶体知识点
基础知识:
1. 晶体是由有序排列的原子或分子构成的固体,非晶体是由无序排列的原子或分子构成的固体。
2. 晶体具有定向性,非晶体没有定向性。
3. 晶体具有明确的晶体结构,而非晶体没有明确的结构,呈现出随机分布的状态。
4. 晶体具有具体的晶格参数、晶面和晶体形态,而非晶体没有这些特征。
晶体结构:
1. 晶体结构分为离子晶体结构、共价晶体结构和金属晶体结构。
2. 离子晶体结构由正离子和负离子通过电静力相互作用形成的结构。
3. 共价晶体结构由共价键形成的结构。
4. 金属晶体结构由金属原子之间的金属键形成的结构。
晶体缺陷:
1. 晶体缺陷主要分为点缺陷、线缺陷和面缺陷。
2. 点缺陷包括空位缺陷和杂质缺陷。
3. 线缺陷包括位错和螺旋位错。
4. 面缺陷包括晶界和堆垛错。
非晶体结构:
1. 非晶体结构没有明确的结构,它的结构呈现出无规则分布的状态。
2. 非晶体结构有两种常见的排列方式,即高密度排列(例如熔
融态条件下)和低密度排列(例如固态条件下)。
3. 非晶体具有很强的非晶特性,例如固态条件下呈现出象液体的形态。
4. 非晶体具有良好的机械性能和化学性质,因此在制备材料、光电器件等领域有广泛应用。

第四章非晶态结构与性质【例4-1】一种用于制造灯泡的苏打-石灰-石英玻璃的退火点是514℃,软化点是696℃,计算这种玻璃的熔融范围和工作范围。
【解】按公式退火点:514+273=787K时粘度η=1012Pa·s软化点:696+273=969K时粘度η=4.5×106Pa·s,则:解之:△E=429 kJ/mol,得:Pa·s工作温度范围粘度一般为103~107 Pa·s,由于当η=103Pa·s时,℃当η=107Pa·s时,℃所以工作温度范围是682~877℃熔融范围粘度一般是10~100Pa·s当η=10Pa·s时,℃当η=50Pa·s时,4℃所以熔融温度范围是940~1009℃【例4-2】已知石英玻璃的密度为2.3g/cm’,假定玻璃中原子尺寸与晶体SiO2相同。
试计算玻璃原子堆积系数(APC)是多少?【解】设在体积为1nm3内SiO2原子数为n,则密度按题意ρ=2. 3g/cm3=2.3×10-21g/nm3,SiO2相对分子质量M=60.02g代入上式求得n:个/nm3在1nm中SiO2所占体积则:【例4-3】正硅酸铅玻璃密度为7.36g/cm3,求这个玻璃中氧的密度为若干?试把它与熔融石英(密度为2.2g/cm3)中的氧密度比较,试指出铅离子所在位置。
【解】正硅酸铅PbSiO3的相对分子质量为GM=207.2+28+16×3=283.2在1cm3中PbSiO3的个数为:个/cm3在PbSiO3玻璃中氧的密度为:g/cm3同样求得石英玻璃中SiO2的个数n2和氧的密度为ρ2:个/cm3,g/cm3显然ρ1>ρ2,即PbSiO3玻璃中氧的密度高于石英玻璃SiO2中氧的密度。
因而PbSiO3玻璃中Pb2+作为网络改变离子而统计均匀分布在Si-O形成的网络骨架空隙中。
【例4-4】一种玻璃的组成为80wt%SiO2和20wt%Na2O,试计算其非桥氧百分数?【解】将玻璃组成由质量百分比换算成摩尔百分比,如下表所示:wt%mol数mol%SiO280 1.33 80.6Na2O 20 0.32 19.4,,非桥氧%=【例4-5】有两种不同配比的玻璃,其组成如下,请用玻璃结构参数说明两种玻璃高温下粘度的大小?序号Na2Owt%Al2O3wt%SiO2wt%1 10 20 702 20 10 70【解】将玻璃组成由质量百分比换算成摩尔百分比,如下表所示:NoNa2O Al2O3SiO2Y wt%mol%wt%mol%wt%mol%1 10 10.6 20 12.9 70 76.5 2.722 20 20.4 10 6.2 70 73.4 3.66 对1#玻璃:, Al3+被视为网络改变离子,,,对2#玻璃:, Al3+作为网络形成离子,,,即:1#玻璃Y1<玻璃Y2,在高温下1#粘度<2#粘度。
第4章 非晶态结构与性质4.1 熔体的结构4.2 熔体的性质4.3 玻璃的通性和玻璃的转变4.4 玻璃的形成4.5 玻璃结构理论第4章非晶态结构与性质——4.5 玻璃结构理论4.5 玻璃结构理论一、微晶学说二、无规则网络学说三、两大学说的比较与发展第4章非晶态结构与性质——4.5 玻璃结构理论一、微晶学说前苏联学者列别捷夫(A.A.Лебедев)1921年提出实验依据�折射率-温度曲线�钠硅双组分玻璃的X射线散射强度曲线�红外反射光谱第4章非晶态结构与性质——4.5 玻璃结构理论第4章 非晶态结构与性质——4.5 玻璃结构理论硅酸盐玻璃折射率随温度变化曲线200400300100500100200-200-100Δn ×105T(℃)第4章 非晶态结构与性质——4.5 玻璃结构理论SiO 2含量76.4%的钠硅酸盐玻璃折射率随温度变化曲线200300100-200-100Δn ×107T (℃)β γα βα β鳞石英(160 ℃)鳞石英(117 ℃)方石英(268 ℃)第4章 非晶态结构与性质——4.5 玻璃结构理论27Na 2O ·73SiO 2玻璃的X 射线散射强度曲线1-未加热;2-在618℃保温1h3-在800 ℃保温10min 和670 ℃保温20h150100 50 0 15010050 0 250 200 150 100 50 00.10.20.30.40.5sin θλI 1325-同上,析晶玻璃,620℃保温6h4-同上,连续薄雾析晶,620℃保温3h3-同上,有间断薄雾析晶,620℃保温3h2-玻璃表层部分,620℃保温1h1-原始玻璃33.3Na2O·66.7SiO2玻璃的反射光谱第4章非晶态结构与性质——4.5 玻璃结构理论学说要点:�玻璃结构由无数“微晶”分散在无定形介质中构成;�“微晶”化学性质和数量取决于玻璃化学组成,可以是独立原子团或一定组成化合物和固溶体等,与该玻璃物系的相平衡有关;�“微晶” 是晶格极度变形的微小有序区域,“微晶”中心质点排列较有规律,愈远离中心则变形程度愈大;�“微晶”部分逐步过渡到无定形部分,两者之间无明显界线。