5.4.4无机非金属材料的非晶体结构
- 格式:ppt
- 大小:9.88 MB
- 文档页数:57

非晶体材料的结构分析非晶体材料是一类无定形或准无定形结构的材料,其最大的特点是其内部结构无法被经典的晶体学方法所描述。
这种材料结构的复杂性带来了其特殊的力学、导电、光学、热学、磁学等性质,因此成为物理化学、材料科学、化学等领域中研究的重要热点之一。
本文将围绕非晶体材料的结构分析展开,提供一些基础知识和研究方法。
一、非晶体材料的发现和分类非晶体材料的研究可以追溯到20世纪初期,迅速发展至今,可以分为金属非晶体材料和无机非晶体材料两大类。
前者包括金属玻璃、非晶合金等材料,而后者包括硅氧烷、硼烷、硫化物等材料。
这两大类材料在构成和性质方面存在很多差异,因此在研究方法和应用上也有所不同。
二、非晶体材料的结构分析方法1. X射线衍射X射线衍射是最常用的晶体学方法,其原理是当入射的X射线碰到材料后,由于其特殊的电磁性质而发生散射,并形成特征的衍射图案。
由此可得出晶体的位置、取向、原子间距和晶胞参数等信息。
但是对于非晶体材料,X射线衍射的方法并不适用。
这是因为非晶体结构较为复杂,其原子间距离和同一平面上原子的相对位置不易固定,导致传统的晶体学方法无法正确反映其内部结构。
但是,非晶体材料的偏晶性可以允许X射线的部分散射,通过分析衍射图案的形成特征可以发现非晶体特殊的结构。
因此X射线衍射仍是了解非晶体材料内部结构的重要手段之一。
2. 电子衍射电子衍射是一种比较新的物理手段,其基本思想是利用电子在材料中的散射来分析其内部结构。
相对于传统的X射线衍射,电子的波长更短,可以穿透更深的材料厚度,因此可以用于对非晶体材料的结构分析。
同时,由于电子的散射强度与离子电荷数的平方成正比,所以电子衍射在轻原子的结构分析中更为有效。
现有的电子衍射仪器在设计上也与X射线衍射有很多相似之处,例如退火等处理技术、角度测量等方法。
3. 热分析热分析主要是对非晶体材料的热稳定性进行测试。
随着温度的升高,该材料逐渐失去非晶蜕变的能力,转变为晶体,同时,可以从体积、焓、熵、固相分析等方面进行分析、研究了解非晶体细微结构的转变。

无机非金属材料物理化学知识点整理无机非金属材料为北航材料学院2009年考研新加科目,考试内容包括大三金属方向限选课《无机非金属材料物理化学》(60%左右)和大四金属方向限选课《特种陶瓷材料》(40%左右)。
参考书:陆佩文主编《无机材料科学基础》,武汉理工大学出版社,1996年。
本资料由陆晨整理录入。
祝愿大家考出好成绩。
第一章无机非金属材料的晶体结构第一节:概述一、晶体定义:晶体是内部质点在三维空间呈周期性重复排列的固体。
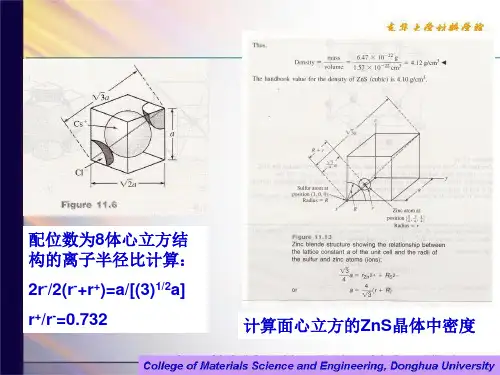
二、晶体结构=空间点阵+结构单元三、晶体的基本性质:1、均一性2、各向异性3、自限性4、对称性5、稳定性四、对称性、对称元素、七大晶系、十四种布拉菲格子结晶符号1、晶面符号——米勒指数(hkl) 2、晶棱符号[ uvw]PS:其实只要看了金属学,这些就都会了,懒得写了…第二节:晶体化学一、离子键、共价键、金属键、分子间力、氢键定义、特点(大家都知道的东西…)二、离子极化:三、鲍林规则(重点):鲍林第一规则──配位多面体规则,其内容是:“在中,在正离子周围形成一个负离子多面体,正负离子之间的距离取决于离子半径之和,正离子的配位数取决于离子半径比”。
鲍林第二规则──电价规则指出:“在一个稳定的离子晶体结构中,每一个负离子电荷数等于或近似等于相邻正离子分配给这个负离子的静电键强度的总和,其偏差≤1/4价”。
静电键强度S=正离子数Z+/正离子配位数n ,则负离子数Z=∑Si=∑(Zi+/ni)。
鲍林第三规则──多面体共顶、共棱、共面规则,其内容是:“在一个配位结构中,共用棱,特别是共用面的存在会降低这个结构的稳定性。
其中高电价,低配位的正离子的这种效应更为明显”。
鲍林第四规则──不同配位多面体连接规则,其内容是:“若晶体结构中含有一种以上的正离子,则高电价、低配位的多面体之间有尽可能彼此互不连接的趋势”。
例如,在镁橄榄石结构中,有[SiO4]四面体和[MgO6]八面体两种配位多面体,但Si4+电价高、配位数低,所以[SiO4]四面体之间彼此无连接,它们之间由[MgO 6]八面体所隔开。




第四章 非晶体结构第一节 非晶体分类一、分类1、玻璃体:金属或非金属氧化物,经高温熔融后,快速冷却所得到的结构。
2、聚合物:这种结构的分子链很长,无法经过扩散过程形成规则排列,而保持其吴规线团状。
3、凝胶体:胶体质点相互连接形成空间网络结构,其质点排列是无序的,质点间是分子间作用力。
4、非晶态薄膜:经气相反映,直接在另一材料表面形成的沉积层。
非晶体结构特点:短程有序 长程无序二、玻璃体的通性1、各向同性2、介稳性3、转变具有逐渐性,可逆性4、物理化学性质随温度连续变化。
第二节 玻璃体的转变一、转变机理玻璃转变过程是两种不同速度相互比较、相互竞争的过程。
结构调整速度:指在冷却过程中,熔体中质点发生调整重新达到新的平衡结构的速度,由物体本性决定。
冷却速度:外部环境所提供的速度。
冷却速度 大于 结构调整速度:所需时间得不到保证,熔体结构来不及调整重排而偏离平衡结构,发生玻璃转变。
冷却速度 小于结构调整速度,保持平衡,发生结晶转变。
二、转变过程当发生转变时,熔体的许多物理性质如比容、热膨胀系数等都变化。
图5-5 液固状态下的V~T关系1、Tg:相应于曲线低温直线部分开始弯曲时的温度,玻璃出现脆性的最高T,相当于粘度为10的12到13次方,称为脆性温度。
脆性温度作用:退火温度上限,可以消除玻璃制品的内应力。
2、Tf:相应于曲线弯曲部分开始转向高温直线部分的温度,是玻璃开始出现液体典型性质的温度,相当于粘度为10的9次方,称为软化温度。
3、Tg —Tf:性质或多或少会发生急剧变化,称为反常间距、玻璃转化温度范围。
T<Tg固态(性质逐渐变化)T>Tf熔体(性质逐渐变化)三、转变条件1、热力学条件熔体(高温状态)释放能量两种途径:(1)结晶化:有序度不断增加,直到释放出全部的多余能量。
(2)玻璃化:释放出部分能量,保持了高温熔体的部分结构。
提出:对于同一种材料,玻璃态和晶态的内能差别越大,结晶倾向也越大2、动力学条件物质的成核速率和长大速率曲线基本一致:结晶物质的成核速率和长大速率曲线严重分离:玻璃图5-3 易成玻璃的材料结晶动力学曲线3、结晶化学条件(1)单键的强度与玻璃的形成根据单键强度的大小,可将氧化物分成三类:∙单键强度>335KJ/mol的氧化物可以单独形成玻璃,称网络形成剂。


第六章无机非金属材料的结构特征第一节无机非金属材料的显微结构●基本特征●化学键合●正负离子的堆积方法●1.4 典型无机化合物晶体结构●(1)AX型晶体●(2) AX2型晶体●(3)A2X3型晶体●(4)ABO3型晶体●(5)AB2O4型晶体第二节硅酸盐材料的晶体结构●2.1 硅酸盐材料的结构特征及其分类●2. 2 岛状结构●2. 3 组群状结构●2.4 链状结构●2. 5 层状结构●2.6 架状结构第三节熔体及非晶态固体的结构●3.1 熔体的结构模型●3.1.1熔体的结构●3.1.2 熔体组成与结构●3.2 熔体的性质●3.2.1 粘度●(1)粘度的概念●(2)粘度与温度的关系●(3)粘度与组成关系●3.2.2 导电性能●3.2.3 表面张力和表面能●3.3非晶态固体的结构特征与表征●3.4玻璃的概念与通性●3.4玻璃的概念与通性●3.5 玻璃的结构理论●3.5.1 无规则网络学说●3.5.2 晶子学说●3.6 玻璃化条件●3.6.1 形成玻璃的物质及其方法●3.6.2 玻璃形成的热力学条件●3.6.3 玻璃形成的动力学条件●3.6.4 玻璃形成的结晶化学条件●(1)键强●(2)键型本章小结无机非金属材料的显微结构从存在形式上讲主要包括晶体结构、非晶体(玻璃态)结构孔结构及它们不同形式且错综复杂的组合或复合。
它的所有性能都是其内部微观结构在一定的外界因素作用下的综合反映。
所以,有关无机非金属材料的学习和研究也要同其它任何材料一样,着重理顺材料的结构(组成)、工艺(合成)、性质(性能)和效能及其相互之间的关系。
广义上的硅酸盐材料几乎包含了所有无机非金属材料,所以掌握结构较为复杂的硅酸盐晶体就显得尤为重要。
通常可以从基本结构单元的构造(包括配位数和配位多面体及其连接方式)、基本结构单元之间的连接、晶胞分子数、空隙的填充情况、同晶取代等方面来说明或揭示硅酸盐晶体的微观结构及其与晶体宏观性质之间的关系。

§7 无机非金属材料结构7.1 金刚石型结构晶体中各原子以共价键结合,构成正四面体,键角是109度,如:C,Si, Ge等。
图2.36 金刚石晶格结构a:晶格结构;b:四面体配位7.2 硅酸盐结构这是陶瓷的主要结构,其结构基本单元是硅氧四面体。
按照硅氧四面体在空间的不同连接方式,硅酸盐结构可分为:(1)链状结构:该结构中硅氧四面体共有一个氧,连接成链状,如石棉纤维;图2.37 链状硅氧四面体a:单链;b:双链(2)层状结构:该结构中硅氧四面体连接成片状,许多片叠合在一起形成层状,层之间以分子间作用力结合,由于该作用力小而容易裂开,如滑石、云母等;图2.38 层状硅氧四面体a:立体图;b:投影图(3)网状结构:该结构中硅氧四面体在三维方向上相互结合,形成网状结构,如石英,由于结合力强而质地坚硬。
7.3 玻璃结构玻璃是由熔融体过冷而形成的非晶结构透明固体材料,在结构上具有长程无序、短程有序的特点,热力学上具有亚稳性,存在熔融态向玻璃态转变的渐变性。
关于玻璃结构的理论,主要有两种学说:(1)无规则网络学说:玻璃是由离子多面体构成,它们之间通过公共氧搭桥作三维无规则连续排列,形成空间网络结构;(2)晶子学说:认为玻璃是由晶子构成,晶子是与该玻璃成分一致的晶态化合物,但尺寸远小于一般的晶粒。
有关玻璃态的形成机制,尚待进一步的研究探讨。
图2.39 石英晶体与石英玻璃结构对比a:石英晶体;b:石英玻璃7.4 氧化物和非氧化物结构氧化物和非氧化物的结构主要取决于:a)阴阳离子的电荷(决定化学式);b)阴阳离子的半径(决定阳离子周围最近邻阴离子的配位数)。
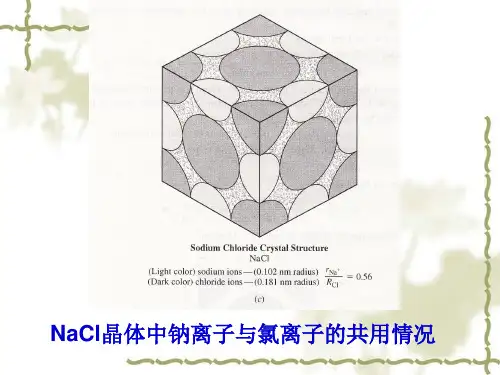
典型的结构有:(1)NaCl结构:又称岩盐型结构,属于立方晶系,面心立方点阵,是典型的离子晶体,氯离子形成密堆的面心立方晶格,钠离子占据其八面体间隙,如:NaCl,KCl,LiF,KBr,NaI,MgO,CaO,BaO等。
(2)CsCl结构:属于立方晶系,简单立方点阵,铯离子处于氯离子的正六面体间隙位置,如:CsCl,LiHg,LiAl,MgTl等。
一概述1.材料是人类社会所能接受的、可经济地制造有用物品的物质。
材料性能关系到材料的应用材料含义在于应用,材料的什么决定应用的概念和设计,决定了应用的基础——综合的性能决定最终产品的形态和应用……2.材料研究的核心问题:以材料的结构和性能为研究对象,并重点研究结构与材料性能之间的关系,为材料性能的改进和新材料的开发提供指导。
3材料结构层次:原子结构,晶体结构——功能材料密切相关;显微结构,微观组织——结构材料密切相关;宏观结构——复合材料相关;、4材料的电子结构——指材料中的电子分布和状态,它不同于单个的分子和原子的电子结构,因为这两者不是长程的完整的材料。
它是决定材料晶体结构的主要和本质原因。
5. 电子波动反映到原子中,为驻波。
6.现代材料结构和性能测量的重要原理和基础:X光衍射和电子显微技术——微观结构,磁性分布和能隙空间分布等等,其中大都以微观过程或性能直接体现了量子效应和作用……7.量子理论是解决电子结构的惟一工具。
是以能量的量子化和波函数概念为核心的,可依照薛定额方程确定的第一性原理分析方法。
二、晶体结构1晶体的特征:均匀性;各向异性;自发地形成多面体外形;晶体具有明显确定的熔点;晶体的对称性;晶体对X射线的衍射;2晶体的宏观特性是由晶体内部结构的周期性决定的,即晶体的宏观特性是微观特性的反映。
3晶体结构即晶体的微观结构,是指晶体中实际质点(原子、离子或分子)的具体排列情况4晶体与非晶体的最本质差别在于组成晶体的原子、离子、分子等质点是规则排列的(长程序),而非晶体中这些质点除与其最近邻外,基本上无规则地堆积在一起(短程序)。
晶体与非晶体之间的主要差别在于它们是否有三维长程点阵结构。
5晶体――原子或原子团、离子或分子在空间按一定规律呈周期性地排列构成的固体6固体分类(按结构)――晶体: 长程有序;非晶体: 不具有长程序的特点,短程有序;准晶体: 有长程取向性,而没有长程的平移对称性。
7在晶体中适当选取某些原子作为一个基本结构单元,这个基本结构单元称为基元,基元是晶体结构中最小的重复单元,基元在空间周期性重复排列就形成晶体结构。