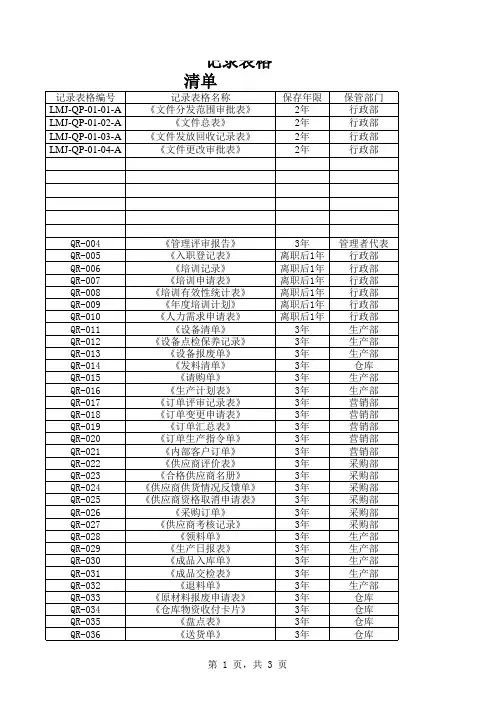
文件更改记录表
- 格式:doc
- 大小:46.50 KB
- 文档页数:2


质量管理体系文件更改记录一、更改记录的定义更改记录是指在质量管理体系文件中对文件更改进行记录和跟踪的的文件。
它包含了文件更改的详细信息,例如更改时间、目的、内容、责任人等。
更改记录的目的是为了确保质量管理体系文件的准确性、完整性和实效性。
二、更改记录的目的1.跟踪文件更改历史:通过更改记录,可以清晰地了解每个文件的修改历史,包括何时有修改、修改的目的和内容等,以便轻松跟踪和检索相关信息。
2.确保文档的一致性:通过更改记录,可以确保质量管理体系文件的各个版本保持一致性,避免出现对同一文件的多次修改或冲突修改。
3.提供修改依据:更改记录可以为文件的修改提供依据和参考,使修改人员了解之前的修改情况,从而做到修改的连贯性和系统性。
4.便于审核和追溯:通过更改记录,审计员可以清晰地看到质量管理体系文件的修改历史,了解文件的修改情况,以便进行审核和追溯。
三、更改记录的内容更改记录包括但不限于以下内容:1.文件编号和名称:记录被修改的文件的编号和名称,使其易于辨认和检索。
2.更改时间:记录每次文件更改的具体时间,确保修改的顺序和时间线索。
3.更改目的:简要描述每次修改的目的和原因,使修改人员了解修改的意图。
4.更改内容:详细描述每次修改的具体内容,包括新增、删除、修改和移动等,使修改人员了解修改的具体细节。
5.责任人:记录每次修改的责任人,明确修改的责任和权益。
6.审核和批准:记录每次修改的审核和批准人员,确保修改符合规定的审批程序和要求。
四、更改记录的管理更改记录应由质量管理部门或专门的文件管理部门进行管理,并按照一定的流程和规定进行操作。
具体管理步骤如下:1.创建更改记录:在每次文件更改时,负责人员应创建相应的更改记录,并填写相关信息。
2.审核和批准:更改记录应经过负责人的审核和上级管理层的批准,确保修改符合规定的审核程序。
3.审查与存档:质量管理部门应定期审查更改记录的完整性和准确性,并将其存档,以备将来的参考和追溯。

申请发放理由文件和资料管理程序□新文件发行□更改换发说明:□遗失补发□破损换发□其它发放部门数量(份) 领用文件(签名) 领用日期旧文件回收(签名) 回收日期总经理1副总经理1管理者代表1行政人事1生产部1品管部1生产部(采购) 1生产部(仓库) 1业务部(业务) 1技术部1备注生效日期人事部和文控共用一套文件2022.12.05申请发放理由质量记录管理程序□新文件发行□更改换发□遗失补发□破损换发□其它说明:发放部门数量(份) 领用文件(签名) 领用日期旧文件回收(签名) 回收日期总经理1副总经理1管理者代表1行政人事1生产部1品管部1生产部(采购) 1生产部(仓库) 1业务部(业务) 1技术部1备注生效日期人事部和文控共用一套文件2022.12.05申请发放理由供应/外包商评价程序□新文件发行□更改换发□遗失补发□破损换发□其它说明:发放部门数量(份) 领用文件(签名) 领用日期旧文件回收(签名) 回收日期总经理1副总经理1管理者代表1行政人事1生产部1品管部1生产部(采购) 1生产部(仓库) 1业务部(业务) 1技术部1备注生效日期人事部和文控共用一套文件2022.12.05申请发放理由顾客满意度评价程序□新文件发行□更改换发□遗失补发□破损换发□其它说明:发放部门数量(份) 领用文件(签名) 领用日期旧文件回收(签名) 回收日期总经理1副总经理1管理者代表1行政人事1生产部1品管部1生产部(采购) 1生产部(仓库) 1业务部(业务) 1技术部1备注生效日期人事部和文控共用一套文件2022.12.05NO.申请发放理由发放部门总经理副总经理管理者代表行政人事生产部品管部生产部(采购) 生产部(仓库) 业务部(业务) 技术部内部质量体系审核管理程序□新文件发行□更改换发说明:数量(份) 领用文件(签名)1111111111□遗失补发领用日期□破损换发□其它旧文件回收(签名) 回收日期备注生效日期人事部和文控共用一套文件2022.12.05申请发放理由不合格品管理程序□新文件发行□更改换发□遗失补发□破损换发□其它说明:发放部门数量(份) 领用文件(签名) 领用日期旧文件回收(签名) 回收日期总经理1副总经理1管理者代表1行政人事1生产部1品管部1生产部(采购) 1生产部(仓库) 1业务部(业务) 1技术部1备注生效日期人事部和文控共用一套文件2022.12.05申请发放理由纠正和预防措施管理程序□新文件发行□更改换发□遗失补发□破损换发□其它说明:发放部门数量(份) 领用文件(签名) 领用日期旧文件回收(签名) 回收日期总经理1副总经理1管理者代表1行政人事1生产部1品管部1生产部(采购) 1生产部(仓库) 1业务部(业务) 1技术部1备注生效日期人事部和文控共用一份文件. 2022.12.05。

怎么完成修订记录
修订记录是记录某个文档、文件或产品的修订历史和内容的文件。
它是非常重要的,因为它可以追踪和记录所有更改的细节,以便人们可以查看和了解它们。
以下是如何完成修订记录的步骤:
1. 创建修订记录表格。
在表格中,您应该包括以下内容:修订
日期、版本号、修订说明、修订人员、审核人员、批准人员等信息。
2. 向修订记录表格中添加新的修订。
每次进行修订时,您都应
该添加一个新的修订行。
在行中,您需要填写修订日期、版本号、修订说明、修订人员、审核人员和批准人员等信息。
3. 更新修订记录表格。
您应该确保修订记录表格保持最新状态。
每次进行修改后,您都应该更新表格,并将其保存在某个易于访问的位置,以便需要时查看。
4. 分享修订记录。
修订记录表格应该与所有相关人员共享。
这样,他们可以查看和了解所有更改的细节,以便在需要时进行参考。
5. 审核修订记录。
您应该确保修订记录表格中的每个修订都是
正确的、准确的和完整的。
如果发现任何错误或遗漏,您应该进行相应的更正和更新。
完成修订记录可能需要花费一些时间和精力,但它非常重要。
通过创建并维护修订记录表格,您可以确保所有更改都得到了记录和跟踪,从而使整个过程更加透明和可靠。
- 1 -。

文件更改申请表
编号:001 表码:HBM/BD—4—0
文件更改申请表
编号:002 表码:HBM/BD-4—00
宜兴市恒保乳胶制品有限公司
文件更改申请表
宜兴市恒保乳胶制品有限公司
文件更改申请表
编号:004 表码:HBM/BD—4—0
文件更改申请表
编号:005 表码:HBM/BD—4-00
宜兴市恒保乳胶制品有限公司
文件更改申请表
编号:006 表码:HBM/BD—4—0
宜兴市恒保乳胶制品有限公司
文件更改申请表
编号:007 表码:HBM/BD-4—00
宜兴市恒保乳胶制品有限公司
文件更改申请表
编号:008 表码:HBM/BD—4-00
宜兴市恒保乳胶制品有限公司
文件更改申请表
宜兴市恒保乳胶制品有限公司
文件更改申请表
编号:009 表码:HBM/BD—4-00。
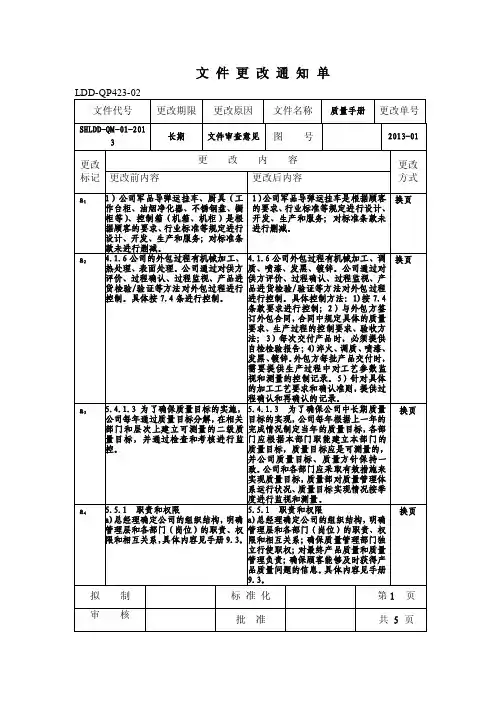


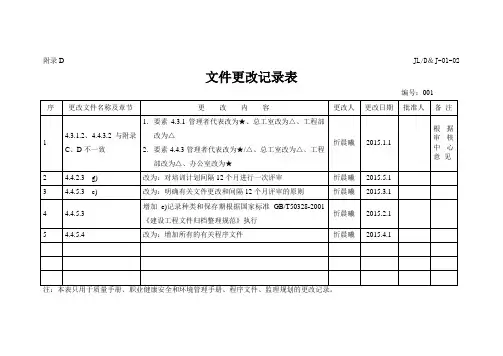

文件修订和更改记录
文件修订和更改记录是用于追踪文件变更的重要工具,它可以帮助组织维护文件的准确性和一致性。
以下是文件修订和更改记录的基本步骤:
1. 确定文件范围和重要性:在开始文件修订和更改记录之前,需要确定需要修订和记录变更的文件范围。
这可能包括政策、程序、标准、技术文档等。
对于关键性文件,如质量手册、操作程序等,需要特别关注。
2. 确定记录要求:根据组织的需求和标准,确定文件修订和更改记录的要求。
这可能包括记录更改的内容、日期、更改人员的签名等。
3. 制定文件控制程序:制定文件控制程序,明确文件的发放、更改、审查和撤销等操作流程。
这有助于确保文件的准确性和一致性,并防止无效或过时的文件的使用。
4. 实施文件审查和变更程序:定期进行文件审查,以评估文件的适用性和有效性。
当文件需要变更时,应遵循规定的程序进行修改,并确保所有相关人员都了解变更的内容和影响。
5. 记录文件修订和更改:在文件修订和更改过程中,应详细记录更改的内容、日期、更改人员的签名等信息。
这有助于追踪文件的变更历史,并为未来的审查和审计提供证据。
6. 维护文件修订和更改记录:确保文件的修订和更改记录得到妥善保管。
这可以包括将记录保存在电子文档管理系统或纸质文件夹中,以便于未来查阅和使用。
7. 培训员工:为员工提供文件修订和更改记录的培训,以确保他们了解并遵循组织的文件控制程序。
通过以上步骤,组织可以有效地追踪和管理文件的修订和更改记录,确保文件的准确性和一致性,并提高组织的管理水平和工作效率。
程序文件修改记录与流程图1目的对检测方法进行确认,以确保采用的检测方法满足客户要求和预期的使用要求并保证检测方法在应用时的协调一致。
2适用范围本程序使用于公司对检测方法的变更和偏离进行的确认。
3职责3.1总经理负责批准实验室检测方法的变化和偏离的实施;3.2 技术负责人负责组织实施对检测方法的变化和偏离的确认;3.3 检测一、二室负责实施检测方法的变化和偏离的确认;4工作程序4.1方法的偏离和变化4.1.1当客户提出偏离检测标准、规范中规定的方法时,合同评审时应与客户就方法中变动部分进行书面的约定,并明示可能存在的风险。
4.1.2当公司确定检测中需要偏离检测标准、规范中规定的方法时,合同评审时应以书面方式告知客户并说明偏离的原由、可能存在的问题和可能存在的风险,并征得客户的书面同意。
4.1.3技术负责人负责组织检测一、二室对偏离的检测标准、规范中规定的方法进行必要的确认,以确定偏离的方法满足预期使用要求的能力和可行性;4.1.4 国家、行业颁布的检测标准、规范中规定的方法发生性质变化,技术负责人负责组织相关部门实施确认。
4.1.5 任何对检测标准、规范中规定的方法偏离或变化,办公室应及时通知检测一、二室负责人。
4.2本公司需要进行方法确认的范围包括:a) 国家、行业颁布的检测标准中方法的性质发生变化;b) 对检测标准、规范中的方法实施偏离;c) 超出其预定范围使用的标准方法;d) 经过扩充和更改的标准方法;4.3确定方法性能的技术(确认的方法)可采用《检测结果质量控制程序》中的方法。
4.4方法确认的实施4.4.1各部在开展检测工作时,采用满足客户需要并适用于所进行的检测的方法,优先使用国际、区域或国家标准发布的方法,并确保使用最新有效版本。
如客户指定的方法不合适或已过期时,通知客户。
4.4.2当缺乏检测细则会造成检测人员对标准、规范理解不同、操作方法不同、判断不同而影响检测质量时,各部应依据标准、规范编制检测细则。