第三章 硅酸盐分析
- 格式:ppt
- 大小:1.56 MB
- 文档页数:95

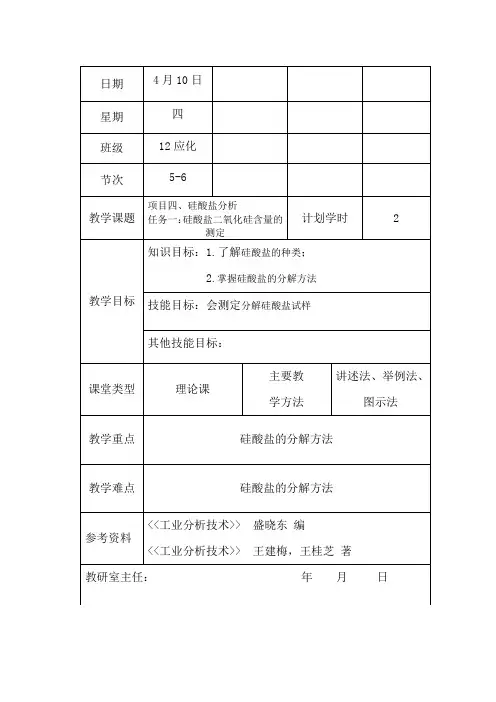
日期4月10日星期四班级12应化节次5-6教学课题项目四、硅酸盐分析任务一:硅酸盐二氧化硅含量的测定计划学时 2教学目标知识目标:1.了解硅酸盐的种类;2.掌握硅酸盐的分解方法技能目标:会测定分解硅酸盐试样其他技能目标:课堂类型理论课主要教学方法讲述法、举例法、图示法教学重点硅酸盐的分解方法教学难点硅酸盐的分解方法参考资料<<工业分析技术>> 盛晓东编<<工业分析技术>> 王建梅,王桂芝著教研室主任:年月日教学内容及过程设计一、水分的测定水分可分为吸附水和化合水。
1、吸附水吸附水在105 ~110℃下烘2h,称重测定。
2、化合水化合水包括结晶水和结构水两部分。
结晶水是以H2O分子状态存在于矿物晶格中,如石膏CaSO4·2H2O。
结晶水通常在300 ℃以下灼烧即可排出。
结构水是以化合状态的氢或氢氧根存在于矿物的晶格中,需加热到300 ~1300℃才能分解而放出。
化合水的测定方法有重量法、气相色谱法、库仑法等。
二、烧失量的测定烧失量又称为灼烧减量,是试样在1000 ℃灼烧后所失去的质量。
烧失量主要包括化合水、二氧化碳、和少量的硫、氟、氯、有机质等。
烧失量是试样中各组分在灼烧时的各种化学反应所引起的质量增加和减少的代数和。
因此,当试样较为复杂时,一般不测烧失量。
三、二氧化硅含量的测定1、氯化铵重量法(1)原理试样用无水Na2CO3烧结,使不溶的硅酸盐转化为可溶性的硅酸钠,用盐酸分解熔融块。
Na2SiO3+2HCl=H2SiO3+2NaCl再加入固体氯化铵,在沸水浴上加热蒸发,使硅酸脱水析出,沉淀用滤纸过滤后,灼烧,得到含有铁、铝等杂质的不纯二氧化硅。
用HF处理沉淀,使其中的SiO2以SiF4形式挥发,失去的质量即为纯SiO2的质量。
SiO2 + 6HF = H2SiF6 + 2H2OH2SiF6 = SiF4 ↑+ 2HF再用分光光度法测定滤液中可溶性的SiO2的量,二者之和即为SiO2的总量(GB/T176-1996中规定的基准法)。



硅酸盐的快速分析法硅酸盐是非常常见的硅氧化合物之一,主要广泛分布于地壳当中,它不但是化工原料,而且是大部分岩石矿物的主要构成成分,广泛应用于科研领域和工业生产领域。
本文中,主要分析了硅酸盐的化学成分,并针对如何系统分析岩石矿物中的硅酸盐提出新的研究和设计方法,即微波消解法,这种方法可以迅速分析和分解岩石试样,一方面确保分析的准度和精度,另一方面有效提升分析效率。
通过实验可以发现,微波消解法不但简单高效,而且有助于提升工业生产水平,可以在工业生产中大量适用。
【关键词】岩石矿物;硅酸盐;微波消解法;研究设计在分析岩石矿物中硅酸盐成分的过程中,需要对非常多的元素项目进行测定,而且分析过程相当复杂,通常情况下,在判断和分析矿物中硅酸盐成分时,需要采用屏蔽、分离以及分解等各种手段,以在保证分析效率的同时降低矿物试样用量,同时避免测定结果收到干扰元素的影响。
目前而言,分析硅酸盐的主要方法是以重量法为基础,只经过一次样品就能够测定三氧化二铁、三氧化二铝以及二氧化硅等各种成分,主要有四个步骤:一是分解试样;二是分离成分;三是测定成分;四是依次重复测定多种成分。
一般而言,以原子吸收分光光度法为基础的快速分析、酸溶快速分析以及碱溶快速分析是比较常见的快速分析方法。
这三种方法的优势各不相同,以原子吸收分光光度法为基础的快速分析法能够对五氧化二磷和二氧化钛等化合物进行分析和测试;酸溶快速分析法能够第一时间测定和分离二氧化硅;而碱溶快速分析法能够第一时间测定和分离氧化钠与氧化钾。
但是,这三种方法都具备相同的缺点,就是流程比较复杂繁琐,不适用于工业生产和控制。
因此,笔者提出微波消解法,一方面能够进一步提升分析岩石矿物中硅酸盐成分的水平和效率,另一方面也有助于推动盐酸盐分析技术在工业中的发展。
一、实验仪器及材料(一)实验仪器本实验的实验仪器主要是家用微波炉,功率最好为1200瓦,可以选用苏泊尔和美的等知名品牌。
(二)实验材料实验材料主要包括实验岩石樣本、实验试剂以及实验器材三大部分:具体而言,实验岩石样本方面,主要包括水泥生料、普通硅酸盐水泥以及水泥熟料;实验试剂方面,主要包括EDTA标样、浓度为90%的KOH溶液,CMP指示剂、三乙醇胺以及浓度为36%的盐酸,其中,CMP指示剂是指甲基百里香酚蓝——钙黄绿素——酚酞混合物;实验器材主要包括混合搅拌机、离心机以及水晶玻璃试管等。






项目一:水泥熟料中SiO2、Fe2O3、Al2O3、CaO和MgO含量的测定(一)硅酸盐分析的项目和意义硅酸盐分析在国民经济中具有十分重要的意义。
在地质学中矿物质的定名需要全分析结果,根根据岩石全分析结果了解,岩石内部的含量变化、元素在地壳内部的迁移情况和变化规律、元素的集中和分散。
工业生产过程中常常需要对原料、中间产品、产品和废渣等进行与岩石分析相类似的全分析。
(二)实验原理水泥主要由硅酸盐组成。
水泥熟料是由水泥生料经1400℃以上的高温煅烧而成的。
一般的水泥由水泥熟料加入适量的石膏组成。
要控制水泥的质量,可通过水泥熟料的分析得以实现。
检验水泥熟料质量和烧成情况的好坏,根据分析结果,可及时调整原理的配比以控制生产。
水泥熟料的主要化学成分是SiO2(含量范围18%~24%)、Fe2O3(含量范围2.0%~5.5%)、Al2O3(含量范围4.0%~9.5%)、CaO(含量范围60%~67%)和MgO(含量范围<4.5%)。
(1)试样的分解:水泥熟料中碱性氧化物占60%以上,因此易为酸分解。
水泥熟料主要为硅酸三钙、硅酸二钙、氯酸三钙和铁铝酸四钙等混合物。
这些化合物与盐酸作用时,生成硅酸和可溶性的氯化物,分析如下:4Ca O·Al2O3·Fe2O3+20HCl→4CaCl2+2AlCl3+2FeCl3+10H2O硅酸是一种无机酸,在水溶液中绝大部分以溶胶状态存在,其化学反应以SiO2·H2O 表示。
再用浓酸和加热蒸干等方法处理后,能是绝大部分硅酸水溶胶脱水成水凝胶析出,因此可以利用沉淀分离的方法把硅酸与水泥中的铁、铝、钙、镁等其它组分分开。
(2)SiO2测定的原理:本实验中以重量法测定SiO2的含量。
在水泥熟料经酸分解后的溶液中,采用加热蒸干和加固体氯化铵两种措施,是水溶性胶状硅胶尽可能全部脱水析出。
蒸发脱水是将溶液控制在100~110℃温度下进行,在水浴或电热板上加热10~15分钟。
硅酸盐全分析一、样品前处理过程准确称取样品0.5g,加入5~6g NaOH①,用银坩埚在500~600℃②熔融20~30分钟③。
冷却后脱埚(放入100ml水中分别用蒸馏水和硝酸(1+20)④反复清洗坩埚3~4次)。
在搅拌下一次⑤加入25ml⑥浓盐酸溶解熔块浸出物。
再加入1~2ml 硝酸(1+1)⑦煮沸,得澄清试液,冷却至室温,最后定容至250ml。
①熔融过程中所需药品为优级纯(GR)或分析纯(AR)。
②铁矿石熔融需在600~700℃下,50~60分钟。
③熔融过程中应注意溶剂“爬埚”。
④可用胶头棒清洗。
硝酸尽量少用,防止银被溶解。
⑤一次加入可防止粘土类样品中硅胶析出。
石灰石样品应分次加入,防止大量喷出将试液带出。
CO2⑥若为铁矿石,用量为30~35ml。
⑦将Fe2+氧化为Fe3+。
⑧转移过程中应特别注意样品损失。
⑨粘土类及砂分析时称量应少于0.5g,铁粉类分析时称量约为0.3g。
二、元素分析1.硅元素分析上述试液定容后马上①吸出50ml于塑料烧杯中,一次加入15ml浓硝酸②后可待用。
在溶液中加入10ml 15%的氟化钾溶液,搅拌,冷却至室温。
再加入固体氯化钾,搅拌并压碎不溶颗粒,直至饱和。
放置10~15分钟,快速滤纸过滤。
塑料杯及沉淀用5%氯化钾溶液各洗涤2~3次③。
将滤纸连同沉淀置于原塑料杯中,沿杯壁加入10ml 10%氟化钾-乙醇溶液④及两滴酚酞指示剂,用氢氧化钠标准溶液中和未洗尽的酸,仔细搅动滤纸并擦洗杯壁,直至酚酞变为浅红(不计读数)。
后加入沸水⑤至300ml(沸水预先用氢氧化钠溶液中和至酚酞呈微红色),用氢氧化钠标准溶液滴定⑥至微红色并记下读数。
二氧化硅的百分含量:①防止长时间放置后硅胶沉积,使的试液中硅胶分布不均匀,造成测量误差。
②加入浓硝酸可防止硅胶沉积。
③KCl溶液总体积控制在20~25ml,尽量减少氟硅酸钾的水解反应,避免检测结果偏小。
④抑制氟硅酸钾的水解反应,避免检测结果偏小。