电位滴定法测定铁离子含量的应用研究
- 格式:pdf
- 大小:1.44 MB
- 文档页数:2

重铬酸钾电位滴定硫酸亚铁铵溶液用重铬酸钾电位滴定硫酸亚铁溶液一、实验目的1. 学习电位滴定的基本原理和操作2. 熟悉酸度计的使用方法二、实验原理电位滴定法定义: 是根据滴定过程中指示电极电位的突跃来确定滴定终点的一种滴定分析方法。
与直接电位法的区别:定量参数不同;与化学滴定法的区别:确定滴定终点方法不同。
重铬酸钾法电位滴定硫酸亚铁铵溶液中亚铁离子含量2+测定原理:用K2Cr2O7滴定Fe,其反应式如下2- 2++ 2+3+Cr2O7+ 6 Fe + 14H=2Cr + 6 Fe +7H2O利用铂电极作指示电极,饱和甘汞电极作参比电极,与被测溶液组成工作电池。
在滴定过程中,随着滴定剂的加入,铂电极的电极电位发生变化。
在化学计量点附近铂电极的电极电位产生突跃,从而确定滴定终点。
实验装置如右图三、仪器与试剂酸度计移液管(10ml)磁力搅拌器铂电极量筒(10ml)饱和甘汞电极酸式滴定管 0.010mol/L K2Cr2O7标准溶液硫酸亚铁铵溶液二苯胺四、实验内容和步骤1. 用移液管准确移取10ml 硫酸亚铁铵溶液于150ml烧杯中,加入3mol/LH2SO4溶液8~10ml,加水至约50ml,将饱和甘汞电极和铂电极插入溶液中,放入转子,开动搅拌器,待电位稳定后,记录溶液的起始电位,然后用K2Cr2O7标准溶液滴定,每加入一定体积的溶液,记录溶液的电位。
数据记录入下表,绘出E-V曲线,确定终点V1,计算硫酸亚铁铵溶液的准确浓度。
2. 用移液管准确移取10ml 硫酸亚铁铵溶液于150ml烧杯中,加入3mol/LH2SO4溶液8~10ml,加水至约50ml,滴入2滴二苯胺,放入转子,开动搅拌器,然后用K2Cr2O7标准溶液滴定,根据指示剂颜色的变化无色――浅绿――紫色,确定滴定终点,记下消耗的K2Cr2O7标准溶液的体积V2。
五、数据记录和结果分析电位滴定数据记录表V/ml E/mV c/mol?L?1 取平均值c=0.015965mol?L?19.501 686.0 0.015864 9.601 692.0 0.016032 9.582 704.1 0.015999 六、思考题1.为什么氧化还原滴定可以用铂电极作指示电极?2+答:在氧化还原滴定中,Fe 在阳极发生氧化反应,失去电子,电子通过电极和导线传递到阴极,2-Cr2O7在正极得到电子被还原,发生还原反应,所以产生了电流。

游离铁的测定方法下面将介绍几种常用的游离铁测定方法:1.光度测定法:光度测定法是通过测量溶液中游离铁离子的吸光度来确定其浓度的方法。
在可见光或紫外光的特定波长下,Fe2+和Fe3+离子有特征性的吸收峰,可以根据吸光度与浓度的关系建立标准曲线,然后通过测量待测样品的吸光度来计算游离铁离子的浓度。
2.滴定法:滴定法是通过在反应容器中滴加与游离铁离子发生化学反应的可滴定试剂,来确定游离铁离子的浓度。
常见的滴定试剂包括二酸硫-亚砜溶液、酞菁试剂等。
通过观察试剂与铁离子的反应终点出现的颜色变化或指示剂颜色变化,可以确定铁离子的浓度。
3.电位滴定法:电位滴定法是利用电位滴定仪测量游离铁溶液中铁离子浓度的方法。
该方法通过在电位滴定仪中使用电位滴定电极和参比电极,对溶液进行电位滴定。
通过追踪电位滴定曲线,可以确定溶液中铁离子的电位滴定终点从而计算其浓度。
4.原子吸收光谱法(AAS):原子吸收光谱法是一种常用的分析仪器方法,能够测定溶液中微量金属元素的含量,包括游离铁离子。
原理是将铁离子蒸发成原子态,然后通过原子吸收光谱仪测量原子吸收的特征性光谱线。
根据吸收光的强度与样品中的铁离子浓度的关系,可以计算游离铁离子的含量。
5.显色反应法:显色反应法是通过合成其中一种配合物,使游离铁离子与配合物发生显色反应,从而测定游离铁离子的浓度。
常见的配合物包括硫基酚类染料和酞菁类染料等。
通过比色法或分光光度计测量显色反应产生的颜色的吸光度,可以计算游离铁离子的含量。
总结起来,游离铁的测定方法主要包括光度测定法、滴定法、电位滴定法、原子吸收光谱法和显色反应法。
选择合适的方法取决于样品的性质、分析需求和实验条件。
在进行测定时,要严格控制实验条件,确保测定结果的准确性和可靠性。


水溶液中金属离子的分析与检测方法金属离子是指在水溶液中以离子形式存在的金属元素。
金属离子的分析与检测方法是化学分析领域的重要内容之一,它对于环境保护、食品安全、医药研究等领域具有重要的意义。
本文将从常见的金属离子分析方法、仪器设备以及应用领域三个方面进行探讨。
一、常见的金属离子分析方法1. 比色法:比色法是一种常见的金属离子分析方法,它利用金属离子与特定试剂反应后产生的颜色差异来进行分析。
例如,硫化物离子可以与银离子反应生成黑色的硫化银沉淀,从而可以通过比色法来定量分析硫化物离子的浓度。
2. 沉淀法:沉淀法是一种通过金属离子与特定试剂反应生成可见沉淀的方法。
常见的沉淀法有氢氧化物沉淀法、硫化物沉淀法等。
例如,氢氧化物沉淀法可以通过将铁离子与氢氧化钠反应生成棕色的氢氧化铁沉淀,从而定量分析铁离子的浓度。
3. 电化学分析法:电化学分析法是利用电化学原理进行金属离子分析的方法。
常见的电化学分析方法有电位滴定法、极谱法等。
例如,电位滴定法可以通过测定溶液中金属离子的电位变化来定量分析金属离子的浓度。
二、仪器设备1. 原子吸收光谱仪:原子吸收光谱仪是一种常用的金属离子分析仪器,它利用金属离子吸收特定波长的光线来进行分析。
原子吸收光谱仪具有灵敏度高、准确性好的特点,广泛应用于环境监测、食品安全等领域。
2. 离子色谱仪:离子色谱仪是一种专门用于分析离子的仪器,它利用离子交换柱将溶液中的金属离子分离出来,并通过检测器进行定量分析。
离子色谱仪具有高分辨率、高灵敏度的特点,被广泛应用于水质监测、药物分析等领域。
三、应用领域1. 环境保护:金属离子的分析与检测在环境保护中具有重要的作用。
例如,通过分析水体中重金属离子的浓度可以评估水质的安全性,为环境保护决策提供科学依据。
2. 食品安全:金属离子的分析与检测在食品安全领域也具有重要意义。
例如,通过分析食品中的重金属离子含量可以评估食品的安全性,保障公众的健康。
3. 医药研究:金属离子的分析与检测在医药研究中也扮演着重要角色。

食品中铁含量的测定
食品中铁含量的测定是食品质量检测的重要环节,对确定食品的质量水平和安全性具有重要的意义,可以避免由于铁缺乏而引起的营养不良症状。
铁含量的测定方法有分光光度法、比色法和电位滴定法等,其中分光光度法是目前较为常用的测定方法。
其检定原理是以亮度衰减由铁在恒定浓度的影响下发生改变(尤其是φ 530nm ),用该波段的荧光强度(亮度)作为对变量,获得铁的浓度,从而测定食物中的铁含量。
分光光度法测定铁含量的具体步骤如下:首先,将样品经HCl提取液稀释、加氢氧化钠和形成稀释的抗氧化剂混合放置1小时,使样品中的铁离子转化为氢氧化铁;其次,加入固定厌氧剂、形成解离液,加热放置3小时,使溶液中的氢氧化铁转化为离子化合物形成互联耗尽;第三,添加非混合指示剂和固定厌氧剂,制备测定液,然后安装分光光度计;最后,按照操作步骤去测定比较点,检定铁含量。
通过以上步骤,测定食品中的铁含量,不仅能够了解食品的质量水平和安全性,还有助于及时发现食品的潜在缺陷,保障其安全性及新鲜度。

检验铁元素的方法铁是一种常见而重要的化学元素,具有广泛的应用领域。
为了确保铁元素的质量和纯度,常需要进行各种检验方法。
下面将介绍一些常见的检验铁元素的方法。
1.光谱分析法:光谱分析法是一种常用的检验铁元素的方法。
其中,原子吸收光谱(AAS)和原子发射光谱(AES)是较常见的。
原子吸收光谱法基于物质对特定波长的光吸收的原理,可以测定样品中铁元素的含量。
原子发射光谱法则是基于铁元素在放电激发下产生特定波长的光发射的原理进行分析。
2.化学分析法:化学分析法包括湿法和干法两种方法。
湿法分析主要是通过一系列的化学反应,将铁元素转化为可检测到的化合物,从而进行分析。
常用的湿法分析方法包括络合滴定法、加热法等。
干法分析则是通过高温等条件将铁元素氧化或还原,然后用适当的方法进行测定。
3.电化学分析法:电化学分析法是一种基于电化学原理进行分析的方法,主要包括电位滴定法和电解析法。
电位滴定法是利用电位滴定仪对铁离子与其中一种指示剂所形成的复合物进行测定,从而确定铁元素的含量。
电解析法则是利用电解池进行电解反应,通过测量电解产生的电流或电压变化来确定铁元素含量。
4.热分析法:热分析法是一种通过加热样品,测量其在不同温度下的质量或体积变化的方法。
常见的热分析方法包括差热分析(DSC)和热重分析(TGA)。
差热分析是通过比较样品与基准样品在加热或冷却过程中释放或吸收的热量的差异,来判断样品的性质和组成。
热重分析则是测定样品在加热过程中的质量变化,从而推断其中所含的元素成分。
5.物理特性测量:除了化学方法外,物理特性测量也可用于检验铁元素的方法中。
常见的物理特性测量包括密度测量、磁性测量等。
通过测量铁元素的物理特性,如密度和磁性等,可以初步判断其纯度和性质。
综上所述,检验铁元素的方法包括光谱分析法、化学分析法、电化学分析法、热分析法和物理特性测量等。
通过这些方法的应用,可以检验铁元素的纯度、含量以及其他相关性质,确保其质量满足特定要求。

自动电位滴定仪的用途自动电位滴定仪是一种化学分析仪器,可以用于滴定分析、电位测量、标准溶液的制备等多种应用。
自动电位滴定仪具有高精度、高效率、高自动化、易操作等特点,被广泛应用于化学分析、质量控制等领域。
1.普通滴定分析滴定法是一种重要的定量分析方法,可以用于测定样品中含量的多少、溶液中分子的浓度等参数。
传统的手动滴定法虽然简单易行,但是精度受到人为的误差、视觉判定的局限等问题的影响,不能满足现代分析的要求。
自动电位滴定仪采用了自动控制和电位测量技术,能够高精度地完成滴定,提高分析结果的准确性和可靠性。
2.pH值测量自动电位滴定仪可以通过电极测量的方式检测样品的酸碱度(pH值),进一步精细地掌握样品性质和反应条件。
在化学反应、生物学研究、水质监测等领域中,pH值的测量常是必要的。
3.标准溶液的制备在质量控制和分析试验中,标准溶液的制备至关重要。
自动电位滴定仪可以根据设定的分析目标(如溶质的浓度、反应条件等),自动计算标准溶液的配制比例和体积,快速、准确地制备标准溶液,提高了化学分析的效率。
4.互协校准在实验室中进行的分析需要建立一套完善的校准体系,以确保分析结果的准确性和可靠性。
自动电位滴定仪可以采用互协校准的方式,在与其他仪器配合的同时,时时刻刻确保校准的准确性和稳定性。
5.金属离子含量分析自动电位滴定仪可以用于测定水中、土壤中、食品中的微量金属离子,如铜离子、铁离子、锌离子等等。
这些物质的含量对于环境保护、食品质量检测等都有着非常重要的意义。
总之,自动电位滴定仪在化学分析中有着非常重要的用途,既可以实现普通滴定分析、pH值测量、标准溶液的制备等基本功能,又具有自动化程度高、操作简便等特点。
随着科技发展的进步,自动电位滴定仪必将在化学分析和质量控制领域中发挥更加重要的作用。

以抗坏血酸作还原滴定剂电位滴定法测定铁矿石中全铁戚淑芳;张杰;王莹;宁松【摘要】提出了以抗坏血酸作为还原滴定剂、全自动电位滴定仪判定滴定终点的测定铁矿石中全铁的方法.对滴定酸介质和酸度、温度、电位滴定仪参数进行了优化,对干扰元素的影响等进行了试验.结果表明,全铁可在铁矿石溶样的酸介质及酸度下滴定,无需进行酸度调节,滴定的温度范围为50~80℃.采用过氧化氢或过硫酸铵作预氧化剂,过量的预氧化剂煮沸数分钟即可除去,操作简便.铁矿石中大多数元素均不干扰测定,尤其是铜、钼、钒的允许量可达到5%(质量分数).测定结果相对标准偏差(RSD)小于0.2%.对两个铁矿石标准样品进行加标回收试验,得到加标回收率分别为99.6%和100.4%.%The determination method of total iron in iron ore using ascorbic acid as reducing titrant was development. The end point of titration was determined by full-automatic potential titrimeter. The titration acid medium and acidity, temperature, and potential titrimeter parameters were optimized.The influence of interference elements was tested. The results showed that titration of total iron could be carred out in the medium and acidity of dissolving iron ore samples without pH adjustment. The titration temperature range was 50 -80 ℃ . The hydrogen peroxide or ammonium persulfate was used as pre-oxidant. Since the excessive pre-oxidant could be removed by boiling for a few minutes, the operation was easy. The majority elements in iron ores did not intcrfcrc in the determination, especially the tolerant amount of copper, molybdenum and vanadium could be up to 5 % (mass fraction). The relative standard deviation (RSD) of determination results was less than 0.2 % , and the recoveries for two samples were 99. 6% and 100.4 % ,respectively.【期刊名称】《冶金分析》【年(卷),期】2011(031)005【总页数】4页(P63-66)【关键词】抗坏血酸;电位滴定;铁;铁矿石;预氧化;还原滴定【作者】戚淑芳;张杰;王莹;宁松【作者单位】鞍钢股份公司技术中心,辽宁鞍山114009;鞍钢股份公司技术中心,辽宁鞍山114009;鞍钢股份公司技术中心,辽宁鞍山114009;鞍钢股份公司技术中心,辽宁鞍山114009【正文语种】中文【中图分类】O655.29铁矿石中全铁的测定大多采用重铬酸钾滴定法,该法虽经多次改进,但无根本性变化。

263管理及其他M anagement and other研究铁矿石中全铁含量的检测方法刘 星,龚海兰,张 婕,罗 文,邓黄海(新余钢铁集团有限公司,江西 新余 338000)摘 要:随着近年来我国科学技术水平的不断提升,针对于铁矿石全铁含量的检测方式在不断的健全和完善。
目前国内针对铁矿石中全铁含量的检测方式当下主要有EDTA 滴定检测方式、化学研究法以及过氧化钠分解的方式等,针对铁矿石中的全铁含量进行分析具有着巨大的意义。
根据现有的研究发现,使用不同的分析方式对于铁含量所测得的效果具有着一定的不同之处,在进行具体的操作中使用不同的方式也将会遇到不同的阻碍因素,这样一来就导致最终测得的数据具有着一定的差异性以及不稳定性,想要获得更加准确的检测数据和结果,对于不同的检测方式进行展开研究十分的有必要。
本文将根据笔者工作中的研究和探索经验,从铁矿石中的全铁含量检测的价值出发,通过对不同的检测方式的分析,总结和概括了不同检测方式的优越性,希望能够以后的铁矿石中全铁含量检测带来一些可供参考之处。
关键词:铁矿石;全铁含量检测;化学检测法;问题与措施中图分类号:TF521 文献标识码:A 文章编号:11-5004(2020)16-0263-2收稿日期:2020-08作者简介:刘星,女,生于1974年,汉族,江西抚州人,本科,技师,研究方向:化学分析。
随着人们的生活水平的不断提升,当下的铁矿石已经成为了人们生活中不可获取的部分,随着我国近些年的高速发展以及人们对于生活质量的要求在不断的提升,对于当下的铁矿石需求量在急速的增长。
因此,想要更好的满足当下的需求就应该逐步的提升铁矿石的整体质量,不断的改进全铁含量检测的手段。
我国使用的全铁含量检测的方式有多种,不同的检测方式有着其独特的优势之处,同时也有着一定的不足,想要有效的进行检测,相关工作人员进行熟练的操作时必要的环节,这样才可以更好的筛选出更加符合需求的检测方式[1]。

测定铁的化学分析方法1. 引言铁是一种广泛存在于自然界中的金属元素,也是人体必需的矿物质之一。
由于铁的重要性,确定铁含量的精确方法对于许多领域都具有重要意义,如医药、环境监测和冶金工业等。
本文将介绍几种常用的测定铁的化学分析方法。
2. 原理及步骤2.1 重量法重量法是测定铁含量最常用的一种方法。
它基于样品中铁的质量与其含量的直接关系。
具体操作步骤如下: 1. 取适量待测样品,加入适量的溶剂溶解。
2. 将溶解后的样品溶液转移到称量器皿中。
3. 将称量器皿放入烘箱或加热器中,在一定温度下加热,使样品彻底干燥。
4. 取出干燥的样品,放入称量天平中,记录质量。
5. 根据样品的质量和采样方法,计算出样品中铁的含量。
2.2 比色法比色法是通过测量样品中铁离子与某种试剂反应后产生的显色物的吸光度来确定铁含量的方法。
常用的试剂有二氯苯三羧酸、巴黎绿等。
具体操作步骤如下: 1. 取适量待测样品,加入适量的试剂,使铁离子与试剂反应生成显色物。
2. 使用分光光度计测量显色物的吸光度,记录结果。
3. 根据标准曲线,计算出样品中铁的含量。
2.3 电化学法电化学法是利用电化学技术测定铁含量的一种方法,常用的有电镀析法和电位滴定法。
具体操作步骤如下: 1. 对于电镀析法,将待测样品作为阳极,以电解液中的铁离子作为阴极,通过电流使铁离子电镀析为铁金属。
2. 对于电位滴定法,利用滴定电位表确定滴定终点,滴定时向待测样品中滴加滴定液直到滴定终点,记录滴定液体积。
3. 根据电流量或滴定液体积,计算出样品中铁的含量。
2.4 其他方法除了上述常用的方法外,还有一些其他方法可以用于测定铁的含量。
例如,原子吸收光谱法、荧光光谱法等。
这些方法通常需要先对样品进行预处理和仪器设备较为复杂,适用于专业实验室和科研领域。
3. 结果与讨论根据不同的测定方法,可以得到样品中铁的含量。
不同方法的优缺点也不同。
重量法简单易操作,适用于一般实验室;比色法快速准确,适用于大批量样品测定;电化学法准确度高,适用于痕量铁的测定。
检验3价铁离子的方法随着工业化进程的推进,环境中3价铁离子(Fe3+)的含量不断增加,对人类健康构成了比较大的威胁。
因此,检测环境中Fe3+含量是环境污染防治方面很重要的工作之一。
本文主要总结Fe3+的检测方法及其特点,以期提供科学依据,为今后的环境污染防治工作提供参考依据。
Fe3+的检测方法可以分为化学法和物理法两大类。
一是化学检测法,有以下几种:1.位滴定法:这是一种使用电位滴定的Fe3+的测定方法,常用的指示剂有正硫酸钠、磷酸钠等。
它的优点是快速、性价比高。
2.化-还原滴定法:目前这种方法被广泛应用于Fe3+检测,特别是检测水环境中Fe3+的含量。
它的优点是准确度高,但操作较复杂。
3.效液相色谱法:该方法用于测定Fe3+的浓度,使用标准品与测试样本作比较,而且可以连续测量多种不同浓度的Fe3+。
它的优点是灵敏度高,仪器投资小。
二是物理检测法,有以下几种:1.电元件测定:这是一种使用特定光电元件的Fe3+检测方法,可以根据光电元件反应来直接测定Fe3+配合物的浓度。
它的优点是测量结果准确,操作简单。
2.位探头探测法:这种检测方法可以检测Fe3+在液体、气体中的含量,它的优点是仪器投资低,实施起来也比较方便。
3.谱检测法:这是一种常用的环境检测方法,可以测定Fe3+的吸光度和发射率,从而测定Fe3+的浓度。
它的优点是分析准确,但是仪器实施及管理比较复杂,投资较大。
综上所述,Fe3+的检测方法有众多,各有特点。
在实际应用中,应根据实际情况选择合适的检测方法,并配备高质量的仪器和设备,以确保Fe3+的检测准确可靠。
另外,应定期对该检测方法进行定期校准,以确保检测结果的可靠性。
环境的污染问题一直困扰着人类,因此检测各种环境污染物是很必要的。
Fe3+是环境污染物之一,其含量的检测是非常重要的。
以上就是Fe3+的检测方法,希望能提供科学依据,为今后环境污染防治工作提供参考依据。
检验2价铁离子的方法2价铁离子是一种重要的无机离子,它在环境监测、工业生产和生物学研究中具有重要的应用价值。
因此,准确、快速、可靠地检验2价铁离子的方法对于相关领域的研究和实践具有重要意义。
本文将介绍几种常用的检验2价铁离子的方法,以供参考。
首先,最常见的检验2价铁离子的方法之一是分光光度法。
该方法利用2价铁离子在特定波长下的吸光度特性来进行检测,通过测定样品在特定波长下的吸光度值,然后与标准曲线进行比对,从而得出2价铁离子的浓度。
这种方法具有操作简便、灵敏度高、准确性好的特点,因此在实际应用中得到了广泛的应用。
其次,还可以利用电化学方法来检验2价铁离子。
电化学方法主要包括电位滴定法、循环伏安法等。
其中,电位滴定法是通过测定2价铁离子在电极上的电位变化来确定其浓度,而循环伏安法则是利用2价铁离子在电极上的氧化还原反应特性来进行检测。
这些方法具有操作简便、灵敏度高、实时性强的特点,适用于实时监测和追踪2价铁离子的浓度变化。
另外,还可以利用色度法来检验2价铁离子。
色度法是通过2价铁离子与某种试剂发生显色反应,然后根据显色反应的强度来确定2价铁离子的浓度。
这种方法具有操作简便、成本低廉的特点,适用于大批量样品的检测。
除了上述方法外,还可以利用质谱法、原子吸收光谱法等先进的分析技术来检验2价铁离子。
这些方法具有高灵敏度、高分辨率、多元素同时检测等优点,适用于对2价铁离子进行精准、全面的分析。
综上所述,检验2价铁离子的方法多种多样,可以根据实际需要选择合适的方法进行检测。
在实际应用中,需要根据样品的性质、测定的灵敏度要求、设备的条件等因素综合考虑,选择最适合的检验方法。
希望本文介绍的方法能够对相关领域的研究和实践提供一定的参考价值。
二价铁离子的检验方法和离子方程式
一价铁离子(Fe+)是某些有机物和无机物的一部分,它的存在可以改变物质的性质。
因此,了解一价铁离子的浓度对于许多应用非常重要,可以帮助研究人员更好地提取和处理物质,从而改善质量控制。
由于一价铁离子的检测复杂度较高,因此需要采用特定的检测方法来检测。
一种常用的一价铁离子检测方法是电位滴定法。
在这种方法中,无色、无味的Fe+离子被滴进一种乙酸铁溶液中,然后用不可用(不可饮用)电极测量溶液的pH值。
当滴定的pH 值达到7-9之间的准确值时,就可以确定溶液中的Fe+含量。
其中,Fe3 +离子可以通过色谱气相色谱仪进行检测。
此外,也可以使用其他检测方法来测定一价铁离子,如发光光度法、偶氮受体测定法、分光光度法等。
除了在实验室中,这些方法也可以在实际应用中使用,比如在水处理系统中,可以使用DO滴定来检测Fe + 离子。
一价铁离子的离子方程式为:Fe + = Fe 2+ + 2e - 。
在这个方程式中,Fe +表示一价铁离子,Fe 2+表示二价铁离子,而2e -则表示2颗电子。
因此,可以将Fe +离子转化为Fe 2+离子的还原反应。
综上所述,电位滴定法是检测一价铁离子的最常用方法,当一价铁离子被转化为二价铁离子时,它的离子方程式为Fe + = Fe 2+ + 2e - 。
如果要精确检测一价铁离子,还可以使用其他检测方法,如发光光度法、偶氮受体测定法、分光光度法等。
ic滴定法定量测试金属材料元素成分摘要:一、引言二、IC 滴定法的原理和特点三、IC 滴定法在金属材料元素成分定量测试中的应用四、IC 滴定法的优势与局限性五、结论正文:一、引言金属材料在我国的工业发展中具有举足轻重的地位,其性能、质量和使用寿命等方面都与其元素成分紧密相关。
因此,对金属材料元素成分的定量测试至关重要。
近年来,IC 滴定法作为一种可靠的定量分析方法,在金属材料元素成分的检测领域得到了广泛应用。
本文将对IC 滴定法的原理、特点以及在金属材料元素成分定量测试中的应用进行探讨。
二、IC 滴定法的原理和特点IC 滴定法,即电位滴定法,是一种基于电位滴定原理的定量分析方法。
它通过测量溶液中离子活度与电位之间的关系,实现对溶液中离子浓度的准确测定。
IC 滴定法的主要特点有以下几点:1.高精度:IC 滴定法可以准确测量溶液中的离子活度,从而实现高精度的定量分析。
2.广泛适用性:IC 滴定法适用于多种类型的金属材料,包括钢铁、铝合金、铜合金等。
3.简便快捷:IC 滴定法操作简便,测试速度快,能够满足工业生产中对效率的要求。
4.可靠性高:IC 滴定法不受试样颜色、浊度等物理性质的影响,因此具有较高的可靠性。
三、IC 滴定法在金属材料元素成分定量测试中的应用IC 滴定法在金属材料元素成分定量测试中的应用主要包括以下几个方面:1.钢铁中元素成分的测定:IC 滴定法可以准确测定钢铁中的锰、镍、钼等元素的含量,有助于优化钢铁的性能和质量。
2.铝合金中元素成分的测定:IC 滴定法可以有效地测定铝合金中的硅、镁、锌等元素的含量,为铝合金的生产和应用提供数据支持。
3.铜合金中元素成分的测定:IC 滴定法可以精确测量铜合金中的镍、钴、锌等元素的含量,有助于提高铜合金的导电性和抗腐蚀性能。
四、IC 滴定法的优势与局限性IC 滴定法在金属材料元素成分定量测试中具有显著的优势,但同时也存在一定的局限性:1.优势:IC 滴定法具有高精度、广泛适用性、简便快捷和可靠性高等优点,可以满足金属材料元素成分的定量测试需求。
高锰酸钾滴定二价铁离子,电位计算【实用版】目录一、高锰酸钾滴定二价铁离子的基本原理二、电位计算在高锰酸钾滴定二价铁离子中的应用三、高锰酸钾滴定二价铁离子的实验步骤与注意事项四、结论正文一、高锰酸钾滴定二价铁离子的基本原理高锰酸钾滴定法是一种氧化还原滴定法,主要用于测定水溶液中二价铁离子的含量。
在滴定过程中,高锰酸钾作为氧化剂,可以将二价铁离子氧化为三价铁离子。
通过测定消耗的高锰酸钾的量,可以计算出二价铁离子的含量。
该方法操作简便,结果准确,被广泛应用于水质检测、环境保护等领域。
二、电位计算在高锰酸钾滴定二价铁离子中的应用在高锰酸钾滴定二价铁离子的过程中,电位计算起到了关键作用。
电位计算是基于电极电位的原理,通过测量滴定过程中电极电位的变化,可以确定滴定终点。
在高锰酸钾滴定二价铁离子的实验中,通常采用银/氯化银电极作为参比电极,高锰酸钾电极作为指示电极。
在滴定过程中,随着二价铁离子被氧化为三价铁离子,高锰酸钾电极的电位发生变化,当电位变化达到一定值时,表明滴定终点已到达。
三、高锰酸钾滴定二价铁离子的实验步骤与注意事项1.实验步骤(1)准确称取一定质量的试样,加入适量的缓冲溶液,充分混合。
(2)将试样溶液倒入滴定管中,加入适量的高锰酸钾溶液,进行滴定。
(3)在滴定过程中,观察高锰酸钾电极的电位变化,当电位变化达到滴定终点时,记录消耗的高锰酸钾溶液的体积。
(4)根据消耗的高锰酸钾溶液的体积,计算出试样中二价铁离子的含量。
2.注意事项(1)在实验过程中,应保持试样和滴定溶液的温度一致,以减少温度对电位测量的影响。
(2)滴定过程中,应注意观察电极电位的变化,确保准确判断滴定终点。
(3)实验结束后,应及时清洗滴定管和电极,避免污染。
四、结论高锰酸钾滴定法是一种准确、简便的测定二价铁离子含量的方法。
通过电位计算,可以判断滴定终点,从而得出二价铁离子的含量。
第5期2018年10月No.5 October,2018金属材料受周围介质的作用而损坏,称为金属的腐蚀,腐蚀现象非常普遍,其中用量最大的金属—铁制品的腐蚀最为常见。
常见的铁的腐蚀分为析氢腐蚀和吸氧腐蚀。
而在酸性较强的溶液中发生电化学腐蚀时放出氢气,这种腐蚀叫作析氢腐蚀。
实验原理:通常析氢腐蚀只会产生Fe 2+,而Fe 2+在空气中易被氧化,所以采用液封的方法来隔绝空气。
用K 2Cr 2O 7溶液把Fe 2+完全氧化成Fe 3+,再用SnCl 2将Fe 3+还原为Fe 2+,通过电位的突越来确定终点,并通过滴定剂的用量确定Fe 2+浓度,以此来得到腐蚀速率。
主要反应式:Fe+2H +→Fe 2++H 2↑6Fe 2+ + Cr 2O 72-+14H +→6Fe 3+ +2Cr 3++7H 2O Sn 2++2Fe 3+→Sn 4++2Fe 2+分析溶液中亚铁离子含量的方法有很多种,例如原子吸收分光光度法,该方法虽然测量在小含量时精确度高、稳定性好,但实验条件较苛刻,成本较昂贵,稳定性好且使用条件固定,不能改变温度,不宜直接用于计算平均腐蚀速率。
电位滴定法是电位分析法的一种,是以测量电池电动势为基础的定量分析法,从滴定剂的体积和浓度来计算待测物的含量,在滴定到达终点前后,滴液中的待测离子浓度往往连续变化n 个数量级,引起电位的突跃,以此来指示滴定终点。
该方法温度、液体接界电位的影响并不重要,其准确度优于直接电位法,被测成分的含量仍然通过消耗滴定剂的量来计算,可用于有色或混浊的溶液的滴定,还可用于浓度较稀的试液或滴定反应进行不够完全的情况;灵敏度和准确度高。
而普通滴定法是依靠指示剂颜色变化来指示滴定终点,如果待测溶液有颜色或浑浊时,终点的指示就比较困难,或者根本找不到合适的指示剂。
此实验中,待测溶液本身就有颜色,用指示剂可能会导致滴定终点不易观察。
采用普通滴定管的电位滴定法,无法在进行了液封的待测溶液中直接滴加滴定剂。
如果把滴定管底部直接插入溶液中,则会因为气压原因无法加入滴定剂。
所以,本实验主要采用注射器来代替滴定管进行滴定。
注射器具有可以外部施压的优点,同时刻度精确,且易控制注射量,采用不锈钢针头,防止有些针头会被高浓度的盐酸腐蚀,影响测定结果。
1 实验部分1.1 仪器和试剂仪器:雷磁PHS-2F 型PH 计;雷磁232甘汞参比电极;雷磁213铂电极;IKA RCT 基本型加热磁力搅拌器;磁石;恒温水浴锅;兽用不锈钢注射器。
试剂:盐酸;N80钢;K 2Cr 2O 7固体;SnCl 2·2H 2O 固体;锡粒;液体石蜡。
1.2 溶液的配置标准重铬酸钾溶液的制备:将少量K 2Cr 2O 7固体至于干燥器干燥(T =120 ℃)2 h ,待冷却至室温,用分析天平准确称取1.860 2 g K 2Cr 2O 7药品用蒸馏水溶解,并洗涤3次,定容于1 L 量瓶中待用。
稀释:取125 mL 上述的K 2Cr 2O 7于500 mL 量瓶内进行定容。
C =0.001 580 mol/L 。
SnCl 2溶液的配置:称取1.161 0 g SnCl 2于200 mL 烧杯中。
加入30 mL 浓盐酸,用恒温水浴锅加热(50 ℃),边加热边搅拌,直到溶液澄清透明,待冷却至室温,移至500 mL 量瓶中用1∶1的盐酸洗涤3次并定容至刻度线。
加入两粒锡粒并用液体石蜡液封防止SnCl 2被空气氧化。
取用时倒入烧杯,用液体石蜡液封备用(由于SnCl 2不稳定,极易被氧化,不易保存,所以每次需现配现用)。
2 实验内容2.1 实验操作将N80钢预先称重,并用细绳悬挂卡入磨口锥形瓶加入1∶2的盐酸作腐蚀介质1 h 后取出挂片,用棉球擦洗,无水乙醇擦拭,吹干后称量挂片损失的质量。
后搭建如图1的电位滴定装置,预热装置。
在常温下,用移液管移取25 mL 腐蚀液放入100 mL 烧杯中,液面下加入磁石并插入已在饱和KCl 溶液里浸泡了2 h 的参比电极和清洗干净的铂电极。
接着用液体石蜡覆盖腐蚀液表面进行液封,防止Fe 2+被空气氧化。
记下初电位滴定法测定铁离子含量的应用研究胡 箫,朱锦旗,周永博,鲁凯能(长江大学 工程技术学院,湖北 荆州 434020)摘 要:本实验采用稍加改良的电位滴定法研究不同条件对铁的腐蚀速率的影响,该实验模拟在实验条件相对简便的条件下高效、相对准确地测定铁的平均腐蚀速率,并测定电位滴定法滴定亚铁离子浓度实验的灵敏度,即采用电位滴定法在一定条件下所能准确测定的最低亚铁离子浓度。
最后,通过与失重法对比研究了滴定法测定腐蚀速率的可行性,结果表明,电位滴定法与失重法测得的腐蚀速率有较高的一致性,相对平均偏差未超过4%。
关键词:析氢腐蚀;电位滴定法;失重法基金项目:长江大学工程技术学院大学生创新创业计划(201813245005);长江大学工程技术学院科研基金项目(2018KY05)作者简介:胡箫(1997— ),男,湖北黄石人,本科生;研究方向:分析化学。
现代盐化工Modern Salt and Chemical Industry第5期2018年10月No.5October,2018始不加入K 2Cr 2O 7溶液时的数据,用不锈钢注射器每次准确吸取1 mL K 2Cr 2O 7溶液注入待测溶液中并记录每一次的电位数据,快到化学计量点前逐步改为加0.1 mL 。
当电位发生突变时停止注入K 2Cr 2O 7。
接着每次准确吸取1 mL SnCl 2溶液注入待测溶液中并记录每一次的电位数据,重复上述滴定操作,变量仅为不同浓度的不同溶液,当电位再一次发生突越时,停止注入SnCl 2溶液。
平行3次实验。
图1 电位滴定装置简图2.2 温度对铁腐蚀速率的影响完全重复滴定操作,仅改变加热磁力搅拌器的温度,同时改变电位计的设置温度,分别测定在32 ℃、42 ℃、52 ℃、62 ℃ 4组温度下的电位数据。
平行3次实验。
2.3 待测液浓度对电位滴定灵敏度的影响将配置好的SnCl 2溶液,K 2Cr 2O 7标准液,待测液全部分别稀释5倍、10倍、15倍,在常温下重复滴定操作。
平行3次实验,记录电位数据。
2.4 实验注意事项(1)注射器每次注射里面的空气必须全部排空。
(2)每滴定一次滴定剂,平衡后测定电动势。
(3)首先需要快速滴定寻找化学计量点所在的大致范围,正式滴定时,滴定突越范围前后每次加入的滴定剂体积可以较大,突越范围内每次滴加体积控制在0.1 mL 。
3 实验结果与讨论3.1 数据处理方法失重法通过式(1)计算得到的腐蚀速率,0W Wv St=-(1)式(1)中,v 为腐蚀速率[g/(m 2·h )],W 0和W 分别为腐蚀前和腐蚀后的挂片质量(g ),S 为挂片表面积(m -2),t 为腐蚀时间(h )。
电位滴定法通过式(2)计算得到腐蚀速率:00Fe=V C M v St(2)式(2)中,v 为腐蚀速率[g/(m 2·h )],V 0为消耗滴定剂的用量,C 0为所使用滴定剂的浓度,S 为挂片表面积(m -2),t 为腐蚀时间(h )。
用相邻两次的E 、V 值求△E =0时,即等当点时滴定溶液的体积其公式为:V e=V 1+(V 2-V 1){(△2E /△V 2)/[(△2E /△V 2)+(△2E //△V /2)]}。
式中:△2E 为相邻电势增加值的增、减量。
△V 2为每次滴加液增加量的平方值(一般为0.1 mV 或0.05 mV )。
V 1:电势增加最大前电势值对应的滴定体积。
V 2∶V 1电势值对应的滴定体积后面的滴定体积,图中虚线对应得V 轴上的值即滴定终点消耗溶液体积値V e 。
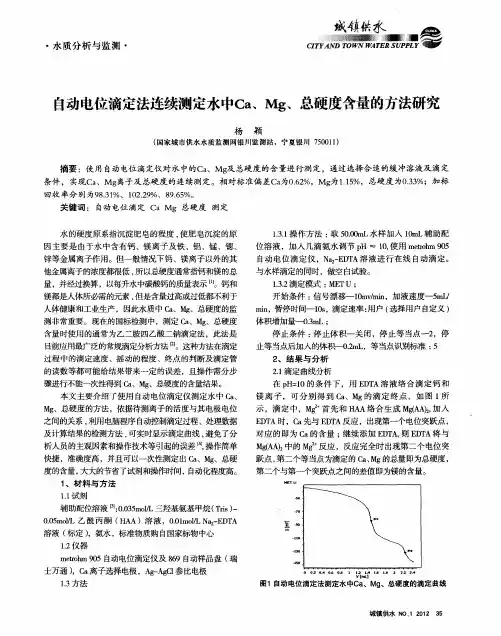
3.2 数据的处理由图2可得知,在32℃、盐酸浓度为1∶2的腐蚀的条件下失重法腐蚀速率测得为5 218.62 g/(m 2·h ),而电位滴定法测得的腐蚀速率为5 409.83 g/(m 2·h ),相对平均偏差为3.5%,则在此条件下,电位滴定法与失重法测得的腐蚀速率有较高的一致性。
图2 腐蚀速率与温度的关系4 实验结果与讨论实验操作过程中表明,当待测液及滴定液浓度稀释为10倍左右的时候即Fe 2+浓度在0.000 96 mol/L 左右的时候,电势会很难稳定,导致测量结果无法精准。
所以在实验条件简陋的条件下,尽量控制待测液浓度不要低于0.000 96 mol/L 。
该滴定结果的重现性比较差。
改进措施如下:(1)温度使水解平衡像右移动导致亚铁离子浓度测定不准确,温度越高误差越大。
(2)也许在实际测量前,样品可能来自于一个没有混合均匀的容器。
或在取样后,样品暴露在不同的环境条件下。
例如样品在滴定前放置不同的时间段,就会吸收不同量的空气中的二氧化碳。
(3)重复性较差还可能取决于用多少样品来做分析。
对于极少量的样品的分析,天平的性能就至关重要。
那么进行一次最小称样量的测试就可以了解天平是否符合要求。
[参考文献][1] 苏铁军,曹 发,杨 帆,等.滴定法与失重法测定碳钢腐蚀速率的比较研究[J]中国无机分析化学,2018(4):29-32.[2] 赵淑楠,张绍举,刘钧泉.高温盐酸对碳钢腐蚀速率影响的探讨[J].石油化工设备技术,2008(4):25-27.现代盐化工·研究与开发。