细胞骨架
- 格式:docx
- 大小:295.13 KB
- 文档页数:8

细胞骨架之微丝一.细胞骨架概念及分类细胞骨架(cytoskeleton)是指真核细胞中的蛋白纤维网架体系.广义上包括细胞质骨架,细胞核骨架,细胞膜骨架,细胞外基质;狭义上指细胞质骨架包括:微丝,微管,中间纤维.细胞骨架存在于各类真核细胞中,但直到1963年,采用戊二醛常温固定方法,在细胞中发现微管后,才逐渐认识到细胞骨架的存在。
细胞骨架不仅对维持细胞的形态、保持细胞内部结构的有序性起重要作用,而且还与细胞运动、物质运输、能量转换、信息传递、细胞分裂、免疫行为、细胞分化等生命活动密切相关。
破坏纤维或干扰相关蛋白都会严重影响信号传导、细胞生长和代谢,而且可能直接影响疾病的病理生理过程.微丝核基质细胞质骨架微管细胞核骨架染色体骨架中等纤维核纤层二.微丝微丝(microfilament,MF),又称肌动蛋白纤维(actin filament),或纤维型肌动蛋白,是指真核细胞中由肌动蛋白(actin)组成,直径为7 nm的骨架纤维。
㈠成分肌动蛋白(actin)是微丝的结构成分,肌动蛋白单体外观呈哑铃状。
肌动蛋白在真核细胞进化过程中高度保守。
不同来源的肌动蛋白其氨基酸顺序差别很小,仅差4~6个氨基酸。
在哺乳动物细胞中至少分离出6种肌动蛋白,按其等电点的不同,可集中分为α、β、γ三类。
α肌动蛋白包括3种亚型:骨骼肌型肌动蛋白、心肌型肌动蛋白、血管型肌动蛋白。
β肌动蛋白为胞质型肌动蛋白,主要存在于非肌肉细胞。
γ肌动蛋白有两种亚型:胞质肌动蛋白(主要存在于非骨骼肌)、肠型肌动蛋白(内脏平滑肌)同一种细胞中可以有2种或2种以上的肌动蛋白亚型存在,且不能互相替代,这种现象可能与不同亚型有不同功能和不同调节机制有关。
㈡微丝的组装是由肌动蛋白亚单位(globular actin, G-actin)组成螺旋状纤维(filamentous actin, F-action)的过程。
每37nm拧成一圈(14个球形肌动蛋白分子线形聚合的长度),每个肌动蛋白分子是接近球形的,它具有极性。


细胞骨架(Cytoskeleton):指存在于真核细胞内的蛋白质纤维网络结构系统狭义细胞骨架:细胞质骨架广义细胞骨架:细胞质骨架、核骨架、细胞膜骨架、胞外基质细胞质骨架:►微管(microtubule)►纤丝(filament):微丝、中等纤维(中间丝)、粗丝微管(microtubule,MT)1、形态结构►细胞骨架中,最早发现,最粗的一种结构►存在于所有真核细胞中►管状结构►大多单管、有时二联管、三联管2、化学组成(1)微管蛋白(tubulin)两种:α-微管蛋白、β-微管蛋白►α-tubulin和β-tubulin聚合,形成异二聚体►异二聚体:高8nm,直径4-5nm,微管的结构亚单位►异二聚体进一步结合,形成原纤维(原丝结构)►13条原纤维,形成一根微管(2)微管连接蛋白(microtubule associated protein,MAP)也称微管附属蛋白、微管关联蛋白呈倒L 形“臂状”突起►长臂垂直伸出,使微管与微管及微管与其它细胞器或结构相作用短臂与微管蛋白结合,稳定、促进微管蛋白聚合作用3、微管的装配微管是一种能进行自我装配的细胞器聚合微管蛋白微管微管的装配是一个高度有序的过程,受许多因素的影响微管组织中心(MTOC)微管在生理状态或实验处理解聚后重新装配的发生处称为微管组织中心(microtubule organizing center,MTOC) :►纤毛(鞭毛)的基体►纺锤体两极的中心粒►染色体的着丝点温度37℃聚合二聚体微管0℃解聚一般认为,20˚C以上才有利于微管的装配MAP►短臂与微管蛋白结合,促进微管蛋白聚合,促进装配►对装配后的MT有稳定作用,增加MT对药物、理化因子的抵抗能力►长臂上有磷酸化位点,磷酸化修饰后,可抑制短臂对微管装配的促进以及稳定和保护作用Ca2+浓度Ca2+ >10μM微管微管蛋白(二聚体)Ca2+<10μM►通过CaM,激活蛋白激酶,MAP长臂磷酸化,解除短臂对微管的保护作用►MT研究中,用EGTA:乙二醇双(β-氨基乙醚)四乙酸药物(1)抑制微管形成药物►许多是植物中提取的代谢产物(生物碱)►秋水仙素(colchicine)►秋水仙胺(秋水仙素类似物,colcemid)►长春花碱►鬼臼素秋水仙素最常用抑制和破坏微管机理:►与β-tubulin肽链中第201位Cys结合►导致二聚体不能形成,微管装配受阻,并引起装配后微管的解聚(2)促进微管形成药物►GTP,为MT装配提供能量,与微管蛋白结合,构象变化,有利于装配►紫杉酚►重水(D2O)微管是一种动态结构:►有极性(βα→βα即头→尾)►头(+极),尾(-极)►+极装配:βα二聚体与GTP结合(有利于装配)►-极去装配:βα二聚体不与GTP结合►一头装配,一头去装配,这种交替变换过程称踏车现象(tread milling)►装配速度>去装配速度,MT延长,反之,MT消失4、微管的功能(1)维持细胞形态:刚性,支架(2)细胞内运输:分泌小泡运输、色素颗粒运输(3)细胞运动——鞭毛和纤毛►鞭毛和纤毛是运动细胞器►自然界许多细胞的运动是靠鞭毛和纤毛进行的►如原生动物:鞭毛虫、纤毛虫;单细胞藻类;动物精子;呼吸道、食道上皮细胞表面纤毛(4)细胞分裂微管参与形成有丝分裂器有丝分裂器包括:►纺锤体►中心粒►染色体纺锤体:由纺锤丝组成►纺锤丝由微管组成(4~6根微管/纺锤丝)►一端与染色体着丝粒相连,一端与中心粒相连(着丝粒、中心粒均为MTOC)►在纺锤丝牵引下,染色体移动中心粒:►位于纺锤体两端►成对出现,相互垂直►9组三联管►MTOC纤丝(filament)包括:►微丝:6~7nm►中间丝:10nm(中间纤维,中等纤维,大小处于中间)►粗丝:15nm1、微丝(microfilament,MF)►又称肌动蛋白纤维(actin filament),肌细胞中的微丝,称细肌丝►由肌动蛋白(actin)组成►肌动蛋白:一条多肽链组成,MW 43kd,球形分子2、粗丝►肌细胞中,称粗肌丝或肌球蛋白丝►由肌球蛋白(myosin)组成►每个肌球蛋白分子由6条多肽链组成肌肉运动►横桥形成后,肌球蛋白头部分子构象变化►两种肌丝间产生滑行►滑行一次,移动10nm►滑行后,在肌球蛋白头部结合2个A TP(A TPase位点)►A TP水解,头部构像复原►肌肉收缩►动物死亡后,A TP耗尽,处于收缩状态,肌肉僵硬在体内,有些微丝是永久性的结构,如肌细胞中的细肌丝等►在大多数非肌细胞中,微丝是一种动态结构►与微管相似,也存在装配和解聚药物:►细胞松弛素B(cytochalasin B,CB)►鬼笔环肽(毒蕈产生)微丝功能:(1)肌肉收缩(2)胞质环流:丽藻、轮藻,叶绿体运动(用CB 处理,停止,洗去CB,恢复)(3)细胞移动:变形虫,肌动蛋白与肌球蛋白相互作用(非肌肉细胞中,肌球蛋白不聚集成粗丝)(4)维持细胞形态♦与微管一起,支架♦应力纤维(stress fiber),微丝束♦肠上皮微绒毛(5)细胞分裂♦纺锤体中有微丝♦胞质分裂环3、中等纤维(intermediate filament,IF)中间纤维、10nm丝按组织来源和免疫原性的不同,分5类:(1)角蛋白纤维(上皮细胞)(2)波形纤维(间质细胞、中胚层来源细胞)(3)结蛋白纤维(肌细胞)(4)神经元纤维(神经元细胞)(5)神经胶质纤维(神经胶质细胞)中等纤维由中等纤维蛋白聚合而成结构:♦羧基末端和氨基末端-非螺旋♦中部α-螺旋区♦α-螺旋区310个氨基酸功能:由于没有特异性药物,影响功能研究(1)支架,细胞形态(2)细胞运动、铺展、胞内颗粒运动(3)形成桥粒等结构(4)信息传递IF与肿瘤诊断:IF的分布具有组织细胞特异性即不同的组织细胞中,IF种类不同,以此鉴定组织细胞类型扩散的癌细胞来源?波形纤维:黑色素瘤、淋巴瘤结蛋白纤维:横纹肌、平滑肌瘤神经纤维:神经母细胞瘤、嗜铬细胞瘤等核骨架(nucleoskeleton),也称核基质(nuclear matrix)成份:♦核骨架蛋白♦核骨架结合蛋白♦几十种功能:♦DNA复制♦RNA转录和加工♦病毒复制和装配♦染色体构建。

第1篇一、实验目的1. 理解细胞骨架的基本概念及其在细胞生物学中的重要性。
2. 掌握使用荧光显微镜观察细胞骨架的方法和技巧。
3. 认识细胞骨架的主要组成成分,包括微丝、微管和中间纤维。
4. 分析细胞骨架在不同细胞类型和生理状态下的形态和分布。
二、实验原理细胞骨架是真核细胞内由微丝、微管和中间纤维组成的网状结构,负责维持细胞形态、细胞运动、物质运输、信号传导等重要功能。
微丝主要由肌动蛋白组成,微管主要由α-和β-微管蛋白组成,而中间纤维则由多种蛋白质组成。
细胞骨架的结构和动态变化对细胞的正常生理功能至关重要。
三、实验材料与仪器材料:1. 植物细胞样本(如洋葱鳞片叶表皮细胞)2. 动物细胞样本(如小鼠成纤维细胞)3. 荧光标记的细胞骨架蛋白抗体4. 抗荧光标记的抗体5. 胶体金标记的抗体6. 封片剂仪器:1. 荧光显微镜2. 激光共聚焦显微镜3. 冷冻切片机4. 液氮5. 恒温培养箱6. 电子显微镜四、实验步骤1. 样本制备:- 植物细胞样本:取洋葱鳞片叶表皮细胞,用2%的戊二醛固定,进行冷冻切片。
- 动物细胞样本:培养小鼠成纤维细胞,用2%的戊二醛固定,进行冷冻切片。
2. 荧光标记:- 将切片置于含有荧光标记的细胞骨架蛋白抗体的溶液中,室温孵育一段时间。
- 洗涤切片,去除未结合的抗体。
3. 抗荧光标记抗体:- 将切片置于含有抗荧光标记抗体的溶液中,室温孵育一段时间。
- 洗涤切片,去除未结合的抗体。
4. 胶体金标记抗体:- 将切片置于含有胶体金标记抗体的溶液中,室温孵育一段时间。
- 洗涤切片,去除未结合的抗体。
5. 封片:- 将切片置于封片剂中,覆盖玻片,封片。
6. 显微镜观察:- 使用荧光显微镜或激光共聚焦显微镜观察细胞骨架的形态和分布。
五、实验结果与分析1. 洋葱鳞片叶表皮细胞:- 在荧光显微镜下观察到洋葱鳞片叶表皮细胞的细胞骨架主要由微丝和微管组成。
- 微丝呈网状分布,主要位于细胞质膜内侧。
- 微管呈束状分布,主要位于细胞核周围。






细胞骨架名词解释细胞骨架是细胞内网络结构的一个重要组成部分,由多种类型的蛋白质构成,负责维持细胞形状、细胞器位置和细胞运动,以及参与细胞内物质的运输和细胞信号传导等功能。
细胞骨架主要包括微丝、中间丝和微管三种主要类型的蛋白质纤维。
微丝是细胞骨架的重要组成部分,由肌动蛋白组成。
它们是细胞运动和细胞皱缩的主要驱动力,可以通过与肌球蛋白的相互作用缩短和延长。
微丝还在细胞分裂和细胞外基质附着等过程中发挥重要作用。
中间丝是一种相对比较稳定、粗且形状较均匀的纤维,由多种类型的中间丝蛋白组成。
中间丝提供了细胞骨架的稳定性,主要存在于细胞核周围和细胞间连接等区域,并在细胞分裂和细胞力学支撑等过程中发挥重要作用。
微管是一种管状结构的蛋白质纤维,在直径和长度上较其他两种骨架纤维更大。
微管的主要成分是α-、β-和γ-微管蛋白,它们通过聚合和解聚的方式调控微管的形成和稳定。
微管在细胞分裂、细胞运输和细胞运动等方面发挥重要作用。
除了以上三种主要类型的细胞骨架,细胞骨架还包括与其他蛋白质交互作用的辅助蛋白质,如肌凝蛋白、交联蛋白和动力蛋白等。
这些蛋白质通过与细胞骨架纤维的相互作用,调节细胞骨架的形成、重塑和动力学行为。
细胞骨架的功能主要包括:维持细胞形状和结构稳定性、细胞运动和细胞内外物质的运输以及参与细胞信号传导等。
细胞骨架通过对细胞内分子的定向排列和有序运动,使细胞能够完成各种形态和运动变化。
此外,细胞骨架还参与细胞内信号的传递和调控,从而调节细胞增殖、分化和凋亡等生命活动。
总之,细胞骨架是维持细胞形态和结构稳定性的重要结构,通过调节细胞的形态和运动,参与细胞内物质的运输和细胞信号传导,对细胞的功能和生命活动起着重要的调控作用。
细胞骨架(cytoskeleton)是指真核细胞中的蛋白纤维网络结构。
广义的细胞骨架包括细胞质骨架、细胞核骨架、细胞膜骨架、细胞外基质四部分,形成贯穿于细胞核、细胞质、细胞外的一体化网络结构。
狭义的细胞骨架是指真核细胞的细胞质中支持细胞形状和引导细胞及细胞成分运动的纤维性细胞质骨架体系。
细胞质骨架由微管和纤丝(微丝,中间丝,粗丝)组成细胞骨架决定动物细胞形态,维持细胞内部结构的有序性,抵制外界压力对细胞的破坏;2.负责多种细胞器在细胞内的定位;线粒体、内质网(驱动蛋白)、高尔基体(胞质动力蛋白)等3.指导物质和细胞器在胞内的移动;胞内的膜泡运输等4.为细胞本身移动和构成细胞运动的力量来源装置;鞭毛的摆动、肌肉的运动等5.为mRNA提供锚定位点,帮助mRNA翻译成多肽链;6.是细胞分裂机制中的重要成分。
微管:微管蛋白【(αβ微管蛋白---异二聚体----原丝----片状原纤维——微管)r 微管蛋白】位于微管组织中心,对微管组成及极性的确定至关重要。
80%的r微管蛋白以环状复合体的形式存在。
微管结合蛋白(microtubule-associated protein, MAP):tau蛋白, MAP1,MAP2, MAP4。
MAP是微管蛋白装配成微管后结合在微管表面的辅助蛋白,具有稳定微管结构以及介导微管与其它细胞成分互作的功能细胞质中由微管蛋白组成的一种细长且具有一定刚性的中空圆管状结构。
13条原纤维外径:24~26nm内径:15nm。
广泛存在于各种真核细胞中,多呈网状或束状分布,与维持细胞形态、细胞运动及细胞分裂等有关。
胞质中微管可装配成:单管(主要存在形式)二联管(纤毛和鞭毛)三联管(中心粒和基体):1.支持和维持细胞形态2.维持细胞内细胞器的空间定位分布驱动蛋白与内质网膜的胞质面结合,沿微管向细胞四周牵拉使内质网在胞质溶质中展开。
动力蛋白与高尔基体膜结合,沿微管向近核方向牵拉,使高尔基体定位于中心体附近。
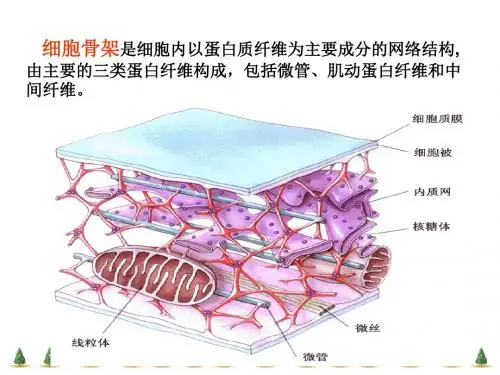
细胞骨架(cytoskeleton):真核细胞中的蛋白纤维网架体系狭义:细胞质骨架(微丝,微管,中间纤维)广义:细胞核骨架(核基质,核纤层,染色体支架),细胞质骨架,细胞膜骨架,胞外基质作用:维持细胞形态,保持胞内结构有序性,与细胞运动,物质运输,能量交换,信息传递细胞分裂,分化,基因表达有关系。
一)细胞质骨架一、微丝(microfilament / MF)1.定义:又称肌动蛋白纤维(actin filament)/纤维状肌动蛋白(F-actin),是真核细胞中由肌动蛋白组成,直径7nm的骨架纤维。
2.装配:1)MF是G-actin 单体组成的多聚体,具有极性,对其行使功能必需。
2)MF一条actin单体链形成的螺旋,每个actin单体周围有4个亚单位(上下两侧)。
3)G-actin 可装配到MF两端,装配速度(+)>(-),也可体外装配(聚合-解聚纯化MF)ATP + Ca2+低浓度Na+、K+阳离子溶液中MF→ G-actin (解聚)Mg2+高浓度Na+、K+阳离子溶液中G-actin →MF (诱导装配)踏车现象(tread milling):MF表现出一端因加亚单位而延长,另一端因亚单位脱落而减短。
4)装配在两个水平上受到MF结合蛋白调节:①游离G-actin单体的浓度;②MF横向连接成束/网的程度5)非肌肉细胞中,MF是动态结构,持续解离和装配,维持细胞形态/运动。
永久性结构:肌肉细丝和小肠上表皮微绒毛中轴心微丝。
暂时性结构:胞质分裂环微丝(血小板激活,无脊椎动物精子顶体反应的MF)3.成分:1)肌动蛋白主要结构成分,M=43K,哑铃状(A TP + Ca2+结合于中间核苷结合槽),存在于所有真核细胞,在进化上高度保守。
已分离6种:4种α肌动蛋白(横纹肌,心肌,血管/肠道平滑肌)+β、γ肌动蛋白(肌肉/非肌肉细胞质)。
2)微丝结合蛋白(microfilament-associated protein)MF结合蛋白参与MF高级结构形成,对肌动蛋白动态装配有调节作用。
§9.1 细胞骨架概述一、细胞骨架的概念细胞骨架是指细胞中由纤维蛋白构成的空间网络结构。
广义的细胞骨架包括:细胞核骨架、细胞质骨架、质膜骨架以及胞外基质。
狭义的细胞骨架包括:细胞质骨架(微管、微丝、中间丝)细胞中同时存在多种类型的细胞骨架并非物质能量的浪费,每种细胞骨架及其组成成分均行使不同的功能,多种组分间分工协作,功能互补,对细胞完成正常的生理功能至关重要。
二、细胞骨架的特点1.细胞骨架由相应的蛋白亚基构成,在组装与解聚间二者达到平衡。
2.细胞骨架具有动态不稳定性,即一定条件下存在组装与去组装现象,在细胞生命活动中起到重要作用。
(1)细胞周期中,细胞骨架经历动态的组装与去组装,周期性的重塑,在分裂期与分裂间期,其分布与组织形式不同。
(2)踏车行为能够改变微管或微丝在细胞中的分布,可能与细胞运动有关。
(3)细胞分裂伴随着纺锤体的形成于分解。
(4)细胞胞质环流伴随着细胞骨架的形成于解聚。
3.细胞骨架是三维的空间网状结构。
三、细胞骨架的功能特点1.细胞骨架构成多种细胞结构。
(1)微管:鞭毛、纤毛、中心体、纺锤体(2)微丝:微绒毛、收缩环、应力纤维、黏合斑、黏合带(3)中间丝:桥粒、半桥粒2.细胞骨架为细胞提供结构支撑,维持细胞形态。
3.细胞骨架介导细胞内物质运输、细胞器运输。
4.细胞骨架介导细胞运动。
5.细胞骨架对细胞分裂起到重要作用。
6.细胞骨架是细胞内结构与功能的空间组织者。
细胞内生物大分子或细胞器的分布具有不对称性,这与细胞骨架的不同组织方式有关,其结构与功能相适应。
四、细胞骨架的研究方法1.荧光显微镜细胞骨架的蛋白亚基可与相应的荧光染料或荧光抗体特异性结合,从而通过荧光显微镜观察其在活细胞中的组织、分布、功能与行为模式。
2.电子显微镜细胞经非离子型去污剂处理后,可溶性物质与膜被抽离,留下不溶的细胞骨架结构,经金属复型后可在电镜下观察细胞骨架的结构。
3.特异性药物处理微管:秋水仙素、长春花碱、紫杉醇微丝:细胞松弛素、鬼笔环肽微管微丝中间丝单体α/β-微管蛋白肌动蛋白杆状蛋白分子量50×10343×10340~200×103结合核苷酸GTP ATP无直径内径 15nm7nm10nm外径 24nm结构13 根原纤维构成的肌动蛋白单体首尾相8 个四聚体或 4 个八空间空心管状结构连构成的双股螺旋聚体构成的螺旋结构极性有有无组织特异性无无有单体库有有无踏车行为有有无结合蛋白动力蛋白肌球蛋白无驱动蛋白特异性药物秋水仙素细胞松弛素未发现长春花碱鬼笔环肽紫杉醇§9.2 微管一、微管的组成与结构1.微管蛋白微管是中空管状的细胞骨架,外径约 24nm,内径约 15nm,由α、β两种球状蛋白形成的异二聚体,即微管蛋白亚基构成,微管蛋白亚基是微管组装的结构单位。
微管组成的细胞器及研究动态在细胞内,由微管所组成的细胞器几种:一、中心体(一)中心体的结构中心体(centrosome)由中心粒(centrioles)和中心粒周围物质(pericentriolar material, PCM)共同组成。
中心粒在细胞内一般有两个,成对存在于核的附近。
每个中心粒是由9排微管(每排3条)围成的短圆筒状结构,两个中心粒在一端大致成垂直对应。
中心粒的直径为0.16~0.23μm,长度一般为0.16~5.6μm,差别较大。
三联体包括3条微管,由内向外分别被编号为A、B、C亚丝,3条微管平行排列成片状三联体结构,只有A管是完全的微管且与中心粒的轴心向外伸出的辐射状的细丝相连。
9组三联体按照一定的角度规则排列,形成了风车状。
三联体之间有细丝相连,且在每一三联体的外侧均有被称为随体的致密物质存在。
(二)中心粒的发生在中心粒周围物质中含有数百个由13个γ微管蛋白和其他蛋白质构成的γ微管蛋白环状复合体γTuRC是一条微管形成的起点,αβ微管蛋白二聚体以一定的方向添加到γ微管蛋白上。
每条微管的起始端埋藏在中心粒周围物质中,以正端向外生长。
γTuRC是微管生成的真正的诱导起点,起“晶种”的作用。
实验证明,只要有γTuRC存在即可引导微管生长,而且所需要的微管蛋白的浓度要比在体外低得多。
中心粒在细胞中具有自我装配的能力。
装配时,首先形成由9条单丝微管围成的环,9条单丝即成为将来的A亚丝,然后B亚丝再以“C”字形(横切面)装配到A亚丝上,最后“C”字形的C亚丝再装配到B亚丝上,此时三联体装配完成,形成前中心粒。
在前中心粒的基础上进一步延长,直至形成成熟的中心粒。
二、纤毛和鞭毛(一)结构纤毛在整体结构上包括三部分。
①纤毛本体:由细胞游离面向外伸出的细柱状突起,表面上包有一层质膜。
②基体:纤毛基部的质膜下方的圆筒形结构,来源于中心粒,其结构与中心粒完全相同,具有MTOC的作用。
③纤毛小根:大多数纤毛小根有横纹,这些小根纤维是由一些3~7nm粗的平行微丝组成。
此外,在基体的一侧,从2~3个三联体上伸出由微丝组成的突起形成基足。
轴丝是纤毛本体的内部由微管及其相关蛋白组成的芯。
大多数纤毛的轴丝是属于9+2型的,外周为9组二联丝微管规则排列一圈,称为外周二联丝。
每组外周二联丝是由两条微管组成,一条为整管,称为A亚丝,另一条为“C”字形的半联丝B亚丝。
A亚丝纵向上一定间隔排列B亚丝。
A亚丝为一条整管,由13条原丝组成,B亚丝为一半管,由10条(或11条)原丝组成,与A亚丝共用3条原丝。
轴丝中央有两条微管,外周包围着一层蛋白质性质的鞘。
外周二联丝之间有连接,称为二联丝间连桥。
外周二联丝和中央鞘之间有放射辐连接,其由A亚丝伸出,近中央鞘一端膨大为辐头。
轴丝中,周围微管的直径为18~25nm,周围微管中,A亚丝比B亚丝更接近于轴。
各种微管在纤毛顶端的延伸程度不同,中央微管最长,可达纤毛顶端,A亚丝较短,B亚丝最短。
有的细胞,纤毛轴丝中无中央微管,属于9+0型,也有9+1型。
基体的远端为基板所封闭,外周二联丝穿过基板同相应的基体微管相连,基体的每组微管比轴丝的二联丝多了一条C管,形成了三联丝。
(二)化学组成轴丝中微管与细胞质微管一样,也是由微管蛋白聚合而成。
A亚丝的微管蛋白和B亚丝中的完全不同,单条的微管的微管蛋白带有一个能与秋水仙素结合的部位,而二联丝微管中替代为GDP,秋水仙素可干扰GDP与单条微管的微管蛋白结合。
动力蛋白是构成A亚丝上的短臂的主要成分,是纤毛运动的动力来源。
连接蛋白由二联丝连桥之中分离出来,可能对保持运动中纤毛的整体性有一定作用。
(三)纤毛和鞭毛运动的机制纤毛运动是摆动,由相邻二联丝间相互滑动引起。
外周二联丝A亚丝上的动力蛋白臂头部结合到相邻二联丝的B亚丝上,动力蛋白分子发生构象变化而牵动相邻二联丝向鞭毛“+”极滑动,而后动力蛋白臂与相邻二联丝B亚丝脱离,动力蛋白构象恢复,重新进入下一轮循环。
由于纤毛轴丝两半所含的二联丝数目不相等,故在两个方向上摆动的力量不均,摆动力量大的为有效鞭击,力量较弱的为恢复鞭击。
(四)纤毛发生纤毛是由基体直接产生,基体是轴丝的微管组织中心。
原生动物和哺乳动物在纤毛基体的一侧垂直方向形成新基体,然后成熟的新基体移至质膜下方,顶端向上,发动形成轴丝。
一个成熟大户的中心粒发动装配成成群的基体,这些基体移至膜下一定部位产生出纤毛。
基体的外周A、B亚丝直接延伸形成轴丝二联丝,C亚丝不伸进纤毛中,中央微管则由基体上方之轴体发出。
轴丝二联丝通过顶端生长而延伸。
三、有丝分裂器有丝分裂时,染色体的姐妹染色单体均由动粒连接到两极发出的微管(动粒微管)上通过微管“+”端的装配或者解聚而使微管的长度发生改变,从而牵引姐妹染色单体分离,到达细胞两极。
四、轴足原生动物纤毛虫纲的有盘亚纲动物,周身向外伸出很长的轴足。
轴足中有微管整齐排列而成的轴丝。
太阳虫中,微管排列成双螺旋。
五、细菌鞭毛细菌鞭毛可分为鞭丝、弯钩和基粒三个部分。
化学性质上,鞭毛蛋白与肌动蛋白相似,无ATP酶活性。
细菌鞭毛运动方式为旋转,直接能源是质子跨膜梯度,细菌质膜两侧保持一定的质子梯度,使质膜保持有高度状态,这种高能状态驱动鞭毛旋转。
鞭毛也具有自我装配现象,利用调节pH使鞭毛的生长蛋白自行解聚和聚合。
研究动态1、2007年1月微管蛋白(tubulins)是微管的基本结构,它们聚集在一起形成原纤维(protofilaments),几股原纤维在一起形成一个大的微管蛋白片层。
研究人员观察酵母中这些微管蛋白片层组装为微管的方式,发现一种关键蛋白——Mal3p。
电镜实验发现Mal3p与微管seam相结合,将微管蛋白片层的两边连接起来形成一个管道。
Mal3p蛋白沿seam排列成为一条直线,“焊接”微管,在微管薄弱位点稳定微管。
“这是首次发现一种与微管seam特异结合的蛋白,”EMBL研究小组前任带头人Andreas Hoenger说,“ seam的功能现在仍然未知,其一度被认为是微管网架(microtubule lattice)临时的、不相关的部分。
我们的实验证明它是调节微管稳定性的中心位点。
”没有Mal3p,微管会变得不稳定,容易解开,Mal3p是微管行为的关键调节者。
细胞可以通过控制Mal3p的有无,快速改变微管的收缩状态,这对于快速的灵活的细胞运输非常重要。
Mal3p沿微管seam的定位非常关键,因为在微管seam,Mal3p可以在不妨碍沿微丝的动力蛋白运输的情况下提供稳定性。
除了稳定功能,Mal3p在运输过程中还发挥更积极的作用。
EMBL研究小组领导人 Damian Brunner说:“动力蛋白通过与微管蛋白直接接触,沿微管移动。
沿它们运动的载体如同高速公路上的货车。
沿seam的一连串Mal3p提供了微丝上的另一条候选轨道,沿这条轨道,特异的动力蛋白可以运动,如同与高速公路并行的铁路。
这种双系统使运输更加多样化,更加有效。
”在酵母研究中得到的关于细胞运输和微管稳定性的新发现,有助于揭示其在人类中的相似过程。
Mal3p在进化过程中相当保守,人类结肠癌或神经退行性疾病等都与Mal3p有关。
2、2007年4月一般认为,kinesin是一种与细胞微管结合而起运输作用的马达蛋白。
Kinesin是由两条轻链和两条重链构成的四聚体,外观上具有两个球形的“头”(具有ATP酶活性)。
它的运动方式是一步一步节节进行的,通过水解三磷酸腺苷(ATP)来为每一步提供能量。
而在每步之间,“分子马达”会停下来,直到ATP被绑定至其中一“头”。
但是,科学家对于ATP通道(ATP gating)的精确机制一直存在争议。
一种观点认为,kinesin在步与步之间只有一头与微管相连,另一头无法与下一个绑定位点连接,除非ATP诱导kinesin发生构象变化。
但还有一种观点认为,kinesin停下时两头都与微管相连,而两个连接头之间的应力(strain)使马达无法前进,直到ATP与其中一头绑定。
但是,无论哪种模型,ATP绑定后都会激发一种与微管网架(microtubule lattice)相关的机制。
但最新的研究结果质疑了微管网架存在的必要性。
领导该研究的是位于英国剑桥的玛丽居里研究院(Marie Curie Research Institute)的Maria Alonso以及论文高级作者Robert Cross,他们发现,一种微管成分——微管蛋白亚基(tubulin subunit)能够引导ATP的自我运转,从而使kinesin不用于微管结合。
凝胶过滤实验表明,未聚合的微管蛋白能在溶液中与kinesin绑定。
通过测定溶液中的ATP酶活性,研究人员发现,自由微管蛋白可以促使kinesin头部的ATP水解,从而激发ATP 循环。
因此,论文作者认为,之前的两种kinesin运动理论都不成立。
Cross表示,“我们的研究结果表明,微管几何结构与ATP通道机制完全无关。
”研究人员推测,在运动间歇,kinesin 一头的微管绑定位点一直处于“掩蔽”(masked)状态,而只有ATP与其另一头绑定才能除去这一障碍。
但是,此次研究的结论并没有得到完全的肯定。
美国斯坦福大学的Steven Block最近发表了关于应力对kinesin运动的作用的相关文章,他表示,最新研究的结论并不能排除马达运动中应力的影响。
即使kinesin是与自由微管蛋白结合,也存在微管蛋白亚基引发一些应变的可能。
此外,微管蛋白亚基或许会很短暂地聚合成极小的微管,研究人员未必能够发现这一现象。
而哥伦比亚大学的Steven Rosenfeld则表示,该研究结果确实能够表明kinesin的运动可以不需要应力的控制,但并不意味着这就是“分子马达”运动调控的唯一方式。
3、2007年6月微管是构成细胞骨架的三种filaments中最大的一种,由两种球状蛋白——alpha tubulin(微管蛋白)和beta tubulin组装而成。
为了立足,初生微管“种子”必须锚定在与细胞核相邻的中心体(或称MTOC,微管组织中心)上。
从MTOC开始,处于生长状态的微管向四周扩散。
它们的快速聚集和解聚,帮助蛋白在细胞中运输,使引发细胞运动的信号极性分布。
今天大多数人将中心体视作微管“晶核形成(nucleation,生物通编者译)”的主要发源地。
文章高级作者、细胞和发育生物学副教授Kaverina说:“我发现许多微管没有附着在中心体。
所以我打算寻找它们的起源。
”Kaverina怀疑高尔基有MTOC的功能。
然而,在活细胞成像技术出现之前无法证明微管的这种起源学说。
“高尔基体与中心体很近,不仔细看的话,很难区分二者。
”为了提高分辨率,Kaverina等用荧光分子标记人视网膜上皮细胞中微管的生长末端(plus端),拍摄它们生长过程。