类风湿因子(RF)定量测定试剂盒标准操作程序(内容清晰)
- 格式:doc
- 大小:55.50 KB
- 文档页数:3

类风湿因子(RF)测定一、用途体外定量测定血清样品中类风湿因子(RF)的含量。
二、临床意义(一)概述类风湿因子是机体针对天然及变性或凝集的免疫球蛋白Fc部分所产生的一组异常免疫球蛋白的总称。
因为首先在类风湿性关节炎患者的血清中发现,故称之为类风湿因子。
(二)临床意义1.类风湿性关节炎:RF阳性率为52%〜92%,多在70%〜80%左右。
特异性88.5%左右。
RF阳性者疗效差且多有并发症(如周围神经炎及动脉炎等)。
RF阴性表示病症较轻,且并发症少,疗效好。
持续高滴度RF常提示RA疾病活动,且骨侵蚀发生率高,常可伴有皮下结节或血管炎等全身并发症,提示预后不佳。
区尸主要出现在类风湿性关节炎患者,约70%〜90%的血清中和约60%的滑漠液中可检出IgG类RF,这很可能是自身IgG变性所引起的一种自身免疫应答的表现。
作为类风湿的诊断,对于稀释度的注意非常重要,一般1:32以上才有价值。
但RF也象ANA一样,并不是RA独有的特异性抗体。
2.正常人:阳性率为2〜5%,随年龄增长有增高趋势。
5%正常老年人可出现阳性。
75岁以上阳性率为2%〜25%。
3.自身免疫性疾病:阳性率:SLE(30%)、I°SS(70%〜90%)、SSc(20%〜30%)、PM/DM(5%〜10%)、MCTD(50%〜60%)、IgA肾病(25%〜40%)、恶性贫血为80%,自身免疫性溶血性贫血为75%,慢活肝为60%。
阴性:人$、赖特综合征、。
八、银屑病关节炎、肠病性关节炎。
4.其他:慢性感染性疾病:亚急性细菌性心内膜炎、结核、麻风、梅毒、黑热病、传染性肝炎、血吸虫病等。
非感染性疾病:弥漫性肺间质纤维化、肝硬化、慢性活动性肝炎、结节病、巨球蛋白血症等。
三、检验原理类风湿因子是一种发生于类风湿性关节炎患者体内的抗人变性片6自身抗体。
采用微粒子增强免疫比浊法。
样品中抗人变性IgG自身抗体与包被有人Y-球蛋白的胶乳微粒在液相中相遇,立即形成不溶性抗原-抗体复合物,并产生一定的浊度。

上海捷门生物技术有限公司RF检测试剂盒说明书
类风湿因子(RF)科研检测试剂盒组成结构:
1、血清:操作过程中避免任何细胞刺激。
使用不含热原和内毒素的试管。
收集血液后,1000×g离心10分钟将血红细胞迅速小心地分离。
2、血浆:EDTA、柠檬酸盐、肝素血浆可用于检测。
1000×g离心30分钟去除颗粒。
3、细胞上清液:1000×g离心10分钟去除颗粒和聚合物。
4、组织匀浆:将组织加入适量生理盐水捣碎。
1000×g离心10分钟,取上清液。
5、类风湿因子(RF)科研检测试剂盒保存:如果样品不立即使用,应将其分成小部分-70℃保存,避免反复冷冻。
尽可能的不要使用溶血或高血脂血。
如果血清中大量颗粒,检测前先离心或过滤。
不要在37℃或更高的温度加热解冻。
应在室温下解冻并确保样品均匀地充分解冻。
类风湿因子(RF)科研检测试剂盒注意事项
1. 当混合蛋白溶液时应尽量轻缓,避免起泡。
2. 洗涤过程非常重要,不充分的洗涤易造成假阳性。
3. 一次加样时间X好控制在5分钟内,如标本数量多,推荐使用排枪加样。
4. 请每次测定的同时做标准曲线,X好做复孔。
5. 如标本中待测物质含量过高,请先稀释后再测定,计算时请
X后乘以稀释倍数。
6. 在配制标准品、检测溶液工作液时,请以相应的稀释液配制,不能混淆。
7. 底物请避光保存。
8. 不要用其它生产厂家的试剂替换试剂盒中的试剂。

类风湿因子(RF)测定试剂盒(胶乳免疫比浊法)说明书【产品名称】类风湿因子(RF)测定试剂盒(胶乳免疫比浊法)【包装规格】a)试剂1:1×20mL试剂2:1×5mLb)试剂1:2×40mL试剂2:1×20mLc)试剂1:4×60mL试剂2:2×30mLd)试剂1:2×80mL试剂2:2×20mL【预期用途】用于体外定量测定人血清中类风湿因子的含量。
类风湿因子的检测可以作为类风湿性关节炎的诊断依据,也可作为病情进展的指标。
另外有助于诊断系统性红斑狼疮、慢性肝炎等。
测定类风湿因子常用于类风湿性关节炎的辅助诊断依据[1]。
【检验原理】类风湿因子是和人IgG的Fc片段起免疫反应。
用人IgG包被胶乳微粒和样本中RF发生免疫反应,引起微粒凝聚,致使浊度增加,其增加的程度与RF的含量成正相关。
【主要组成成分】试剂1主要组分三羟甲基氨基甲烷缓冲液18.5mmol/L 聚乙二醇(PEG)4% ProClin300适量试剂2主要组分三羟甲基氨基甲烷缓冲液18.5mmol/L 抗原致敏胶乳类风湿因子(RF)抗体适量ProClin300适量注:不同批号试剂盒中各组分未经试验不可互换。
【储存条件及有效期】1.试剂原包装在2~8℃储存,有效期为12个月,生产日期、有效期见标签。
2.开口后的试剂在仪器仓中(2~8℃)可稳定30天。
【适用仪器】艾威德AS-420/AS-660/AS-1200;日立HITACHI7020型/7060型/7180型/7600型/LABOSPECT008AS型;贝克曼AU400/AU480/AU640/AU680/ AU2700/AU5400/AU5800/AU5811/AU5821;佳能TBA-FX8/TBA-120FR/ TBA-2000FR;罗氏cobas8000c702/cobas8000c701/cobas8000c502;西门子SIEMENS ADVIA1800/ADVIA2400;雅培ABBOTT ARCHITECT c8000/ARCHITECT c16000/ARCHITECT ci8200;西森美康SYSMEX BM6010/C;科华KHB卓越310/卓越330/卓越400/卓越450/ZY-1200/ ZY-1280;迪瑞CS-240/CS-T300/CS-300B/CS-380/CS-400A/CS-400B/ CS-600A/CS-600B/CS-800A/CS-800B/CS-1200/CS-1200ISE/CS-1300B/ CS-1400;迈瑞MINDRAY BS-220/BS-330/BS-350E/BS-380/BS-390/ BS-400/BS-430/BS-600/BS-800/BS-2000M;颐兰贝ES-200/ES-380/ES-480;赛诺迈德SUNMATIK-9050型;雷杜Chemray420;英诺华D280;特康TC6010L;锦瑞GS400;普康6066。

检验科生化类风湿因子测定的标准操作规程【目的】体外检测血清类风湿因子(RF)含量。
【职责】1.实验室工作人员均应熟知并严格遵守本SOP,室负责人监督落实。
2.本SOP的改动,可由任一使用本SOP的工作人员提出,并报经下述人员批准签字:室负责人、科主任。
【标本类型及实验前准备】1.受检者的准备病人空腹12h,不饮酒24h后采集血样。
体检对象抽血前应有两周的的正常状况记录。
注意有无应用影响测试项目的药物。
此外,对于体检者,采血的季节都应做相关记录,因为样本中各项目的含量有季节性变动,为了前后比较应在每年同一季节检验。
对于体检对象抽血前应有2周时间保持平时的饮食习惯,应嘱体检对象在抽血前24小时内不做剧烈运动。
2.静脉采血除非是卧床的病人,一般在采血时取坐位。
体位影响水分在血管内外的分布,会影响测试项目的浓度。
在采血前至少应静坐5分钟,一般从肘静脉取血,使用止血带的时间不超过1分钟,穿刺成功后立即松开止血带。
【仪器设备】东芝TBA-FX8全自动生化分析仪,低速离心机一、检测原理类风湿因子试剂是大小均一的聚苯乙烯乳胶颗粒悬液,颗粒表面包被有抗人γ球蛋白,样本中类风湿因子与之结合后,发生凝聚反应,并产生浊度改变。
该浊度与样本中类风湿因子浓度成正比。
通过测定600nm处吸光度值的变化,即可测得样本中类风湿因子的浓度。
二、试剂1.试剂本科使用上海复星长征医学科学有限公司RF试剂盒,为液体双试剂,各组分如下:试剂1(R1)叠氮化钠 0.1%磷酸盐缓冲液 13 mmol/L试剂2(R2)叠氮化钠 0.1%抗人γ球蛋白致敏胶乳颗粒抗原2.校准要求2.1校准品:使用与试剂配套使用的复星长征校准品对测定进行校准。
2.2校准间隔2.2.1试剂批号变更时,使用与试剂配套使用的复星长征校准品对测定进行校准后再对临床病人样本进行测定。
2.2.2室内质量控制出现问题时使用与试剂配套使用的复星长征校准品对测定进行校准并确认问题得到解决后方可对临床病人样本进行测定。

类风湿因子(RF)测定试剂盒(免疫比浊法)适用范围:本产品用于体外定量测定人血清中类风湿因子的含量。
1.1包装规格试剂1(R1):2×60mL、试剂2(R2):2×12mL;试剂1(R1):1×20mL、试剂2(R2):1×6mL;试剂1(R1):1×60mL、试剂2(R2):1×12mL;试剂1(R1):2×80mL、试剂2(R2):2×16mL;试剂1(R1):1×80mL、试剂2(R2):1×16mL;试剂1(R1):2×400mL、试剂2(R2):2×80mL;试剂1(R1):1×1000mL、试剂2(R2):1×200mL;试剂1(R1):1×5000mL、试剂2(R2):1×1000mL;试剂1(R1):2×61mL、试剂2(R2):2×13mL;640测试/盒:【试剂1(R1):2×61mL、试剂2(R2):2×12mL】;960测试/盒:【试剂1(R1):3×60mL、试剂2(R2):3×12mL】。
1.2 主要组成成分1.2.1试剂组成试剂1(R1)(以下简称R1),试剂2(R2)(以下简称R2)。
R1:磷酸盐缓冲液(pH7.4)含高分子强化剂(聚乙二醇6000),含0.095%的叠氮化钠。
R2:Rf抗体试剂抗人Rf抗体,含0.095%的叠氮化钠。
2.1 外观液体双试剂: R1:无色澄清液体, R2:浅黄色澄清液体。
2.2 净含量液体试剂的净含量不得低于标示体积。
2.3 空白吸光度在37℃、340 nm波长、1cm光径条件下,试剂空白吸光度应<0.08 ABS。
2.4 分析灵敏度浓度为33IU/mL时,吸光度变化范围在(0.008~0.08)之间。
2.5 线性在[2,300]IU/mL线性范围内,线性相关系数r2≥0.995。

血清类风湿因子(RF)的检测1.目的规范类风湿因子(RF)检测试验,确保检测结果准确性和重复性。
2.范围本操作规程适用于生化室工作人员、实习人员、进修人员的操作前培训。
3.术语4.测定原理样本中RF与胶乳颗粒超敏化的变性的人IgG抗体反应,出现凝集反应,在波长660nm处检测其吸光度的变化,其变化程度与样本中的RF含量成正比。
5. 标本采集与处理5.1标本类型:标本最好不要溶血。
留取标本后请尽快分离血清/血浆。
5.2标本稳定性:血清标本在2-8℃稳定48天,或-20℃可稳定6个月。
6. 试剂6.1试剂:本科使用金斯尔试剂盒,即用式液体试剂。
试剂内主要成分如下:规格: R1 3×20ml R2 1×20ml6.2试剂准备试剂为液体双试剂,开瓶即可使用。
6.3试剂稳定性原装试剂在2~8℃避光保存,稳定期12个月。
试剂开瓶载机2~8℃稳定28天。
7.仪器参数设定AU2700参数设定:金斯尔试剂仪器参数具体参加试剂厂家提供的相应仪器的参数说明书.8.校准:具体参见临床生化校准程序8.1 校准条件:8.1.1仪器光路系统经过光路保养或更换光源等重要部件后。
8.1.2仪器经过大保养后。
8.1.3挪动仪器的安装地点。
8.1.4更换试剂批号。
8.1.5室内质控失控。
8.2 AU2700金斯尔试剂系统的校准:8.2.1 准备:金斯尔配套校准物.8.2.2 保存和稳定性:原校准品在2~8℃保存至有效期。
8.2.3保存位置:2号冰箱。
8.2.4操作步骤:蓝色样本架的1号位置放蒸馏水;黄色样本架的相应位置放定标液→仪器主画面[USER] →[Calibration] →[选择校准项目]→[START]→[YES]。
9.室内质控及失控纠正:见临床生化室内质控程序9.1质控物来源:柏乐液体质控品(批号:45612/45613)。
9.2质控物储存条件及准备:-15~-20℃保存至有效期,从低温冰箱取出后室温平衡30分钟。

本试剂盒用于体外定量测定人血清或血浆类风湿因子。
【产品信息】货号试剂盒规格170229910021 试剂1 5×25ml+试剂2 1×25ml 170229910730 试剂1 4×20ml+试剂2 2×8ml 170209910059 5×1ml TruCal RF (类风湿因子校准品)5个不同浓度水平的校准品【摘要】类风湿因子(RF)是一类自身抗体,包括所有类型的免疫球蛋白。
它们是抗变性或聚合IgG分子Fc片段的抗体[1]。
诊断所检测的RF主要是IgM类RF,用来检出各种类风湿疾病,是炎症的起源[2]。
大约70%~80%的类风湿性关节炎(RA)患者RF为阳性,但是并不特异,因为RF浓度的升高还出现在非类风湿疾病中。
在无RA临床症状的高龄人群中,阳性率达到大约10%[3]。
检测RF为鉴别诊断风湿疾病提供了重要的信息[4]。
另外,RA中的高浓度RF值常和疾病的进行性临床发展有关。
但是RF的阳性结果必须结合临床或其他检验结果予以证实。
【方法】免疫透射比浊终点测定法。
【原理】使用热聚合IgG和样品中的类风湿因子进行抗原-抗体反应,形成抗原-抗体复合物,进行透射比浊终点测定。
【试剂】在测定时的各组分和浓度试剂1(R1):磷酸缓冲液pH 7.4 40 mmol/L试剂2(R2):热聚合人IgG 适量试剂稳定性与贮存试剂避光保存于2~8℃,若无污染,可稳定至失效期。
试剂不可冰冻!注意事项1. 试剂中含叠氮钠(0.95g/L),不可入口,避免接触皮肤及粘膜。
2. 应采取必要的预防措施使用试剂。
废液处理参照各地方法规要求。
试剂准备试剂为即用式。
未提供的实验所需物品9 g/L氯化钠溶液一般的实验室仪器设备【标本】血清,肝素或EDTA血浆。
不要使用含氟化钠的血样收集瓶。
稳定性:20-25℃保存可稳定1天2-8℃保存可稳定3天-20℃保存可稳定4周不可使用已被污染的标本。

类风湿因子RF测定1检验目的指导本室工作人员规范操作本检测项目,确保检测结果的准确。
2原理RF是针对自身的变性IgG分子结晶片段的一种自身抗体。
本试剂将人微球蛋白胶合于胶乳微粒,与待测样本中的RF 发生免疫反应,引起微粒的凝集,导致反应体系浊度增加,该浊度的高低在一定量抗体存在时与抗原的含量成正比。
与通过同样处理的标准液比较,即可计算出样本中的RF。
3标本要求3.1使用新鲜血清,不使用血浆.3.2在采集血液后2h分离血清.3.38h内不能及时测定血清可存放于2-80C冰箱保存,3天后测定的血清置-150C―-200C 冰冻保存,但冰冻血清只能复融一次.3.4严重溶血或脂血的标本不能作测定.4试剂4.1试剂:本科使用浙江伊利康生物技术限公司的试剂盒. (浙食药监械(准)字2014第2400384号YZB/浙2314-40-2014)4.1.1试剂盒组成如下:R1三羟甲基氨基缓冲液:20mmol/L叠氮钠:0.95g/LR2:类风湿因子致敏胶乳液:适量叠氮钠:0.95g/L4.1.2 试剂准备:试剂为即用式。
4.1.3 试剂稳定性与贮存:在2~8℃避光、密封的储存条件下,试剂盒自生产之日起有效期为12个月。
4.1.4 变质指示:当试剂有看得见的微生物生长,有浊度,或者未开盖的液体有沉淀时,表明试剂已变质,不能继续使用。
4.1.5 注意事项:试剂中含有稳定剂,可能存在一定的刺激作用和毒性,请勿直接接触皮肤及眼睛。
一旦接触,即用大量清水冲洗。
请勿吞服。
4.2 校准品:使用浙江伊利康生物技术限公司提供的RF校准品对自动分析仪进行校准。
4.3 质控品:使用正常值、病理值复合控制品。
5 仪器AU2700生化分析仪,罗氏P800生化分析仪, 西门子ADVIA-2400生化分析仪,东芝TBA-120生化分析仪6 操作步骤6.1 样品的准备:将标好号的样品离心后放到仪器规定的位置。
6.2 试剂的检测:仪器开机后,检查各种试剂的位置,体积等确认无误后方可进行测定。
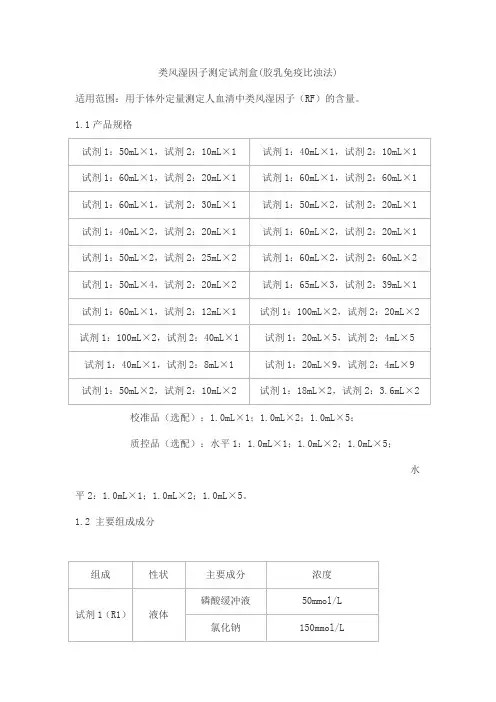
类风湿因子测定试剂盒(胶乳免疫比浊法)适用范围:用于体外定量测定人血清中类风湿因子(RF)的含量。
1.1产品规格校准品(选配):1.0mL×1;1.0mL×2;1.0mL×5;质控品(选配):水平1:1.0mL×1;1.0mL×2;1.0mL×5;水平2:1.0mL×1;1.0mL×2;1.0mL×5。
1.2 主要组成成分校准品靶值批特异,详见校准品瓶签。
质控品质控范围批特异,详见质控品瓶签。
2.1 外观试剂1应为无色澄清液体,试剂2应为无色或乳白色液体。
校准品、质控品均为白色冻干品,复溶后均为无色至淡黄色澄清液体;试剂盒标签标识清晰,外包装完整无损。
2.2 装量试剂液体成分的装量不少于瓶签标示量。
2.3 试剂空白在570nm(540nm~600nm)处测定试剂空白吸光度,应≤1.0;2.4 分析灵敏度测试100IU/mL的被测物时,吸光度变化(ΔA)应≥0.01。
2.5空白限试剂盒的空白限≤1.6IU/mL。
2.6 线性2.6.1 在[10,140]IU/mL区间内,线性相关系数r≥0.990。
2.6.2 在[10,40)IU/mL区间内,线性绝对偏差不超过±6IU/mL;在[40,140]IU/mL区间内,线性相对偏差不超过±15%。
2.7 精密度2.7.1 重复性测试高、低两浓度样本,其结果的变异系数应不超过10%。
2.7.2 批间差随机抽取三批试剂盒测试同一份样本,批间极差(R)应不超过15%。
2.7.3瓶内均匀性校准品,质控品的瓶内变异系数CV应≤10%。
2.7.4瓶间均匀性校准品、质控品批内瓶间变异系数CV应≤10%。
2.8 准确度待检系统与比对系统测值的相关系数r≥0.975;在[10,40)IU/mL 区间内,绝对偏差不超过±6IU/mL;在[40,140] IU/mL区间内,相对偏差不超过±15%。

SOP标准操作程序类风湿因子(RF)测定试剂盒1 实验原理:病人样品,标准液或质控中的类风湿因子(RF)与包被有人γ-球蛋白的胶乳颗粒发生免疫反应,形成免疫复合物产生混浊。
病人样品产生的浊度与标准液中类风湿因子(RF)标准产生的浊度来比较,进行计算。
2 标本的收集与处理:2.1 病人准备:无特殊要求。
最好用禁食的标本以减少乳糜血的干扰。
2.2. 抗凝剂:血清、肝素或EGTA血浆,标本最好不要溶血。
留取标本后请尽快分离血球血浆。
2.3 标本的稳定性:在室温条件下(15~25℃)可以稳定一周。
3 材料:3.1 材料:无需配制,开瓶即用,540nm试剂的空白吸光度超过1.5ABS试剂失效。
工作液:R1与R2按9:1混合,2-8℃可稳定20天。
标准品用1ml蒸馏水复溶,2-8℃稳定一个月。
3.2 试剂的贮存:3.2.1.当保存于2~8℃,不开盖情况下至标签的失效期。
3.2.2. 开盖后放于仪器中可以稳定30天。
3.2.3 开盖后避免污染。
3.3 变质指示:当试剂有浊度时,表明有细菌污染,不能继续使用。
4 类风湿因子(RF)测定试剂盒(日立7600生化分析仪)册或《7600A使用说明书》中查到。
5 计算:采用多点定标法,用RF标准液的吸光度值与相应的RF浓度作图,绘制标准曲线,从标准曲线上查得血清样品的RF浓度。
RF标准液浓度(IU/ml)见标签。
6 试剂性能概要采用科美公司规定的参数进行测定,线性范围(或可报告范围)0-160U/L。
7 超出线性范围(或可报告范围)的处理如样本中(RF)的浓度大于160U/L 时,需对样本进行稀释后再测定,结果乘以稀释倍数。
8 方法的局限性抗干扰能力:胆红素≤20mg/dl,血红蛋白≤10g/L,甘油三酯≤1000mg/dl对测定无干扰。
一些药物等可能会产生干扰。
9 其他必须说明的内容9.1 标准度稀释时,应严格按照说明书浓度进行。
9.2 胶乳试剂在使用前应轻轻摇匀。
9.3 所有的试剂已进行乙肝表面抗原,丙肝抗体和抗艾滋病毒抗体检测(FDA方法),结果阴性。

类风湿因子(RF)测定(胶乳凝集法)作业指导书1.原理RF是一种主要发生于类风湿性关节炎患者体内的抗人变性IgG抗体,可与IgG的Fc段结合。
将变性IgG包被于聚乙苯烯胶乳颗粒上,此致敏胶乳在与待测血清中的RF相遇时,即发生肉眼可见的凝集。
2.标本采集2.1 采集前病人准备:受检者应空腹2.2 标本种类:血清2.3 标本要求:采集病人静脉血2ml,室温放置不超过4小时,分离血清备用。
3.标本储存:2-8°C保存不应超过24小时,-20°C不应超过3个月,-70°C长期保存,应避免反复冻融。
4.标本运输:密封,室温运输。
5.标本拒收标准:污染、标本量不足、脂血或严重溶血标本不宜作此项检测。
6.试剂6.1 试剂名称:类风湿因子测定试剂6.2 试剂生产厂家:西班牙BioSystems S.A.6.3 包装规格:60Test/Kit6.4 试剂盒组成:RF胶乳悬液,阳性对照血清,阴性对照血清。
6.5 试剂储存条件及有效期:2-8°C避光保存,有效期6个月。
7.操作步骤7.1 平衡:将试剂盒各组分取出,平衡至室温(18-25°C)。
7.2 分别吸取50μl阳性对照和阴性对照血清均匀铺加在纸卡的两个圆圈中。
7.3 吸取50μl待测血清均匀铺加在纸卡的另一圆圈中。
7.4 加胶乳试剂50μl于上述血清中。
7.5 处分混匀后立即摇动反应板,2分钟内于直射阳光下观察。
8.结果判断:出现明显凝集者为阳性。
9.质量控制:每次测定均做阴阳对照,阴性对照不出现凝集物,阳性对照出现明显凝集。
10. 参考范围:阴性11. 临床意义:RF是一种以变性IgG为靶抗原的自身抗体。
RF阳性常见于类风湿关节炎患者和自身免疫性疾病患者。
少数健康人也会出现阳性结果。
12. 操作性能:灵敏度、特异性高。
13. 方法局限性:检测出的RF主要为IgM类。
14. 注意事项14.1试剂的使用:在大于10°C室温条件下进行;使用前必需充分混匀。
类风湿因子测定试剂盒(胶乳免疫比浊法)适用范围:本试剂适用于体外定量测定人血清中类风湿因子(RF)的含量。
1.1包装规格序号规格序号规格1 试剂1:1×40ml;试剂2:1×10ml。
2 试剂1:2×40ml;试剂2:2×10ml。
3 试剂1:5×16ml;试剂2:5×4ml。
4 试剂1:4L;试剂2:1L。
1.2主要组成成分本试剂由试剂1(R1)和试剂2(R2)组成试剂1(R1):氯化铵缓冲液100mmol/L氯化钠0.95g/L试剂2(R2):Tris缓冲液100mmol/L包被有IgG的胶乳颗粒悬液0.17w/v%2.1 外观试剂盒外观应整洁,文字符号标识清晰;R1为无色液体,R2为白色颗粒悬浊液体。
液体试剂不得有沉淀和絮状物。
2.2 装量试剂瓶内液体装量应不少于标示值。
2.3 空白吸光度以生理盐水为样品,在37℃、660nm波长、1cm光径条件下,吸光度≤1.4。
2.4 分析灵敏度浓度为44IU/ml的样本,吸光度差值△A>0.04。
2.5 准确性回收试验,回收率在90%~110%范围内。
2.6 重复性用不同浓度的两个样本进行检测,各重复检测10次,其批内变异系数(CV)应不超过10%。
2.7 线性2.7.1在(2,160)IU/ml范围内,线性相关系数r应不低于0.990;2.7.2 在(2,16]IU/ml范围内绝对偏差不超过±1.6IU/ml;(16,160)IU/ml范围内相对偏差不超过±10%。
2.8 批间差用三个批号的试剂盒测定同一份样本,试剂盒批间相对极差应不超过15%。
2.9 稳定性试剂盒在2~8℃避光保存,可稳定12个月。
取到效期后的样品检测试剂空白吸光度、分析灵敏度、准确度、重复性、线性范围应分别符合2.3、2.4、2.5、2.6、2.7的要求。
类风湿因子(RF)定量测定标准操作程序1.摘要本试剂盒适用于体外临床检验,用于测定人血清中类风湿因子的浓度。
RF的测定对类风湿性关节炎的诊断有一定的参考价值。
2.适用范围程序适用于AU5811自动生化分析仪检测血清、血浆中RF的浓度。
3.职责使用AU5811自动生化分析仪进行测定RF浓度的工作人员要严格按照本SOP程序进行,室负责人监督管理;本SOP的改动,可由任一使用本SOP的工作人员提出,并报经生化室负责人、科主任签字批准生效。
4.检测方法上海科华生物生产的类风湿因子定量测定试剂盒采用的是免疫透射比浊法。
5.原理试剂中的人IgG包被于聚苯乙烯粒子上,样本中RF与试剂中包被于聚苯乙烯粒子上的人IgG结合,形成不溶性免疫复合物,该免疫复合物由于包被的聚苯乙烯粒子而使浊度进一步放大,在人IgG足量的情况下,其浊度与人血清中RF含量成正比,与相同条件下操作的校准品比较,通过剂量/反应曲线求出样品中RF的含量。
6.仪器AU5811自动生化分析仪7.试剂7.1试剂来源:上海科华生物工程股份有限公司提供7.2试剂瓶内主要成分:MOPSO缓冲液(PH7.4)、0.2M、NaN3、包被人IgG的聚苯乙烯粒子7.3试剂稳定性:试剂避光保存于2-8℃,若无污染,可稳定至失效期,本试剂有效期为12个月。
试剂不可冰冻。
R1、R2:打开后冷藏于分析仪中可稳定28天。
7.4试剂准备:试剂为即用式。
8.标准品和质量控制8.1校准程序:使用上海科华生物工程股份有限公司试剂盒内提供的标准品对自动分析仪进行校准。
由a、b、c、d四只组成,浓度见说明书。
按照公司标准品使用要求,使用前用0.5ml的生理盐水复溶,待完全混合均匀后(约30分钟)再使用。
校准后,仪器自动对校准品吸光度通过合适的数学模型绘制校准曲线。
8.2质控品:使用罗氏公司提供的生化复合定值质控血清做为室内质控品。
每日在测定前做一次质控,加试剂后做一次质控。
该质控品为干粉包装,在2-8℃冰箱可稳定到失效期,使用前用5ml去离子水复溶,待质控物充分溶解(大约30分钟)后使用。
类风湿因子多重微珠免疫法检测试剂盒说明书(多重微珠免疫法检测类风湿因子RF IgM抗体)产品编号:A91001M简介:宙斯(Zeus)科技公司的AtheNA Multi-Lyte 类风湿因子检测试剂盒是定性或半定量地检测类风湿因子的IgM抗体。
本试剂盒用于类风湿性关节炎的诊断。
本试剂盒用于体外诊断。
背景:类风湿性关节炎(RA)是一种慢性病,往往会发展为关节炎。
RA是一种高度变异疾病,从轻微持久的病症到破坏性的多发性关节炎伴随系统性脉管炎(1)。
这种病症据估计在人群中1-2%的发生率(2),而且妇女发病的可能性是男性的两倍(1)。
早期病症的临床特征包括淋巴结病、厌食、虚弱、疲劳和晨僵或疼痛(1,3)。
和RA有关的标志物通过实验室检测得到。
常见的有类风湿因子RF、抗核抗体ANA、免疫复合物等(3)。
检测血清中的RF IgM对诊断RA较为重要而且可以帮助疾病预后诊断(6)。
RF是一类免疫球蛋白,是和人(或其他属种的)IgG的Fc部分发生反应的抗体(1,4)。
RF是一种多克隆抗体,与IgG的多数部位发生反应。
分为三个主要免疫球蛋白IgM、IgG和IgA,而IgE RF也有提及(5)。
IgM和IgG是最常见的,在诊断为RA的病人中大约75%为IgM RF(4)。
另外RF与一些细菌性或病毒性感染有关,如肝炎或单核细胞及一些慢性感染如结核杆菌、寄生虫性疾病、亚急性细菌性心内膜炎和癌症(1)。
同时在年龄大于65岁的人群中约有15%的人RF水平有上升(4)。
AtheNA Multi-Lyte TM抗核抗体类风湿因子检测系统检测原理:宙斯公司的AtheNA Multi-Lyte类风湿因子检测系统用来检测人血清中类风湿因子的IgM抗体。
整个检测步骤包括两步温育过程。
1、待测血清(经过稀释)与复合悬浮微珠在孔中温育。
复合悬浮微珠为不同荧光编码的聚苯乙烯微粒(polystyrene microspheres); 不同颜色的微粒上结合有不同的抗原。
大白鼠大白鼠类风湿因子类风湿因子(RF)酶联免疫酶联免疫分析分析分析试剂试剂盒使用说明书盒使用说明书盒使用说明书本试剂盒仅供研究使用。
检测范围检测范围:: 96T0.1 U/L -40 U/L使用目的使用目的::本试剂盒用于测定大白鼠血清、血浆及相关液体样本中类风湿因子(RF)含量。
实验原理本试剂盒应用双抗体夹心法测定标本中大白鼠类风湿因子(RF)水平。
用纯化的大白鼠类风湿因子(RF)抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入类风湿因子(RF),再与HRP 标记的类风湿因子(RF)抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB 显色。
TMB 在HRP 酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的类风湿因子(RF)呈正相关。
用酶标仪在450nm 波长下测定吸光度(OD 值),通过标准曲线计算样品中大白鼠类风湿因子(RF)浓度。
试剂盒组成 1 30倍浓缩洗涤液 20ml ×1瓶 7 终止液6ml ×1瓶 2 酶标试剂 6ml ×1瓶 8 标准品(80 U/L ) 0.5ml ×1瓶 3 酶标包被板 12孔×8条 9 标准品稀释液 1.5ml ×1瓶 4 样品稀释液 6ml ×1瓶 10 说明书 1份 5 显色剂A 液 6ml ×1瓶 11 封板膜 2张 6显色剂B 液6ml ×1/瓶12密封袋1个标本标本要求要求1.标本采集后尽早进行提取,提取按相关文献进行,提取后应尽快进行实验。
若不能马上进行试验,可将标本放于-20℃保存,但应避免反复冻融2.不能检测含NaN3的样品,因NaN3抑制辣根过氧化物酶的(HRP )活性。
操作步骤1. 标准品的稀释:本试剂盒提供原倍标准品一支,用户可按照下列图表在小试管中进行稀释。
40 U/L 5号标准品 150µl 的原倍标准品加入150µl 标准品稀释液 20 U/L 4号标准品 150µl 的5号标准品加入150µl 标准品稀释液 10 U/L 3号标准品 150µl 的4号标准品加入150µl 标准品稀释液 0.5 U/L 2号标准品 150µl 的3号标准品加入150µl 标准品稀释液 0.25 U/L1号标准品150µl 的2号标准品加入150µl 标准品稀释液2. 加样:分别设空白孔(空白对照孔不加样品及酶标试剂,其余各步操作相同)、标准孔、待测样品孔。
类风湿因子(RF)测定试剂盒(胶乳免疫比浊法).1包装规格.试剂1:1×45mL、试剂2:1×15mL;.试剂1:1×45mL、试剂2:1×15mL、校准品:6×1mL(6个浓度)、质控品:2×1mL (2个水平);.试剂1:2×45mL、试剂2:2×15mL;.试剂1:2×45mL、试剂2:2×15mL、校准品:6×1mL(6个浓度)、质控品:2×1mL (2个水平);.试剂1:2×60mL、试剂2:2×20mL;.试剂1:1×24mL、试剂2:1×8mL;校准品:6×1mL(6个浓度)、质控品:2×1mL (2个水平);.300测试/盒(试剂1:1×45mL、试剂2:1×15mL)。
.主要组成成分1.2.1试剂组成试剂1:甘氨酸缓冲液0.1mol/L;试剂2:变性IgG致敏的乳胶颗粒、聚苯乙烯微球≤1%(w/v)。
1.2.2校准品组成校准品:类风湿因子、新生牛血清、稳定剂<0.1%。
目标浓度:校准品1:0.0IU/mL、校准品2:7.5±1.5IU/mL、校准品3:15.0±3.0IU/mL、校准品4:30.0±6.0IU/mL、校准品5:60.0±12.0IU/mL、校准品6:120.0±24.0IU/mL。
批特异,具体定值见标签。
1.2.3质控品的组成质控品:类风湿因子(RF)、新生牛血清、稳定剂<0.1%。
定值范围:质控品1:(8.0~20.0)IU/mL、质控品2:(25.0~55.0)IU/mL,批特异,具体定值见标签。
2.1外观.试剂盒各组分应齐全、完整、液体无渗漏;包装标签应清晰,无磨损;.试剂1应为无色或淡黄色澄清溶液,试剂2应为乳白色悬浊液。
类风湿因子(RF)定量测定标准操作程序
1.摘要
本试剂盒适用于体外临床检验,用于测定人血清中类风湿因子的浓度。
RF的测定对类风湿性关节炎的诊断有一定的参考价值。
2.适用范围
程序适用于AU5811自动生化分析仪检测血清、血浆中RF的浓度。
3.职责
使用AU5811自动生化分析仪进行测定RF浓度的工作人员要严格按照本SOP程序进行,室负责人监督管理;本SOP的改动,可由任一使用本SOP的工作人员提出,并报经生化室负责人、科主任签字批准生效。
4.检测方法上海科华生物生产的类风湿因子定量测定试剂盒采用的是免疫透射比浊法。
5.原理
试剂中的人IgG包被于聚苯乙烯粒子上,样本中RF与试剂中包被于聚苯乙烯粒子上的人IgG结合,形成不溶性免疫复合物,该免疫复合物由于包被的聚苯乙烯粒子而使浊度进一步放大,在人IgG足量的情况下,其浊度与人血清中RF含量成正比,与相同条件下操作的校准品比较,通过剂量/反应曲线求出样品中RF的含量。
6.仪器
AU5811自动生化分析仪
7.试剂
7.1试剂来源:上海科华生物工程股份有限公司提供
7.2试剂瓶内主要成分:
MOPSO缓冲液(PH7.4)、0.2M、NaN3、包被人IgG的聚苯乙烯粒子
7.3试剂稳定性:试剂避光保存于2-8℃,若无污染,可稳定至失效期,本试剂有效期为
12个月。
试剂不可冰冻。
R1、R2:打开后冷藏于分析仪中可稳定28天。
7.4试剂准备:试剂为即用式。
8.标准品和质量控制
8.1校准程序:使用上海科华生物工程股份有限公司试剂盒内提供的标准品对自动分析
仪进行校准。
由a、b、c、d四只组成,浓度见说明书。
按照公司标准品使用要求,使用前用0.5ml的生理盐水复溶,待完全混合均匀后(约30分钟)再使用。
校准后,仪器自动对校准品吸光度通过合适的数学模型绘制校准曲线。
8.2质控品:使用罗氏公司提供的生化复合定值质控血清做为室内质控品。
每日在测定
前做一次质控,加试剂后做一次质控。
该质控品为干粉包装,在2-8℃冰箱可稳定到失效期,使用前用5ml去离子水复溶,待质控物充分溶解(大约30分钟)后使用。
8.3质控数据管理:按程序对检验后的质控结果进行转换,对质控数据进行分析处理,如出现失控值,应及时分析失控原因,并填写好相关失控记录。
8.4质控判断规则:按《Westgard多规则质控方法测定标准操作程序》
8.5室间质评:分别参加河北省临检中心室间质评,对回报的室间质评结果按《室间质
量评价程序》进行处理。
9.标本
9.1标本为新鲜血清标本,避免溶血。
若不能及时测定,请尽快置于-20℃保存,避免反
复冻融。
9.2标本拒收:由实验室人员核收送来标本,如有溶血、已被污染、标识不清或与申请
单不符状况,一律要求重新留取标本。
9.3标本处理:收集编号后离心获取血清/血浆以备检测使用。
10.测定程序
10.1分析参数:详见参数表。
10.2操作步骤:签收样本→离心→上机检测→审核报告→签发报告→标本保存。
10.3获取结果:在AU5811仪器上或AU5811传送的中文系统电脑上查找相应结果。
10.4结果报告:对检验后的结果进行审核,系统分析,判断结果的可报告性。
可报告的
结果直接发报告,对不可报告结果进行复检后发报告。
11.计算
校准品校准项目后,测定室内质控,质控结果符合质控要求后方可测定样本。
无需手工计算,每个标本的结果自动打印
12.废液处理
参阅检验科《安全手册》废液处理标准规程处理。
13.操作性能
13.1可报告范围:本法对RF检测范围为10-100IU/ml。
当样品测定值超过上限时,应将
样品用9 g/L氯化钠溶液稀释后重新测定,结果乘以稀释倍数。
13.2特异性/干扰:当样品中胆红素浓度≤700mg/L,血红蛋白浓度≤8000mg/L,脂类低
于4000mg/L时对测定结果的影响可忽略。
极度溶血及脂血标本会影响测定。
13.3分析灵敏度:测试浓度为(30±5)IU/ml的样本,将测试结果换算成浓度为30IU/ml
的样本时,吸光度差值(⊿A)应≥0.01A
13.4精密度:批内变异系数CV≤10% 批间变异系数CV≤15%
14.注意事项
14.1试剂盒仅用于体外诊断。
测定结果仅作为相关疾病的临床诊断依据。
14.2 试剂中校准品采用献血者血清,经过测定HBsAg、抗-HIV1/2、抗-HCV、TP抗体
均为阴性。
但无法完全排除潜在感染的危险,应按有传染源的方式进行防护。
14.3 试剂盒中含有防腐剂叠氮钠,切勿吞咽,避免与皮肤及粘膜接触。
如不慎接触,应
用大量清水冲洗。
如误服,应立即上医院诊治。
15.参考值
健康成年人:≤14IU/ml。
如果结果做为诊断指标应结合病史及其它临床检查结果。
16.临床意义
类风湿因子(RF)是抗变性IgG抗体,常见于类风湿性关节炎病人的血清和滑液中,60-85%的类风湿关节炎的病例RF为阳性,因此,一般认为RF的检测对于类风湿性关节炎的诊断有一定的参考价值。
另外,在类风湿性关节炎药物疗效评价上,RF是否阴转或降低,被作为评价药物是否为致缓解性药物的一个指标。
17.支持性文件
17.1AU5811自动生化分析仪使用说明书。
17.2AU5811自动生化分析仪分析参数。
17.3上海科华生物工程股份有限公司提供的试剂说明书。
18.参考文献
18.1《全国临床检验操作规程》第三版,叶应妩等,2006
18.2Robert W et al:Clinica Chimica Acta.167:1-20
18.3Terry L. Moor et al: Clin Biochem.26:75-84。