常见物质的检验完美版
- 格式:pdf
- 大小:31.95 KB
- 文档页数:6

高中化学常见的物质检验方法及规范用语1、SO42-:取少量样品,加入稀HCl(aq)酸化,再加入BaCl2溶液,生成不溶于酸的白色沉淀,证明样品中有SO42-。
2、Cl-:取少量样品,加入稀HNO3(aq)酸化,加入AgNO3溶液,生成不溶于酸的白色沉淀,证明样品中有Cl-。
3、SO2:取少量样品,通入品红溶液,品红溶液红色褪去,再加热溶液,红色恢复,证明样品中有SO2。
4、Cl2:取少量样品,将湿润的淀粉KI试纸放在集气瓶口处,试纸变蓝,证明样品中有Cl2。
5、NH3:取少量样品,将湿润的红色石蕊试纸放在集气瓶口处,试纸变蓝,证明样品中有NH3。
6、浓氨水:用玻璃棒分别蘸取少量样品和浓盐酸,相互靠近,冒白烟,证明样品为浓氨水。
7、NO:取少量样品,通入少量空气,气体由无色变为红棕色,证明样品为NO。
8、NH4+:取少量溶液,加入少量NaOH溶液并加热,生成可使湿润的红色石蕊试纸变蓝的气体,证明样品中有NH4+。
9、Fe3+:取少量溶液,加入KSCN溶液,溶液变红;取少量溶液,加入NaOH溶液,生成红褐色沉淀,证明样品中有Fe3+。
10、Al3+:取少量溶液,加入少量NaOH溶液,生成白色沉淀,再加入过量NaOH溶液,沉淀逐渐消失,证明样品中有Al3+。
11、Mg2+:取少量溶液,加入过量NaOH溶液,生成白色沉淀,证明样品中有Mg2+。
12、Fe2+:取少量溶液,加入KSCN溶液,溶液无变化,加入氯气,溶液变红,证明样品中有Fe2+。
13、I-:取少量溶液,加入稀硝酸酸化,加入AgNO3溶液,生成黄色沉淀(AgI),加入Cl2的CCl4溶液,下层溶液变为紫红色,证明样品中有I-。
14、Br-:取少量溶液,加入稀硝酸酸化,加入AgNO3溶液,生成淡黄色沉淀(AgBr),加入Cl2的CCl4溶液,下层溶液变为橙红色,证明样品中有Br-。
15:取少量样品,加入浓溴水,生成白色沉淀;取少量样品,加入FeCl3溶液,溶液变为紫色,证明样品为苯酚。

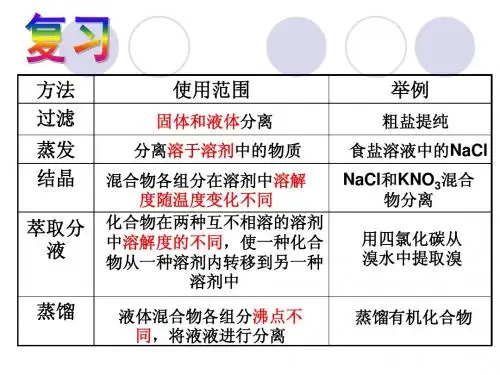

初中化学物质的检验:1、气体的检验[1]氧气:[2]氢气:[3]二氧化碳:[4]氨气:[5]水蒸气:[6]一氧化碳:[7] 氮气:2、离子的检验.(1)酸液(H+):(2)碱液(OH-):(3)盐酸和Cl—:(4)硫酸和SO42-:(6)铵盐(NH4+):(7)Cu2+:(8)Fe2+:(9)Ca2+:(10) CO32—:如何检验:NH4Cl、NH4SO4、KCl、KSO4这四种化肥?初中化学物质的检验:1、气体的检验[1]氧气:带火星的木条放入瓶中,若木条复燃,则是氧气.[2]氢气:在玻璃尖嘴点燃气体,罩一干冷小烧杯,观察杯壁是否有水滴,往烧杯中倒入澄清的石灰水,若不变浑浊,则是氢气.[3]二氧化碳:通入澄清的石灰水,若变浑浊则是二氧化碳.[4]氨气:湿润的红色石蕊试纸,若试纸变蓝,则是氨气.[5]水蒸气:通过无水硫酸铜,若白色固体变蓝,则含水蒸气.[6]一氧化碳:在玻璃尖嘴点燃气体,在火焰上方罩一干冷小烧杯,观察烧杯内壁无水珠生成,然后将烧杯迅速倒转,往烧杯中倒入澄清的石灰水,若澄清的石灰水变浑浊,则是一氧化碳.[7] 氮气:将燃烧的木条伸入集气瓶中,木条熄灭,然后向集气瓶中倒入澄清石灰水,石灰水不变浑浊。
2、离子的检验.(1)酸液(H+):⑴用紫色石蕊试液或PH试纸⑵活泼金属(如:镁条、锌粒等)⑶不溶性碱(如:氢氧化铜等)⑷某些金属氧化物(如:铁锈) {5}碳酸盐(如:碳酸钠等)(2)碱液(OH-):⑴紫色石蕊试液或无色酚酞或PH试纸⑵某些可溶性盐(如:硫酸铜、氯化铁)(3)盐酸和Cl—:用AgNO3溶液和稀HNO3,若产生白色沉淀,则是氯离子(4)硫酸和SO42-:硝酸钡溶液Ba(NO3)2和稀硝酸/先滴加稀盐酸再滴入氯化钡BaCl2 区别Cl-和SO42-:先用 Ba(NO3)2溶液再用AgNO3溶液 (5)CO32-:用盐酸和石灰水(6)铵盐(NH4+):氢氧化钠溶液并加热,把湿润的红色石蕊试纸放在试管口,产生使湿润的红色石蕊试纸变蓝的气体。

2、Cl2:黄绿色刺激性气体有毒;①使湿润淀粉碘化钾试纸变蓝:Cl2+2KI=2KCl+I2 I2遇淀粉变蓝;②使湿润蓝色石蕊试纸先变红后变白:Cl2+H2O=HCl+HClO 6、NO2 :红棕色气体有刺激性气味、有毒,溶于水、水溶液呈酸性,能使紫色石蕊试液变红:3NO2+H2O=2HNO3+NO7、NO:无色气体有毒;在空气中立即变为红棕色:2NO+O2=2NO29、SO2 :无色有刺激性气味、有毒;①通入品红溶液,品红褪色加热又恢复颜色;②使澄清石灰水变浑浊:SO2+Ca(OH)2=CaSO3+H2O;③使酸性高锰酸钾溶液褪色:5SO2+2MnO4-+ 2H2O =2Mn2++5SO42--+4H+10、HCl :无色刺激性气味;①能使湿润蓝色石蕊试纸变红:HCl=H++Cl-;②用蘸浓氨水玻璃棒靠近冒白烟:NH3+HCl=NH4Cl;③气体通入HNO3酸化的AgNO3溶液,有白色沉淀生成:HCl+AgNO3=AgCl↓+HNO3 (AgCl不溶于HNO3)11、H2S:无色臭鸡蛋气味有毒;遇(CH3COO)2Pb 、CuSO4溶液均产生黑色沉淀:2CH3COO-+Pb2++H2S=PbS↓+2CH3COOH;Cu2++H2S=CuS↓+2H+ 12、NH3:无色刺激性气味;①遇湿润红色石蕊试纸变蓝:NH3+H2ONH3·H2ONH4++OH-;②用蘸浓盐酸玻璃棒靠近冒白烟:NH3+HCl==NH4Cl15、C2H4:无色稍有气味;②使KMnO4(H+)溶液褪色;③使溴水褪色:CH2==CH2+Br2→CH2Br-CH2Br216、C2H2:无色无味;;②使KMnO4(H+)溶液褪色;③使溴水褪色:CH≡CH+2Br2→CHBr2-CHBr21、焰色反应:Na+:黄色;K+:紫色(透过蓝色钴玻璃观察);Ca2+:砖红色;3、NH4+:在试液中加强碱(NaOH)加热,产生使湿润红色石蕊试纸变蓝的气体;NH4++OH-NH3↑+H2O;NH3+H2O NH3·H2O NH4++OH-4、Fe3+ :①通KSCN或NH4SCN溶液呈血红色:Fe3++SCN-==[ Fe(SCN)]2+ ;②通NaOH溶液红褐色沉淀:Fe3++3OH-==Fe(OH)3↓5、Fe2+ :①遇NaOH溶液生成白色沉淀在空气中迅速转化成灰绿色最后变成红褐色沉淀:Fe3++2OH-=Fe(OH)2↓;4Fe(OH)2+O2+2H2O==4Fe(OH)3 ;②试液中加KSCN少量无明显变化再加氯水出现血红色;2Fe2++Cl2==2Fe3++2Cl-;Fe3++SCN-==[Fe(SCN)]2+6、Mg2+:遇NaOH溶液有白色沉淀生成,NaOH过量沉淀不溶解:Mg2++2OH-==Mg(OH)2↓,但该沉淀能溶于NH4Cl溶液;7、Al3+ :遇NaOH溶液(适量)有白色沉淀生成,NaOH溶液过量沉淀溶解:Al3++3OH-==Al(OH)3↓;Al(OH)3+OH-==AlO2-+2H2O8、Cu2+:遇NaOH溶液有蓝色沉淀生成,加强热变黑色沉淀:Cu2++2OH-==Cu(OH)2↓;Cu(OH)2CuO+H2O9、Ba2+ :遇稀H2SO4或硫酸盐溶液有白色沉淀生成,加稀HNO3沉淀不溶解:Ba2++SO42-==BaSO4↓10、Ag+;①加NaOH溶液生成白色沉淀,此沉淀迅速转变为棕色沉淀溶于氨水Ag++OH-==AgOH↓;2AgOH==Ag2O+H2OAgOH+2NH3·H2O==[ Ag(NO3)2]OH+2H2O②加稀HCl或可溶性氧化物溶液再加稀HNO3生成白色沉淀:Ag+ +Cl-==AgCl↓1、OH-:OH-碱性:①遇紫色石蕊试液变蓝;②遇酚酞试液变红;③遇湿润红色石蕊试纸变蓝;2、Cl-:遇AgNO3溶液有白色沉淀生成,加稀HNO3沉淀不溶解:Ag++Cl-=AgCl↓3、Br-:加AgNO3溶液有浅黄色沉淀生成,加稀HNO3沉淀不溶解:Ag++Br -=AgBr↓4、I-:①加AgNO3溶液有黄色沉淀生成,加稀HNO3沉淀不溶解:Ag++I-=AgI↓;②加少量新制氯水后再加淀粉溶液显蓝色:2I-+Cl2=I2+2Cl-;I2遇淀粉变蓝5、S2-:①加强酸(非强氧化性)生成无色臭鸡蛋气味气体:S2-+2H+=H2S↑;②遇Pb(NO3)2或(CH3COO)2Pb试液生成黑色沉淀,遇CuSO4试液产生黑色沉淀:Pb2++S2-=PbS↓;Cu2++S2-=CuS↓6、SO42-:加可溶性钡盐[BaCl2或Ba(NO3)2]溶液有白色沉淀生成后再加稀HCl 或稀HNO3沉淀不溶解:Ba2++SO42-=BaSO4↓7、SO32-:加强酸(H2SO4或HCl)把产生气体通入品红溶液中,品红溶液褪色:SO32-+2H+=H2O+SO2↑ SO2使品红溶液褪色8、CO32-:加稀HCl产生气体通入澄清石灰水,石灰水变浑浊:CO32-+2H+=H2O+CO2↑;CO2+Ca(OH)2=CaCO3↓+H2O9、HCO3-:取含HCO3-盐溶液煮沸,放出无色无味、使澄清石灰水变浑浊的气体;或向HCO3-溶液里加入稀MgSO4溶液,无现象,加热煮沸有白色沉淀MgCO3生成,同时放出CO2气体。
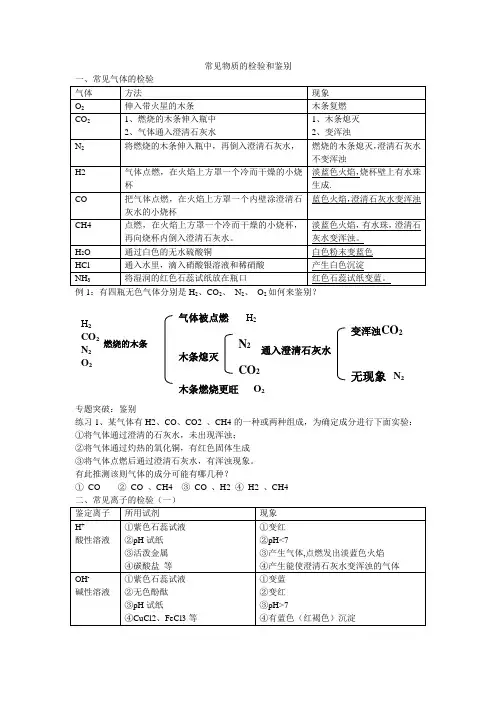
常见物质的检验和鉴别例1:有四瓶无色气体分别是H 2、CO 2、 N 2、 O 2如何来鉴别?专题突破:鉴别练习1、某气体有H2、CO 、CO2 、CH4的一种或两种组成,为确定成分进行下面实验: ①将气体通过澄清的石灰水,未出现浑浊; ②将气体通过灼热的氧化铜,有红色固体生成 ③将气体点燃后通过澄清石灰水,有浑浊现象。
有此推测该则气体的成分可能有哪几种?① CO ② CO 、CH4 ③ CO 、H2 ④ H2 、CH4H 2 CO 2N 2 O 2木条熄灭N 2 CO 2木条燃烧更旺O 2通入澄清石灰水 变浑浊CO 2无现象 N 2燃烧的木条 气体被点燃H 2三、鉴别物质的常用方法1、依据物质的物理性质(1)(观察“颜色”)白色粉末CuSO4 MgO Na2CO3NaOH等蓝色晶体CuSO4·5H2O黑色粉末 C CuO Fe3O4MnO2 铁粉红色固体Cu Fe2O3浅绿色溶液亚铁盐溶液(如FeSO4 )棕黄色溶液铁盐溶液(如FeCl3)蓝色溶液铜盐溶液(如CuSO4)(2)(观察固体的溶解性)(观察固体溶于水后是否有放热、吸热现象)溶于水后放热固体CaO NaOH溶于水后吸热固体KNO32、抓住“气体”——根据被鉴别物质发生反应是否产生气体,或根据气体的颜色、气味等来鉴别碳酸盐遇酸产生二氧化碳气体铵盐遇可溶性碱产生刺激性气味NH3活泼金属遇酸产生氢气3、分析沉淀——根据沉淀的颜色或性质鉴别物质。
(1)不溶于水但溶于酸的白色沉淀有BaCO3、CaCO3、Mg(OH)2等;(2)不溶于水和稀硝酸的白色沉淀有AgCl、BaSO4(3)蓝色沉淀:Cu(OH)2红褐色沉淀:Fe(OH)34、分析典型反应——根据焰色反应颜色来鉴别钠盐和钾盐。
钠盐 灼烧时火焰呈黄色 钾盐 透过蓝色钴玻璃片火焰呈紫色★多种试剂分步鉴别法(分组法)通常待测物都是无色溶液或白色固体无色溶液一般用酸碱指示剂分成酸性、中性、碱性几组 白色固体一般可加水,根据溶解性分组。
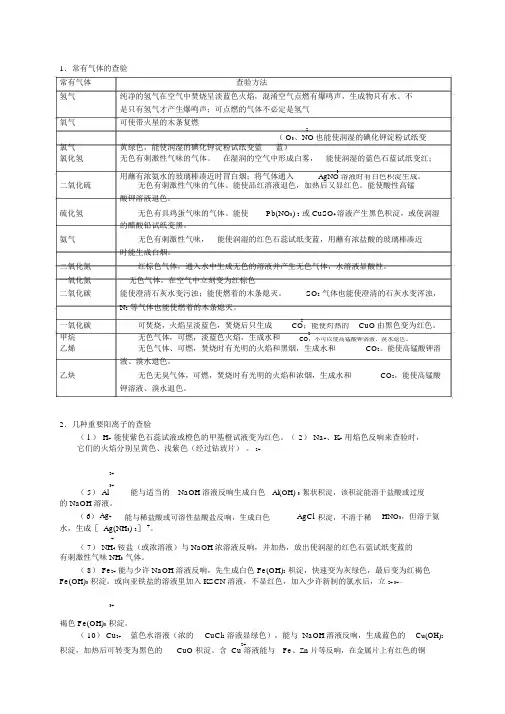
1.常有气体的查验常有气体查验方法氢气纯净的氢气在空气中焚烧呈淡蓝色火焰,混淆空气点燃有爆鸣声,生成物只有水。
不是只有氢气才产生爆鸣声;可点燃的气体不必定是氢气氧气可使带火星的木条复燃氯气黄绿色,能使润湿的碘化钾淀粉试纸变蓝2( O3、NO也能使润湿的碘化钾淀粉试纸变蓝)氯化氢无色有刺激性气味的气体。
在湿润的空气中形成白雾,能使润湿的蓝色石蓝试纸变红;用蘸有浓氨水的玻璃棒凑近时冒白烟;将气体通入3AgNO溶液时有白色积淀生成。
二氧化硫无色有刺激性气味的气体。
能使品红溶液退色,加热后又显红色。
能使酸性高锰酸钾溶液退色。
硫化氢无色有具鸡蛋气味的气体。
能使Pb(NO3) 2或 CuSO4溶液产生黑色积淀,或使润湿的醋酸铅试纸变黑。
氨气无色有刺激性气味,能使润湿的红色石蕊试纸变蓝,用蘸有浓盐酸的玻璃棒凑近时能生成白烟。
二氧化氮红棕色气体,通入水中生成无色的溶液并产生无色气体,水溶液显酸性。
一氧化氮无色气体,在空气中立刻变为红棕色二氧化碳能使澄清石灰水变污浊;能使燃着的木条熄灭。
SO2气体也能使澄清的石灰水变浑浊,N2等气体也能使燃着的木条熄灭。
一氧化碳可焚烧,火焰呈淡蓝色,焚烧后只生成2CuO由黑色变为红色。
CO;能使灼热的甲烷无色气体,可燃,淡蓝色火焰,生成水和2CO;不可以使高锰酸钾溶液、溴水退色。
乙烯无色气体、可燃,焚烧时有光明的火焰和黑烟,生成水和CO2。
能使高锰酸钾溶液、溴水退色。
乙炔无色无臭气体,可燃,焚烧时有光明的火焰和浓烟,生成水和CO2,能使高锰酸钾溶液、溴水退色。
2.几种重要阳离子的查验( l ) H+能使紫色石蕊试液或橙色的甲基橙试液变为红色。
( 2) Na+、K+用焰色反响来查验时,它们的火焰分别呈黄色、浅紫色(经过钴玻片)。
2+2+3+( 5) Al能与适当的NaOH溶液反响生成白色Al(OH) 3絮状积淀,该积淀能溶于盐酸或过度的 NaOH溶液。
( 6)Ag+能与稀盐酸或可溶性盐酸盐反响,生成白色AgCl积淀,不溶于稀HNO3,但溶于氨水,生成[ Ag(NH3) 2]+。

2、Cl2 :黄绿色刺激性气体有毒;①使润湿淀粉碘化钾试纸变蓝: Cl2+2KI=2KCl+I26 、I2 遇淀粉变蓝;②使润湿蓝色石蕊试纸先变红后变白:Cl2+H2O=HCl+HClONO2 :红棕色气体有刺激性气味、有毒,溶于水、水溶液呈酸性,能使紫色石蕊试液变红: 3NO2+H2O=2HNO3+NO7、NO :无色气体有毒;在空气中立刻变为红棕色:2NO+O2=2NO29、SO2 :无色有刺激性气味、有毒;①通入品红溶液,品红退色加热又恢复颜色;②使澄清石灰水变污浊: SO2+Ca(OH)2=CaSO3+H2O ;③使酸性高锰酸钾溶液褪色: 5SO2+2MnO4 - + 2H2O =2Mn2++5SO42--+4H+10 、HCl :无色刺激性气味;①能使润湿蓝色石蕊试纸变红:HCl=H++Cl -;②用蘸浓氨水玻璃棒凑近冒白烟:NH3+HCl=NH4Cl ;③气体通入HNO3 酸化的AgNO3 溶液,有白色积淀生成:HCl+AgNO3=AgCl↓ +HNO3(AgCl不溶于HNO3)11 、H2S :无色臭鸡蛋气味有毒;遇 (CH3COO)2Pb 、CuSO4 溶液均产生黑色积淀: 2CH3COO -+Pb2 ++H2S=PbS↓+2CH3COOH ; Cu2++H2S=CuS↓+2H+12 、NH3 :无色刺激性气味;①遇润湿红色石蕊试纸变蓝:NH3+H2ONH3· H2ONH4++OH -;②用蘸浓盐酸玻璃棒凑近冒白烟:NH3+HCl==NH4Cl15 、C2H4 :无色稍有气味;②使KMnO4(H+) 溶液退色;③使溴水退色:CH2==CH2+Br2→ CH2Br-CH2Br216 、C2H2 :无色无味;;②使KMnO4(H+) 溶液退色;③使溴水退色: CH≡CH+2Br2→CHBr2-CHBr21、焰色反响: Na+ :黄色; K+:紫色(透过蓝色钴玻璃察看);Ca2+ :砖红色;3、NH4+ :在试液中增强碱( NaOH )加热,产生使润湿红色石蕊试纸变蓝的气体;NH4++OH - NH3↑ +H2O; NH3+H2O NH3· H2O NH4++OH -4、Fe3+ :①通 KSCN 或 NH4SCN 溶液呈血红色:Fe3++SCN - ==[ Fe(SCN)]2+;②通 NaOH 溶液红褐色积淀: Fe3++3OH - ==Fe(OH)3↓5、Fe2+ :①遇 NaOH 溶液生成白色积淀在空气中快速转变为灰绿色最后变为红褐色积淀: Fe3++2OH - =Fe(OH)2↓; 4Fe(OH)2+O2+2H2O==4Fe(OH)3;②试液中加 KSCN 少许无显然变化再加氯水出现血红色;2Fe2++Cl2==2Fe3++2Cl-;Fe3++SCN -==[Fe(SCN)]2+6、Mg2+ :遇 NaOH 溶液有白色积淀生成,NaOH 过度积淀不溶解:Mg2++2OH - ==Mg(OH)2↓,但该积淀能溶于NH4Cl 溶液;7、Al3+:遇NaOH溶液(适当)有白色积淀生成,NaOH 溶液过度积淀溶解:Al3++3OH - ==Al(OH)3 ↓;Al(OH)3+OH -==AlO2 - +2H2O8、Cu2+ :遇 NaOH 溶液有蓝色积淀生成,增强热变黑色积淀:Cu2++2OH - ==Cu(OH)2↓; Cu(OH)2CuO+H2O9、Ba2+ :遇稀 H2SO4 或硫酸盐溶液有白色积淀生成,加稀HNO3 积淀不溶解:Ba2++SO42 -==BaSO4↓10 、Ag+ ;①加 NaOH 溶液生成白色积淀,此积淀快速转变为棕色积淀溶于氨水Ag++OH - ==AgOH↓;2AgOH==Ag2O+H2OAgOH+2NH3· H2O==[ Ag(NO3)2]OH+2H2O②加稀 HCl 或可溶性氧化物溶液再加稀HNO3 生成白色积淀: Ag+ +Cl - ==AgCl↓1、OH -: OH -碱性:①遇紫色石蕊试液变蓝;②遇酚酞试液变红;③遇润湿红色石蕊试纸变蓝;2、Cl -:遇AgNO3溶液有白色积淀生成,加稀HNO3积淀不溶解:Ag++Cl-=AgCl↓3、Br -:加AgNO3 溶液有浅黄色积淀生成,加稀HNO3积淀不溶解:Ag++Br- =AgBr↓4、I-:①加 AgNO3 溶液有黄色积淀生成,加稀 HNO3 积淀不溶解:Ag++I -=AgI ↓;②加少许新制氯水后再加淀粉溶液显蓝色:2I- +Cl2=I2+2Cl -; I2 遇淀粉变蓝5、S2 -:①增强酸(非强氧化性)生成无色臭鸡蛋气味气体:S2- +2H+=H2S↑;②遇 Pb(NO3)2 或(CH3COO)2Pb试液生成黑色积淀,遇CuSO4 试液产生黑色沉淀: Pb2++S2 - =PbS↓; Cu2++S2 -=CuS↓6、SO42 -:加可溶性钡盐 [BaCl2 或 Ba(NO3)2] 溶液有白色积淀生成后再加稀HCl 或稀 HNO3 积淀不溶解:Ba2++SO42 -=BaSO4↓7、SO32 -:增强酸( H2SO4 或 HCl )把产生气体通入品红溶液中,品红溶液褪色: SO32 - +2H+=H2O+SO2↑SO2 使品红溶液退色8、CO32 -:加稀 HCl 产生气体通入澄清石灰水,石灰水变污浊:CO32 -+2H+=H2O+CO2↑;CO2+Ca(OH)2=CaCO3↓ +H2O9、HCO3 -:取含 HCO3 -盐溶液煮沸,放出无色无味、使澄清石灰水变污浊的气体;或向 HCO3 -溶液里加入稀 MgSO4 溶液,无现象,加热煮沸有白色积淀 MgCO3生成,同时放出 CO2 气体。

一、物质的检验利用物质特有的性质,确定物质是否存在的实验方法。
(一)、气体的检验1、氧气:带火星的木条放入瓶中,若木条复燃,则是氧气。
2、氢气:在玻璃尖嘴点燃气体,罩一干冷小烧杯,观察杯壁是否有水滴,往烧杯中倒入澄清的石灰水,若不变浑浊,则是氢气。
3、二氧化碳:通入澄清的石灰水,,若变浑浊则是二氧化碳。
4、氨气:湿润的紫红色石蕊试纸,若试纸变蓝,则是氨气。
5、水蒸气:通过无水硫酸铜,若白色固体变蓝,则含水蒸气。
(二)、离子的检验6、氢离子:滴加紫色石蕊试液/加入锌粒。
7、氢氧根离子:酚酞试液/硫酸铜溶液。
8、碳酸根离子:稀盐酸和澄清的石灰水。
9、氯离子:硝酸银溶液和稀硝酸,若产生白色沉淀,则是氯离子。
10、硫酸根离子:硝酸钡溶液和稀硝酸/先滴加稀盐酸再滴入氯化钡。
11、铵根离子:氢氧化钠溶液并加热,把湿润的红色石蕊试纸放在试管口。
12、铜离子:滴加氢氧化钠溶液,若产生蓝色沉淀则是铜离子。
13、铁离子:滴加氢氧化钠溶液,若产生红褐色沉淀则是铁离子。
二、物质的除杂根据物质和杂质的物理化学性质,采用适当的方法把混合物中杂质分离除去,从而得到纯净的某物质的实验方法。
(一)、物理方法1、过滤法:适用于不溶于液体的固体与液体的分离或提纯。
2、结晶法:适用于可溶性固体与液体的分离和提纯。
具体方法有两种。
①降温结晶法:适用于溶解度受温度变化影响较大的固态物质的分离或提纯。
②蒸发结晶法:适用于溶解度受温度变化影响不大固体物质的分离或提纯。
(二)、化学方法:1、原则:①“不增、不减、易分”:不增即最终不能引入新的杂质;不减是除杂结果不应使所需物质减少;易分是加入试剂后,使杂质转化为沉淀、气体和水等与所需物质易于分离。
②先除杂后干燥。
2、方法:(以下括号里的均为杂质)①吸收法:如一氧化碳混有二氧化碳可用氢氧化钠等碱性溶液吸收;②沉淀法:如氯化钾中混有氯化镁可加氢氧化钾溶液,再过滤;③溶解法:如铜中混有氧化铜可加入过量的盐酸,再过滤;④转化法:如铜中混有锌可加硫酸铜溶液再过滤;⑤气化法:如氯化钠中混有碳酸钠可加入过量盐酸,再蒸发结晶;⑥加热法:如氧化钙中混有碳酸钙可高温灼烧;⑦综合法:当含有多种成分的杂质时,分离提纯往往不仅仅使用一种方法,而是几种方法交替使用。


常见物质的检验和鉴别知识归纳:一、需要记住的常见物质的颜色1、氢氧化铜为蓝色,氢氧化铁为红褐色。
2、凡含Cu2+的溶液呈蓝色。
如:CuSO4溶液、CuCl2溶液、Cu(NO3)2溶液。
3、凡含Fe2+的溶液呈浅绿色。
如:FeSO4溶液、FeCl2溶液;4、凡含Fe3+的溶液呈黄色。
如:FeCl3溶液、Fe2(SO4)3溶液,5、其余溶液一般无色。
(高锰酸钾溶液为紫红色)6、黑色粉末:碳粉、氧化铜、二氧化锰、铁粉7、红色粉末:氧化铁8、红色固体:铜二、记住常见的七种难溶物:氢氧化镁、氢氧化铜、氢氧化铁、氯化银、硫酸钡、碳酸钙、碳酸钡。
既不溶于水、也不溶于酸的白色沉淀是:氯化银、硫酸钡三、常见气体的检验:四、常见离子的检验:典型例题:例题1:现有O2、H2、CO2、CO、N2、CH4等六种气体,如何用实验的方法将它们一一鉴别出来。
例题2:为了验证某气体是由二氧化碳和一氧化碳组成的混合气体,某课外小组同学设计一个实验方案,组装了如右图实验装置。
请你根据该装置图回答下列问题:溶液,作用是。
(1)A中装Ca(OH)2(2)B中装NaOH溶液,作用是。
溶液,作用是。
(3)D中装Ca(OH)2(4)能证明原混合气体中含有二氧化碳的实验现象是(5)能证明原混合气体中含有一氧化碳的实验现象是(5)这套装置中还有一些不足,不足之处是:你的改进措施是(6)写出A、B、C、D处发生的化学反应方程式:A:B:C:D:当堂训练1、小明学习化学后,在家里想用化学方法来鉴别碱面(主要成分是碳酸钠)和食盐,你认为下列方法可行的是()A.观察它们的颜色B.分别倒入水中观察是否溶解C.取少量分别倒入食醋D.分别尝它们的味道2、现有氢气、甲烷、二氧化碳三种气体,如果用最简单的方法将它们鉴别出来,除用一盒火柴外,你至少还需要下列试剂中的()A.浓硫酸B.蒸馏水C.酚酞试液D.澄清的石灰水3、能将氯化钙、盐酸、氢氧化钾三种溶液鉴别出来的试剂是()A. 氯化钠溶液B. 苛性钠溶液C. 硝酸银溶液D. 碳酸钠溶液4、某校实验室在搬迁时,不慎把三瓶无色溶液的标签损坏了,只知道它们分别是盐酸、BaCl2溶液和Na2CO3溶液中的一种。
常见物质的检验方法物质的检验方法是指通过一系列的实验、观察和测试手段来确定物质的性质和成分的方法。
下面将介绍一些常见物质的检验方法。
金属物质的检验方法主要包括外观、重量、硬度、延展性、熔点等几个方面。
1.外观检验:通过肉眼观察金属物质的颜色、形状、表面质量等来鉴别金属。
2.重量检验:使用称量工具,如天平、电子秤等测量金属物质的重量。
3.硬度检验:通常使用刮痕硬度试验或洛氏硬度试验仪来测定物质的硬度。
4.延展性检验:将金属物质放在冶炼设备中加热,观察其变形情况来判断延展性。
5.熔点检验:通过加热金属物质,测定其熔点来判定其成分。
有机物质的检验方法主要包括外观、溶解性、染色反应、化学反应等几个方面。
1.外观检验:通过肉眼观察有机物质的颜色、形状、透明度等外观特征。
2.溶解性检验:将有机物质置于不同溶剂中,观察其溶解性来判定有机物质的特性。
3.染色反应检验:常用荧光试剂、染色剂等与有机物质发生化学反应,观察颜色的变化来鉴定有机物质。
4.化学反应检验:通过与不同试剂的反应观察,如酸碱反应、氧化还原反应等来判断有机物质的性质。
常见溶液的检验方法主要包括外观、pH值、密度、浓度等几个方面。
1.外观检验:通过肉眼观察溶液的颜色、透明度、沉淀等外观特征。
2.pH值检验:使用pH试纸、酸碱指示剂等来测定溶液的酸碱性。
3.密度检验:常用密度计等工具来测量溶液的密度。
4.浓度检验:通过比色、滴定等方法来精确测定溶液中的物质浓度。
常见气体的检验方法主要包括外观、气味、燃烧性质、可燃性等方面。
1.外观检验:通过肉眼观察气体的颜色、透明度等特征。
2.气味检验:通过嗅觉判断气体的特殊气味。
3.燃烧性质检验:通过点燃气体,观察其燃烧性质和颜色。
4.可燃性检验:使用火源或火花接触气体,判断其是否可燃。
常见无机盐的检验方法主要包括外观、溶解性、气体生成、酸碱反应等方面。
1.外观检验:通过肉眼观察无机盐的颜色、颗粒度等外观特征。
2.溶解性检验:将无机盐溶解于水中,观察溶解情况来判断其溶解性。
常有物质的查验新课标要求:认识常有离子的查验方法。
学习必需的化学实验技术,体验和认识化学科学研究的一般过程和方法,认识实验在化学学习和研究中的重要作用。
一、先期剖析 【学习内容剖析】“常有物质的查验〞选自苏教版化学 1 专题一第二单元,是在学习了物质的分离和提纯后自然过渡到对常有物质的查验,而本单元学的正是研究物质的实验方法,可见本节内容的重要性。
先由我们的2-查验,与酸反应生成无色无味能使澄清石灰水污浊的气体和纤维蛋CO 3 白质焚烧有烧焦羽毛味查验引出物质查验。
再侧重详细讲了 4+-42-的各自离子反应 NH、CI 、 SO 判定查验方法以及焰色反应,特别是 K + 、 Na +的颜色。
顺带介绍了几种现代化学剖析法,大多是仪器剖析,一般查验的对象是有机物。
讲堂主假如让学生察看现象,由表及里研究实质,学会解说现象并作出结论,意会实验在化学研究中的重要性。
常有物质的查验是无机推测题中必不可以少的一局部,内容联系密切,极为要点。
【学习者剖析】1. 已经学习过 CO 32- 离子查验,对离子查验法有必定认知2. 生活经验中对根本物质查验法较为熟习,如察看法等3. 已学过了物质的分离和提纯,为物质的判定打下必定实验根基4. 一时间很难正确记着每种离子的判定方法,可能会混杂5. 详细剖析中,对有关扰乱离子的清除短缺完好性6. 对实验详细判定方案操作、现象、结论书写、剖析还是很难写得有条理【教课要点】常有离子〔 +- 2- 2-〕的检出实验方法、会运用不一样的方法〔如: NH 4 、 CI 、 SO 4 、 CO 3 焰色法〕判定物质及清除有关离子扰乱【教课难点】剖析并检出混杂系统中所含离子、设计判定方案研究常有物质的构成二、教课目的【知识与技术】 1. 掌握常有离子+- 2-2-等的查验方法NH、 CI、 SO、 CO4432. 能判断出混杂物中某些特色物质〔如O 2、 I 2 〕的存在3. 会用焰色反应、离子查验法设计简单实验判定方案研究常有物质构成4. 简单说出现代化学的剖析方法〔仪器〕 【过程与方法】1. 学会察看,由外入内剖析现象实质,概括总结2. 初步学习实验详细操作,标准谨慎3. 掌握实验研究的方法,能提出问题,并自主思虑解决 【感情态度与价值观】1. 发现物质的查验在生产生活中的宽泛应用,领会化学的适用性,增添了学习兴趣2. 意会到实验在化学学科中的重要性,提升创新精神和实验能力,培育谨慎的思想和科学研究精神 三、教课准备试管,胶头滴管,酒精灯,火柴、铂丝、蓝色钴玻璃NH4CI 、( NH4) 2SO4、 KCI、 K2SO4、 NaOH、稀 HCI、稀 HNO3、 BaCI2、NaCI四、教课过程设计【导入新课】发问,情境导入1、平时生活中仔细察看的同学都知道家里的暖水瓶用久了就会有薄层水垢,那是怎么办理掉的呢?--用食醋--为何?--主要成分是碳酸钙2、厨房有两瓶失掉标签的醋和白酒,怎么样将它们分辨出来?--闻气味,有酸味的是醋,没有的是白酒--哦,我们能够依据气味来鉴识,那么,假定是白醋和酱油,那还能够如何划分呢?--看颜色,有颜色的是酱油,无色的是醋3.商场有一件衣服,标签不当心破坏了,只知它是纯毛的或是纯棉的,假如叫你们去确立,那能够怎么做?--焚烧,假如有烧焦羽毛味的即是纯毛的; 假如没有,那么是纯棉的--为何有烧焦羽毛味的即是纯毛的呢?--纯毛制品含有蛋白质,蛋白质焚烧有烧焦羽毛味的--看来大家对生活都察看入微哦。