常见弱电解质电离平衡常数表
- 格式:doc
- 大小:95.00 KB
- 文档页数:2

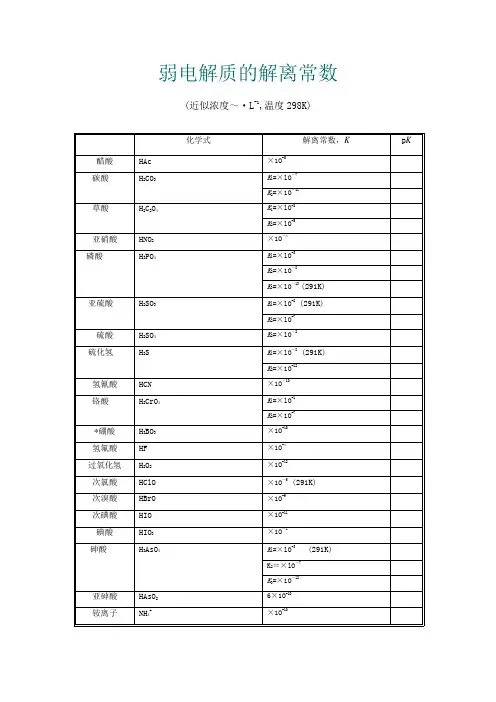
弱电解质的解离常数(近似浓度~·L-1,温度298K)名称化学式解离常数,K p K 醋酸HAc×1O-5碳酸H2CO3K1=×lO-7K2=×1O-11草酸H2C2O4K1=×lO-2K2=×lO-5亚硝酸HNO2×1O-4磷酸H3PO4K1=×lO-3K2=×1O-8K3=×lO-13 (291K)亚硫酸H2SO3 K1=×lO-2 (291K)K2=×lO-7硫酸H2SO4K2=×lO-2硫化氢H2S K1=×lO-8 (291K)K2=×1O-12氢氰酸HCN×1O-1O铬酸H2CrO4K1=×lO-1K2=×1O-7*硼酸H3BO3×1O-1O氢氟酸HF×1O-4过氧化氢H2O2×1O-12次氯酸HClO×1O-5 (291K)次溴酸HBrO×1O-9次碘酸HIO×1O-11碘酸HIO3×1O-1砷酸H3AsO4 K1=×lO-3 (291K)K2=×lO-7K3=×1O-12亚砷酸HAsO26×1O-1O铵离子NH4+×1O-1O氨水NH3·H2O×1O-5联胺N2H4×1O-7羟氨NH2OH×1O-9氢氧化铅Pb(OH)2×1O-4氢氧化锂LiOH×1O-1氢氧化铍Be(OH)2×1O-6BeOH+×1O-9氢氧化铝A1(OH)3×1O-9Al(OH)2+×1O-1O氢氧化锌Zn(OH)2×1O-7氢氧化镉Cd(OH)2×1O-11*乙二胺H2NC2H4NH2K1=×lO-5K2=×lO-8*六亚甲基四胺(CH2)6N4×1O-9 *尿素CO(NH2)2×1O-14*质子化六亚甲基四胺(CH2)6N4H+×1O-6甲酸HCOOH ×1O-4 (293K)氯乙酸ClCH2COOH×1O-3氨基乙酸NH2CH2COOH×1O-1O*邻苯二甲酸C6H4(COOH)2K1=×1O-3K2=×1O-6柠檬酸(HOOCCH2)2C(OH)COOH K1=×1O-4K2=×1O-5 (293K)K3=×1O-7-酒石酸(CH(OH)COOH)2K1=×1O-3K2=×1O-5*8-羟基喹啉C9H6NOH K1=8×lO-6K2=1×1O-9苯酚C6H5OH ×1O-1O (293K)*对氨基苯磺酸H2NC6H4SO3H K l=×lO-lK2=×1O-4*乙二胺四乙酸(EDTA) (CH2COOH)2NH+CH2CH2NH+(CH2COOH)2K5=×1O-7K6=×1O-11。




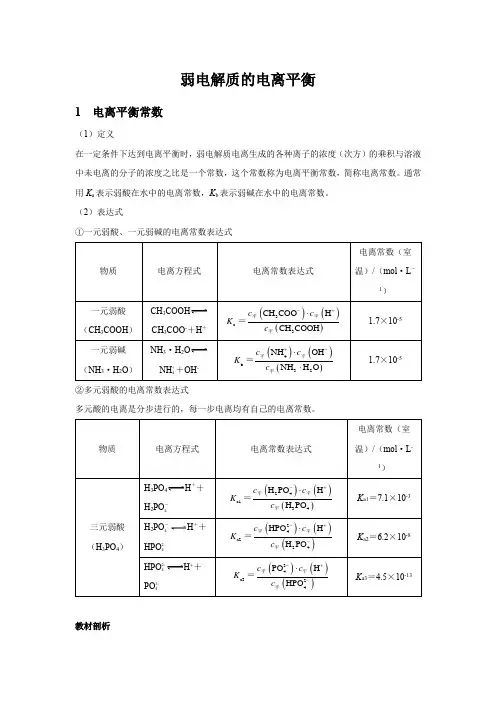
弱电解质的电离平衡1 电离平衡常数(1)定义在一定条件下达到电离平衡时,弱电解质电离生成的各种离子的浓度(次方)的乘积与溶液中未电离的分子的浓度之比是一个常数,这个常数称为电离平衡常数,简称电离常数。
通常用K a表示弱酸在水中的电离常数,K b表示弱碱在水中的电离常数。
(2)表达式①一元弱酸、一元弱碱的电离常数表达式CH3COOHCH3COO-+H+NH3·H2ONH ++OH-4②多元弱酸的电离常数表达式多元酸的电离是分步进行的,每一步电离均有自己的电离常数。
H3PO4H++H2PO-4H2PO-H++4HPO2-4H++HPO2-4PO3-4教材剖析【教材P98】 “多元弱酸的各级电离常数逐级减小。
对于各级电离常数相差很大的多元弱酸,其水溶液中的H +主要是由第一步电离产生的。
”【教材剖析】 多元弱酸第一步电离出H +后,剩余的酸根离子带负电荷,对H +的吸引力增强,使其电离出H +更困难,故一般K a1>>K a2>>K a3……。
因此计算多元弱酸溶液中的c (H+)或比较弱酸酸性的相对强弱时,通常只考虑第一步电离。
(3)意义电离常数表征了弱电解质的电离能力,根据相同温度下电离常数的大小可以判断弱电解质电离能力的相对强弱。
弱酸的电离常数越大,弱酸电离出H +的能力就越强,酸性也就越强;反之,酸性越弱。
如:名师提醒(1)电离常数服从化学平衡常数的一般规律,只受温度的影响。
(2)电离常数相对较大、电离能力较强的弱电解质,其溶液的导电能力不一定强。
这是因为溶液的导电能力与溶液中的离子浓度和离子所带电荷数有关。
(3)相同温度下,等浓度的多种一元弱酸溶液,弱酸的电离常数越大,溶液中c (H +)越大,溶液的导电能力也就越强。
2 电离度(1)定义弱电解质在水中的电离达到平衡状态时,已电离的溶质的分子数占原有溶质分子总数(包括已电离的和未电离的)的百分率称为电离度,通常用α表示。


弱电解质的电离平衡常数电离平衡常数是描述溶液中弱电解质电离程度的重要物理量。
对于弱电解质来说,其电离平衡常数通常用酸解离常数(Ka)或碱离解常数(Kb)来表示。
本文将分别从酸解离常数和碱离解常数两个方面来探讨弱电解质的电离平衡常数。
一、酸解离常数(Ka)酸解离常数(Ka)是描述酸在溶液中电离程度的指标。
对于弱酸HA,其在水溶液中可以发生如下电离反应:HA ⇌ H+ + A-其中HA为未电离的弱酸,H+为产生的氢离子,A-为产生的酸根离子。
酸解离常数(Ka)的定义为:Ka = [H+][A-]/[HA]其中[H+]表示溶液中的氢离子浓度,[A-]表示溶液中的酸根离子浓度,[HA]表示溶液中的弱酸浓度。
酸解离常数越大,说明弱酸的电离程度越高,反之,酸解离常数越小,说明弱酸的电离程度越低。
弱酸的电离程度主要受到以下因素的影响:1. 分子内的键能:键能越强,电离程度越低;2. 分子结构:分子结构中含有共轭体系或芳香环的弱酸,电离程度较高;3. 溶剂的性质:溶剂中的极性越大,电离程度越高;4. 温度:温度升高会增加电离程度。
二、碱离解常数(Kb)碱离解常数(Kb)是描述碱在溶液中电离程度的指标。
对于弱碱B,其在水溶液中可以发生如下电离反应:B + H2O ⇌ BH+ + OH-其中B为未电离的弱碱,BH+为产生的碱根离子,OH-为产生的氢氧根离子。
碱离解常数(Kb)的定义为:Kb = [BH+][OH-]/[B]其中[BH+]表示溶液中的碱根离子浓度,[OH-]表示溶液中的氢氧根离子浓度,[B]表示溶液中的弱碱浓度。
碱离解常数越大,说明弱碱的电离程度越高,反之,碱离解常数越小,说明弱碱的电离程度越低。
弱碱的电离程度主要受到以下因素的影响:1. 分子内的键能:键能越强,电离程度越低;2. 分子结构:分子结构中含有孤对电子或共轭体系的弱碱,电离程度较高;3. 溶剂的性质:溶剂中的极性越大,电离程度越高;4. 温度:温度升高会增加电离程度。

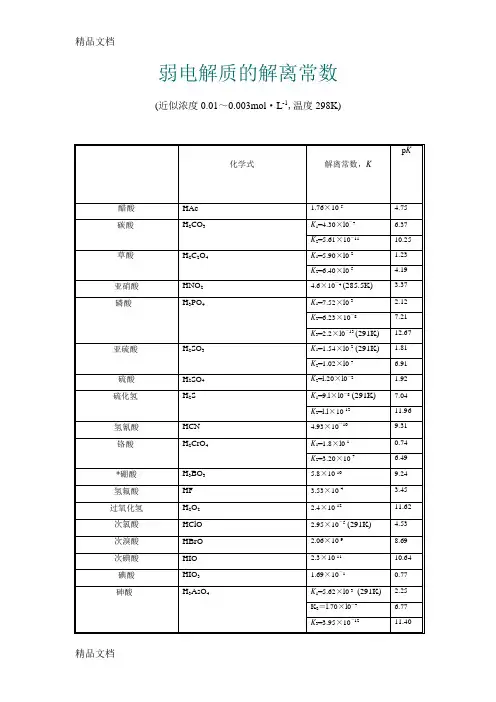
弱电解质的解离常数(近似浓度O.O1~O.OO3mol·L-1,温度298K)化学式解离常数,K p K 醋酸HAc 1.76×1O-5 4.75 碳酸?H2CO3?K1=4.3O×lO-7 6.37K2=5.61×1O-111O.25 草酸?H2C2O4?K1=5.9O×lO-2 1.23K2=6.4O×lO-5 4.19 亚硝酸HNO2? 4.6×1O-4(285.5K) 3.37 磷酸??H3PO4??K1=7.52×lO-3 2.12K2=6.23×1O-87.21K3=2.2×lO-13(291K)12.67 亚硫酸?H2SO3?K1=1.54×lO-2(291K)? 1.81K2=1.O2×lO-7 6.91 硫酸H2SO4K2=l.2O×lO-2 1.92 硫化氢?H2S?K1=9.l×lO-8(291K)?7.O4K2=l.l×1O-1211.96 氢氰酸HCN 4.93×1O-1O9.31 铬酸?H2CrO4?K1=1.8×lO-1O.74K2=3.2O×1O-7 6.49 *硼酸H3BO3 5.8×1O-1O9.24 氢氟酸HF 3.53×1O-4 3.45 过氧化氢H2O2 2.4×1O-1211.62 次氯酸HClO 2.95×1O-5(291K) 4.53 次溴酸HBrO 2.O6×1O-98.69 次碘酸HIO 2.3×1O-111O.64 碘酸HIO3 1.69×1O-1O.77 砷酸?H3AsO4??K1=5.62×lO-3?(291K) 2.25K2=l.7O×lO-7 6.77K3=3.95×1O-1211.4O 亚砷酸HAsO26×1O-1O9.22 铵离子NH4+ 5.56×1O-1O9.25 氨水NH3·H2O 1.79×1O-5 4.75 联胺N2H48.91×1O-7 6.O5 羟氨NH2OH9.12×1O-98.O4 氢氧化铅Pb(OH)29.6×1O-4 3.O2氢氧化锂LiOH 6.31×1O-1O.2 氢氧化铍?Be(OH)2 1.78×1O-6 5.75 BeOH+ 2.51×1O-98.6 氢氧化铝A1(OH)3 5.O1×1O-98.3 Al(OH)2+ 1.99×1O-1O9.7 氢氧化锌Zn(OH)27.94×1O-7 6.1 氢氧化镉Cd(OH)2 5.O1×1O-111O.3 *乙二胺?H2NC2H4NH2?K1=8.5×lO-5 4.O7K2=7.l×lO-87.15 *六亚甲基四胺(CH2)6N4 1.35×1O-98.87*尿素CO(NH2)2 1.3×1O-1413.89 *质子化六亚甲基四胺(CH2)6N4H+7.1×1O-6 5.15甲酸HCOOH? 1.77×1O-4(293K) 3.75 氯乙酸ClCH2COOH 1.4O×1O-3 2.85 氨基乙酸NH2CH2COOH 1.67×1O-1O9.78 *邻苯二甲酸C6H4(COOH)2K1=1.12×1O-3 2.95K2=3.91×1O-6 5.41 柠檬酸??(HOOCCH2)2C(OH)COOH???K1=7.l×1O-4 3.14K2=1.68×1O-5(293K) 4.77K3=4.1×1O-7 6.39 -酒石酸?(CH(OH)COOH)2?K1=1.O4×1O-3 2.98K2=4.55×1O-5 4.34 *8-羟基喹啉?C9H6NOH?K1=8×lO-6 5.1K2=1×1O-99.O 苯酚C6H5OH? 1.28×1O-1O(293K)9.89*对氨基苯磺酸?H2NC6H4SO3H?Kl=2.6×lO-l O.58K2=7.6×1O-4 3.12*乙二胺四乙酸(EDTA)?(CH2COOH)2NH+CH2CH2NH+(CH2COOH)2?K5=5.4×1O-7 6.27K6=l.12×1O-111O.95。
电离平衡常数1.表达式(1)一元弱酸HA 的电离常数:根据HA H ++A -,可表示为K a =c (A -)·c (H +)c (HA )。
(2)一元弱碱BOH 的电离常数:根据BOH B ++OH -,可表示为K b =c (B +)·c (OH -)c (BOH )。
2.特点(1)电离平衡常数与温度有关,与浓度无关,升高温度,K 值增大。
(2)电离平衡常数反映弱电解质的相对强弱,K 越大,表示弱电解质越易电离,酸性或碱性越强。
(3)多元弱酸的各级电离常数的大小关系是K 1≫K 2≫K 3……,故其酸性取决于第一步电离。
3.电离平衡常数的应用(1)判断弱酸(或弱碱)的相对强弱,电离常数越大,酸性(或碱性)越强。
例1 相同温度下,根据三种酸的电离常数,酸 HX HY HZ 电离平衡常数9×10-79×10-61×10-2则三种酸的强弱关系:HZ>HY>HX 。
(2)定量判断电离平衡移动的方向、解释移动的原因。
例2 0.1 mol·L -1的CH 3COOH 溶液加水稀释,平衡移动方向的判断,溶液中c (H +)的变化情况。
答案CH 3COOHH ++CH 3COO -原平衡: c (CH 3COOH) c (H +) c (CH 3COO -) 假设稀释 c (CH 3COOH )n c (H +)n c (CH 3COO -)n至n 倍后:Q =c (H +)n ·c (CH 3COO -)n c (CH 3COOH )n =c (H +)·c (CH 3COO -)n ·c (CH 3COOH )=K an <K a (n >1)所以电离平衡向电离方向移动。
移动的结果使c (CH 3COOH)减小,由于平衡常数不变,故c (H +)和c (CH 3COO -)都必然减小。
弱电解质的解离常数(近似浓度O.O1~O.OO3mol·L-1,温度298K)化学式解离常数,K p K 醋酸HAc 1.76×1O-5 4.75 碳酸H2CO3K1=4.3O×lO-7 6.37K2=5.61×1O-111O.25 草酸H2C2O4K1=5.9O×lO-2 1.23K2=6.4O×lO-5 4.19 亚硝酸HNO2 4.6×1O-4 (285.5K) 3.37 磷酸H3PO4K1=7.52×lO-3 2.12K2=6.23×1O-87.21K3=2.2×lO-13 (291K) 12.67 亚硫酸H2SO3 K1=1.54×lO-2 (291K) 1.81K2=1.O2×lO-7 6.91 硫酸H2SO4K2=l.2O×lO-2 1.92 硫化氢H2S K1=9.l×lO-8 (291K) 7.O4K2=l.l×1O-1211.96 氢氰酸HCN 4.93×1O-1O9.31 铬酸H2CrO4K1=1.8×lO-1O.74K2=3.2O×1O-7 6.49 *硼酸H3BO3 5.8×1O-1O9.24 氢氟酸HF 3.53×1O-4 3.45 过氧化氢H2O2 2.4×1O-1211.62 次氯酸HClO 2.95×1O-5 (291K) 4.53 次溴酸HBrO 2.O6×1O-98.69 次碘酸HIO 2.3×1O-111O.64 碘酸HIO3 1.69×1O-1O.77 砷酸H3AsO4 K1=5.62×lO-3 (291K) 2.25K2=l.7O×lO-7 6.77K3=3.95×1O-1211.4O 亚砷酸HAsO26×1O-1O9.22 铵离子NH4+ 5.56×1O-1O9.25 氨水NH3·H2O 1.79×1O-5 4.75 联胺N2H48.91×1O-7 6.O5 羟氨NH2OH9.12×1O-98.O4 氢氧化铅Pb(OH)29.6×1O-4 3.O2氢氧化锂LiOH 6.31×1O-1O.2 氢氧化铍Be(OH)2 1.78×1O-6 5.75 BeOH+ 2.51×1O-98.6 氢氧化铝A1(OH)3 5.O1×1O-98.3 Al(OH)2+ 1.99×1O-1O9.7 氢氧化锌Zn(OH)27.94×1O-7 6.1 氢氧化镉Cd(OH)2 5.O1×1O-111O.3 *乙二胺H2NC2H4NH2K1=8.5×lO-5 4.O7K2=7.l×lO-87.15 *六亚甲基四胺(CH2)6N4 1.35×1O-98.87*尿素CO(NH2)2 1.3×1O-1413.89 *质子化六亚甲基四胺(CH2)6N4H+7.1×1O-6 5.15甲酸HCOOH 1.77×1O-4 (293K) 3.75 氯乙酸ClCH2COOH 1.4O×1O-3 2.85 氨基乙酸NH2CH2COOH 1.67×1O-1O9.78 *邻苯二甲酸C6H4(COOH)2K1=1.12×1O-3 2.95K2=3.91×1O-6 5.41 柠檬酸(HOOCCH2)2C(OH)COOH K1=7.l×1O-4 3.14K2=1.68×1O-5 (293K) 4.77K3=4.1×1O-7 6.39 -酒石酸(CH(OH)COOH)2K1=1.O4×1O-3 2.98K2=4.55×1O-5 4.34*8-羟基喹啉C9H6NOH K1=8×lO-6 5.1K2=1×1O-99.O苯酚C6H5OH 1.28×1O-1O (293K)9.89*对氨基苯磺酸H2NC6H4SO3H Kl=2.6×lO-l O.58K2=7.6×1O-4 3.12*乙二胺四乙酸(EDTA) (CH2COOH)2NH+CH2CH2NH+(CH2COOH)2K5=5.4×1O-7 6.27K6=l.12×1O-111O.95。
弱电解质的解离常数
(近似浓度O.O1~O.OO3mol·L-1,温度298K)
化学式解离常数,K p K 醋酸HAc 1.76×1O-5 4.75 碳酸?H2CO3?K1=4.3O×lO-7 6.37
K2=5.61×1O-111O.25 草酸?H2C2O4?K1=5.9O×lO-2 1.23
K2=6.4O×lO-5 4.19 亚硝酸HNO2? 4.6×1O-4 (285.5K) 3.37 磷酸??H3PO4??K1=7.52×lO-3 2.12
K2=6.23×1O-87.21
K3=2.2×lO-13 (291K) 12.67 亚硫酸?H2SO3 ?K1=1.54×lO-2 (291K)? 1.81
K2=1.O2×lO-7 6.91 硫酸H2SO4K2=l.2O×lO-2 1.92 硫化氢?H2S ?K1=9.l×lO-8 (291K)?7.O4
K2=l.l×1O-1211.96 氢氰酸HCN 4.93×1O-1O9.31 铬酸?H2CrO4?K1=1.8×lO-1O.74
K2=3.2O×1O-7 6.49 *硼酸H3BO3 5.8×1O-1O9.24 氢氟酸HF 3.53×1O-4 3.45 过氧化氢H2O2 2.4×1O-1211.62 次氯酸HClO 2.95×1O-5 (291K) 4.53 次溴酸HBrO 2.O6×1O-98.69 次碘酸HIO 2.3×1O-111O.64 碘酸HIO3 1.69×1O-1O.77 砷酸 ?H3AsO4 ??K1=5.62×lO-3? (291K) 2.25
K2=l.7O×lO-7 6.77
K3=3.95×1O-1211.4O 亚砷酸HAsO26×1O-1O9.22 铵离子NH4+ 5.56×1O-1O9.25 氨水NH3·H2O 1.79×1O-5 4.75 联胺N2H48.91×1O-7 6.O5
羟氨NH2OH9.12×1O-98.O4 氢氧化铅Pb(OH)29.6×1O-4 3.O2 氢氧化锂LiOH 6.31×1O-1O.2 氢氧化铍?Be(OH)2 1.78×1O-6 5.75 BeOH+ 2.51×1O-98.6 氢氧化铝A1(OH)3 5.O1×1O-98.3 Al(OH)2+ 1.99×1O-1O9.7 氢氧化锌Zn(OH)27.94×1O-7 6.1 氢氧化镉Cd(OH)2 5.O1×1O-111O.3 *乙二胺?H2NC2H4NH2?K1=8.5×lO-5 4.O7
K2=7.l×lO-87.15 *六亚甲基四
胺
(CH2)6N4 1.35×1O-98.87
*尿素CO(NH2)2 1.3×1O-1413.89 *质子化六亚
甲基四胺
(CH2)6N4H+7.1×1O-6 5.15
甲酸HCOOH ? 1.77×1O-4 (293K) 3.75 氯乙酸ClCH2COOH 1.4O×1O-3 2.85 氨基乙酸NH2CH2COOH 1.67×1O-1O9.78 *邻苯二甲酸C6H4(COOH)2K1=1.12×1O-3 2.95
K2=3.91×1O-6 5.41 柠檬酸??(HOOCCH2)2C(OH)COOH? ??K1=7.l×1O-4 3.14
K2=1.68×1O-5 (293K) 4.77
K3=4.1×1O-7 6.39 -酒石酸?(CH(OH)COOH)2?K1=1.O4×1O-3 2.98
K2=4.55×1O-5 4.34 *8-羟基喹啉?C9H6NOH?K1=8×lO-6 5.1
K2=1×1O-99.O 苯酚C6H5OH ? 1.28×1O-1O (293K)9.89
*对氨基苯磺
酸?H2NC6H4SO3H?K l=2.6×lO-l O.58
K2=7.6×1O-4 3.12
*乙二胺四乙酸(EDTA)? (CH2COOH)2NH+CH2CH2NH+(CH2
COOH)2?
K5=5.4×1O-7 6.27
K6=l.12×1O-111O.95。