PCR仪操作指南
- 格式:docx
- 大小:15.74 KB
- 文档页数:2
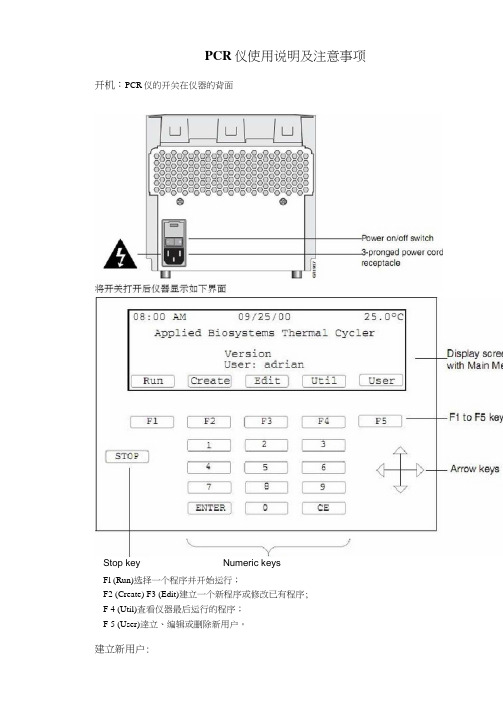
PCR仪使用说明及注意事项开机:PCR仪的开关在仪器的背面Stop key Numeric keysFl (Run)选择一个程序并开始运行;F2 (Create) F3 (Edit)建立一个新程序或修改已有程序;F 4 (Util)査看仪器最后运行的程序;F 5 (User)逹立、编辑或删除新用户。
建立新用户:Applied Biosystems Thermal CyclerVersion user: adrian [亡二呂己匸目 | Bdit ][ dl ][ Cw"]选择F 2User L-tairie : name PlK number : Z^oneProtection: UnlockedPress PIN # to create a #・ Then you set protection to Locked to prei^YLt methods from being over>nri11en or deleted ・甌c 證封[已]「P 工萤# ]怛諒g 至iFlF2F3F4F5命名完成后选择Fl ,用户若建立完成。
程序设■: 1、新逹程序08:00 AM09/25/00 25・0。
(?Applied Biosystems Thermal Cyclerversion User: adrian[ Run [dred 二耳 | Ed 让]「「User ] FlF2F3F4F5选择用户名后,选择F 2adrlan annaSelect User 23ame cave doug faye3em f eiramooc. mike irrjrray nayanangui [Accept [ :\ewJ t 吐t[Delet e] (Cancelj FL F2F3F4 F5FL IF3F508 : 2 u AM Main Menu09/25/00~ 25.0°C选择F 5F2F3 F4 F5用户名可以用宁母.数字或它们的组台命名,通过方向键选择字母、通过数宇键选择数宇。

pCR仪操作流程PCR(聚合酶链反应)仪是一种广泛应用于分子生物学实验室的设备,用于扩增和复制DNA序列。
正确的操作流程对于获得准确的实验结果至关重要。
本文将介绍pCR仪的基本操作流程,以确保您能够正确操作和利用该设备。
1. 准备实验材料和试剂在进行pCR实验之前,确保准备齐全所需的实验材料和试剂。
这些包括DNA模板、引物、dNTPs(脱氧核苷酸三磷酸盐)、聚合酶、反应缓冲液、电泳试剂等。
确保所使用的试剂和材料都在保质期内,并按照实验要求进行储存。
2. 设定PCR参数根据实验需要,设置PCR参数,包括温度和时间控制。
一般来说,PCR反应需要进行一系列的循环,每个循环包括三个主要的步骤:变性、退火和延伸。
根据模板DNA的GC含量和引物的特异性,可以确定合适的变性温度和时间,引物的退火温度和延伸温度。
确保参数的设定符合实验要求。
3. 加入试剂和混合根据PCR反应的体积要求,将所需试剂和混合物精确配制。
通常情况下,将DNA模板、引物、dNTPs、聚合酶和反应缓冲液组合在一起,并轻轻混合。
通过离心操作,使反应混合物沉淀在管底,减少液面上的气泡。
4. 加热反应混合物将反应混合物置于已预热的PCR仪中。
确保反应管的盖子紧闭,以防止外界的污染和蒸发。
根据设定的PCR参数,在仪器中进行加热和循环操作。
确保温度的变化符合实验要求,以保证DNA的扩增和复制过程能够进行顺利。
5. 检测PCR产物PCR反应完成后,取出反应管,并将反应产物进行检测。
最常用的方法是利用琼脂糖凝胶电泳,将PCR产物在电泳仪中进行分离。
通过比较PCR产物与分子量标准品之间的迁移距离,可以确定扩增的目标DNA片段的大小。
6. 结果分析和记录根据电泳结果,分析PCR反应的结果。
正常情况下,目标DNA片段应该有明确的条带出现。
记录结果,并进行数据分析和解读。
如果实验结果不符合预期,可能需要重新优化PCR反应的条件或调整试剂的浓度。
总结:pCR仪操作流程涉及到实验前的准备、PCR参数的设定、试剂的加入和混合、反应体系的加热、PCR产物的检测、结果分析和记录等步骤。

pcr仪操作规程PCR仪操作规程一、实验前准备1. 确保PCR仪及其相关设备工作正常,温度控制准确。
2. 检查所需试剂和试验用品是否齐全,并确保其完好无损。
3. 充分准备好所需样品和试剂。
二、实验操作步骤1. 打开PCR仪电源,将仪器温度设置为所需温度。
2. 准备PCR试管,根据实验需要选择合适的试管尺寸和材质。
3. 将待测样品转移到试管中,确保样品转移时避免污染。
4. 加入适量的引物、模板DNA和酶,确保试管中各组分加入正确。
5. 轻轻混匀试管中的液体,尽量避免产生气泡。
6. 紧贴试管盖,将试管放入PCR仪保护套中,确保密封。
7. 将试管架放入PCR仪中,确保试管数量合适,不要过多或过少。
8. 关上PCR仪盖,开始PCR扩增反应。
三、PCR程序设置1. 打开PCR仪操作面板,选择“PCR”模式。
2. 设定所需的扩增程序参数,包括温度和时间等。
3. 设置好反应程序后,按下“开始”按钮,启动PCR 反应。
四、PCR扩增反应1. PCR反应过程中要保持实验环境的干净和整洁,避免污染。
2. 定时观察PCR反应状态,确保仪器温度控制准确。
3. 扩增反应完成后,关闭PCR仪电源,停止反应。
五、PCR反应后处理1. 打开PCR仪盖,将试管从仪器中取出。
2. 迅速将试管放入冰浴中,以停止反应。
3. 根据实验需要,可进行进一步的处理,如电泳分析或提取目标产物等。
六、实验结束后1. 清洗PCR试管,避免残留物的污染。
2. 关闭PCR仪电源,确保仪器处于安全状态。
3. 整理实验台面,注意清理实验区域,保持实验环境的清洁。
七、实验数据记录与分析1. 记录实验过程中的相关数据,如PCR仪设置温度、反应时间等。
2. 对实验结果进行分析和解读,根据需要进行数据处理和统计。
八、实验安全注意事项1. 在实验过程中要注意个人防护,佩戴实验手套、实验服等。
2. 注意对PCR试管的正确处理和处置,避免造成污染和危险。
3. 遵守实验室规范,注意实验场所的卫生和安全。

PCR仪
操作指南
一、开机
连接电源线后,打开机器后部的主开关(在机器的左下角)。
开机后机器进行自检“Self Test”,自检结束后出现用户主界面,显示加热模块“Block”格式和温度“Temp”和热盖温度“Lid”,在屏幕左上角显示“Ready”。
二、程序设置
1.建立新程序
按“File”→“New”→“Program”,进入一个编辑窗口输入程序名称按“Enter”键确认,之后进入程序编辑器;在“Header”中设置热盖的参数,输入温度和压力,温度默认值为96℃,一般设置为99℃,如变性温度较低时默认值也可以满足使用要求,压力默认值为90N。
按“Step”设置PCR循环在“Temp”中输入温度后按“Enter”,“Time”中输入时间按“Enter”,依次编辑步骤。
输入“Goto”要返回的步骤序号,形成PCR 循环,输入循环数。
2.编辑模板程序
按“File”→“Edit”→“Program”,进入编辑窗口后按“Edit”键开始修改程序,修改完毕后按“Save”键保存后关闭该窗口返回主界面。
三、运行程序
程序设置好后,按“Run”+“Start”,打开一个子窗口选择要运行的程序(最后一次修改的程序将自动被选中),确认选择的程序后按“Start Now”开始运行程序。
四、暂停与终止
如果要暂停或终止正在运行的程序,按“Run”+“Pause”或“Run”+“Stop now”,暂停后要继续原来的程序按“Run”+“Continue”。
五、关机
程序运行结束后,界面返回至主菜单。
关闭仪器后部的主开关。

简化PCR仪使用方法说明书PCR仪使用方法说明书一、简介PCR(聚合酶链式反应)仪是一种用于扩增DNA片段的仪器。
本说明书将详细介绍PCR仪的使用方法,旨在帮助用户快速上手操作并获得稳定可靠的实验结果。
二、仪器准备1. 环境准备确保实验室温度稳定在22-25℃,相对湿度保持在40%-60%。
2. 仪器检查* 检查PCR仪电源是否连接并插入适当的插座。
* 检查仪器的温度控制装置,确保其工作正常。
* 检查反应管孔,确保无污染或损坏。
3. 试剂准备根据实验需要,准备好PCR反应液的各种试剂,如DNA模板、引物、酶、缓冲液等。
三、操作步骤1. 反应管装载* 准备一张PCR反应管载荷表,记录每个反应管中的试剂和样品。
* 将所需试剂按照实验设计加入PCR反应管中。
* 使用适当的标签标记每个反应管以便于识别。
2. 反应管密封* 安装好PCR反应管盖或透明密封膜,确保完全封闭,避免样品蒸发或污染。
3. 程序设置* 打开PCR仪软件,并连接仪器。
* 根据实验要求,在软件界面中设置反应温度、时间等参数。
4. 仪器运行* 在PCR仪软件中选择所需的PCR程序。
* 确保仪器盖板完全关闭,并启动PCR仪程序。
5. 实验结果分析* 实验结束后,从PCR仪中取出反应管。
* 根据实验目的,可以使用凝胶电泳或其他方法对反应产物进行分析。
四、注意事项1. 实验操作* 操作前请先彻底洗手,并佩戴实验手套,避免样品污染。
* 操作过程中,注意避光并尽量减少反应管开盖的次数。
2. 仪器安全* 在操作过程中,避免触摸仪器的加热块,以免烫伤。
* 使用完毕后,及时关闭PCR仪电源,并拔掉电源插线。
3. 废弃物处理* 废弃物(如实验管、试剂、手套等)请按照实验室规定的生物废弃物处理要求进行处理。
五、故障排除1. 仪器无法启动* 检查电源连接是否正常。
* 确保插座电源正常,尝试使用其他插座。
* 如果仍无法解决问题,请联系仪器维修人员。
2. 温度控制异常* 检查仪器温度传感器是否正常。

PCR仪操作规程一、PCR仪的准备工作1.将PCR仪放置在坚固平稳的工作台上。
2.确保PCR仪能够正常通电,并连接稳定的电源。
3.检查PCR仪是否有足够的耗材,如:PCR试剂盒、PCR板、PCR管等。
4.确保PCR仪的外壳干净整洁,无尘。
5.检查PCR仪的温控系统是否正常运作,温度探头是否正确连接。
二、程序设置1.打开PCR仪的电源,等待仪器启动。
2.进入PCR仪的操作界面,在设置中选择需要运行的PCR程序。
3.设置PCR程序的相关参数,包括:反应体系、产物大小、温控方式、梯度设置等。
4.确认无误后,保存设置。
三、样本处理1.根据实验需求,准备所需的样本和试剂。
2.将待测样本和控制样本分别加入PCR管中,并按照试剂盒说明书的要求,分别加入PCR试剂。
3.小心混匀,避免产生气泡。
4.使用电动移液器,将样品转移到PCR板的相应孔中。
5.确保试管盖扣紧并密封,避免蒸发和污染。
四、样品放置1.使用PCR板架,将PCR板放入PCR仪中。
2.确保PCR板放置稳定,不晃动。
3.在关闭仪器时,检查所有的孔位是否已经满。
4.根据实验要求选择合适的PCR模式。
五、运行PCR程序1.确保PCR仪处于关机状态,将PCR板放入PCR仪中。
2.关闭PCR仪的盖子,并轻轻按下,确保盖子紧密贴合。
3.打开PCR仪的电源,启动PCR程序。
4.开始运行程序后,定期检查PCR仪的运行状态,确保温度的稳定和反应的正常进行。
5.在PCR反应过程中不要移动或震动PCR仪。
6.必要时对PCR反应进行监测,可使用实时荧光PCR功能。
六、PCR反应后处理1.PCR反应结束后,停止PCR程序运行。
2.打开PCR仪盖子,取出PCR板。
3.将PCR板置于洗涤台上,进行样本的后续处理。
4.根据实验要求,可以选择对PCR产物进行凝胶电泳分析或进一步测序。
七、清洁和维护1.每次使用后,将PCR仪的工作台面、盖子等部位用75%乙醇擦拭干净。
2.定期清洁PCR仪的内部,检查温控系统的工作情况。
PCR仪操作指南
引言:
PCR(聚合酶链反应)是一种常用的分子生物学技术,用于检测和扩
增特定DNA序列。
PCR仪是进行PCR实验的必备设备之一,本操作指南将
详细介绍PCR仪的使用流程和操作注意事项,旨在帮助使用者正确操作PCR仪,提高实验的成功率。
一、实验前的准备工作:
1.根据实验需要,选择合适的引物,设计PCR反应体系。
2.准备好PCR反应物,包括DNA模板、引物、核酸酶、脱氧核苷酸三
磷酸、聚合酶等。
3.根据PCR仪的使用手册,检查设备的工作状态,保证设备正常运行。
4.准备PCR反应管,确保干净无污染。
二、操作步骤:
1.打开PCR仪电源,启动设备。
根据使用手册,设置合适的温度和时
间参数,并选择合适的热启动模式(立即开始或延迟开始)。
2. 调整PCR仪的温度设置。
根据PCR实验需要,设置热循环的温度
范围和时间参数,包括Denaturation(变性)、Annealing(退火)和Extension(延伸)步骤的温度和时间。
3. 预热PCR仪至所需的初始温度。
根据实验需要,将PCR仪的温度
调整至Denaturation步骤所需的温度(通常为95℃)。
4.添加PCR反应物至PCR反应管中。
按照预先设计的PCR反应体系,
将DNA模板、引物、核酸酶、脱氧核苷酸三磷酸、聚合酶等加入PCR反应
管中。
5.将PCR反应管放置在PCR仪的样品架中。
确保PCR反应管放置稳定,避免管内反应物溢出。
6.关闭PCR仪的上盖。
PCR仪操作规程精编版1.前言PCR(聚合酶链反应)是一种广泛应用于生物学实验室中的技术,用于扩增特定DNA片段。
PCR仪是进行PCR实验的必备设备之一,正确、规范的操作PCR仪对于保证实验结果的准确性和可靠性至关重要。
本操作规程详细介绍了PCR仪的使用步骤和注意事项,希望能为用户提供参考和指导。
2.仪器及试剂准备2.1确保PCR仪处于正常工作状态,检查电源和仪器连接是否良好。
2.2准备PCR反应管或PCR板,并按实验需求正确标记和编号。
2.3 准备PCR反应体系所需核酸模板、引物、Taq DNA酶、dNTP混合液等试剂。
3.PCR仪操作步骤3.1打开PCR仪电源开关,待其启动完毕后,按照实验需求选择相应的程序和参数。
3.2将PCR反应管或PCR板放置于PCR仪样品位中,并确保盖盖紧密。
3.3关闭PCR仪仪器上的开盖传感器,避免开盖造成反应体系受污染。
3.4根据实验要求和PCR仪说明书中的温度曲线设置合适的温度程序(包括预PCR、PCR和最终PCR过程)和时间参数,并启动PCR仪。
3.5当PCR反应结束后,关闭PCR仪电源开关,将PCR反应管或PCR板取出。
4.PCR仪使用注意事项4.1仪器和试剂准备前应先查看仪器和试剂的保存状态是否良好,过期的试剂和损坏的仪器应及时更换。
4.2操作PCR仪时需佩戴手套,避免手部接触实验物品,以防止交叉污染。
4.3操作过程中应注意防止可能导致PCR反应管或PCR板破碎或溢出的因素,如震动、碰撞等。
4.4操作完PCR仪后,须及时清理PCR仪内部和外部的杂物和污染物,并保持仪器干燥。
4.5为了保证PCR反应体系的准确性和可靠性,每个批次实验前应进行空白对照实验。
4.6操作PCR仪时应遵循实验室的安全操作规程,禁止一人独自在实验室进行操作,必要时应有他人在场协助。
5.仪器维护与故障排除5.1每次使用PCR仪后,应及时清理PCR仪外部的灰尘和污染物,并检查电源和仪器连接是否良好。
S1000 PCR仪快速操作指南一.运行程序1.接通仪器电源,打开仪器开关,仪器自检后,显示主菜单。
2.在PCR管中加入样品,把管子放入仪器中,关上盖子,准备开始实验。
3.检查主菜单中状态是否为Block is idle,选择RUN。
然后选择需要运行的程序,点击ENTER确定选择并继续。
注意:当仪器安装了双48反应模块时,有当两个模块均为闲置状态时,状态信息才显示Blocks are idle。
4.^5.选择运行的程序:点击箭头键选择一个文件夹,然后点击向右箭头键选择此文件夹中的文件。
选择MAIN文件夹可选择预设程序。
点击ENTER确定并继续。
注意:运行中的程序是不能进行编辑的。
程序中的改动将在下一次此程序运行时被应用。
6.选择运行模块(双48模块形式)点击箭头键选择BLOCK A或BLOCK B。
点击ENTER继续。
6.输入样品体积输入1-50微升(使用Calculated mode)或输入0微升(使用Block mode)。
7.选择VIEW键预览运行的程序(可选择操作)点击向右箭头键选择VIEW,点击ENTER确定进行程序预览。
点击ENTER向下翻页来预览程序,在程序最后一步再次点击ENTER返回。
8.选择RUN开始运行。
选择RUN,点击ENTER开始运行。
9.程序运行时的监测(可选操作)&程序运行开始后,点击SCREEN键可在下面三个屏幕之间切换。
A.运行屏幕:程序开始运行后,在屏幕的最下面一行将显示运行状态。
点击Screen键可显示Running屏幕。
B.图形屏幕:此屏幕可显示每一步的目标温度。
C.Time Remaining屏幕:此屏幕显示到程序结束的剩余时间。
10.浏览Protocol complete屏幕程序结束后,将显示Protocol complete屏幕。
浏览此屏幕后,点击ENTER返回主菜单。
10.浏览LAST RUN屏幕(可选操作)返回主菜单后点击SCREEN键可浏览LAST RUN。
PCR仪操作指南
步骤:
1、开机:打开开关,视窗上显示“SELF TEST”,显示10秒中后,显示RUN-ENTER菜单:
准备执行程序。
2、放入样本管,关紧盖子。
3、一、如果要运行已经编好的程序,则直接按《Proceed》,用箭头键选择已储存的程序,按《Proceed》,则屏幕显示:
按《Proceed》选择ENABLE,则开始执行程序。
二、如果要输入新的程序,则在RUN-ENTER菜单上用箭头键选择ENTER PROGRAM,按《Proceed》,屏幕显示
按《Proceed》,1)选择NEW,命名新的程序,最多8个字母,输入后按《Proceed》确认(如何输入字母、数字)。
2)输入程序步骤:名字输入后,显示
按《Proceed》则可以输入温度(0~100℃),按《Proceed》确认后,则可以输入孵育时间,用《Select》键移动光标,输入数字,完成后按《Proceed》确认,跳到下一步,输入方式同上。
3)选择GOTO,输入循环步骤时链接到第几步(循环数最多可达9999次)(为实际循环数-1)。
4) 选择option,显示
再选择increment,按《Proceed》确认,输入初始的温度,确认后输入时间,按《Proceed》确认,然后输入每个循环增加或减少的温度,增加用正值,减少用负值(-0.1℃~6℃),按《Proceed》确认。
选择extend, 按《Proceed》确认,输入每个循环增加或减少的时间(-60~60秒),按《Proceed》确认。
选择slop(指温度上升或下降的速率),输入温度的改变值(-0.1~1.5℃)按《Proceed》确认,然后输入加热或致冷的速度,按《Proceed》确认。
4)选择End,输入结束步骤。
5、输入完成的程序后,到RUN-ENTER菜单,选择新程序,开始运行。
6、其它:用《pause》可以暂停一个运行的程序,再按一次继续程序。
用《stop》或《Cancel》可停止运行的程序。
编辑程序:
1、可以用《Cancel》键删除输错的值,输入新的值后按《Proceed》确认。
2、对于未输完的程序,要先输入END,按《Proceed》将程序储存后才能删除。
3、删除已经储存的程序:从RUN-ENTER菜单中选择RUN-PROGRAM,按《Proceed》,显示主菜单,选择DELET,用《Select》选择删除。
4、查看程序的步骤:在主菜单上选择LIST,按《Proceed》,用《Select》将选择名称,再按《Proceed》,显示程序的第一步,用《Select》键向前、向后翻页查看,此时不能改变程序的值。
编辑已有的程序:
1、从RUN-ENTER菜单中选择RUN-PROGRAM,按《Proceed》,显示主菜单,选择EDIT,按《Proceed》确认,用《Select》键选择要编辑的程序,按《Proceed》显示程序的第一步。
2、用《Select》键将光标移到要改变的温度或循环的值上,键入新值,按《Proceed》确认,按《Cancel》
删除键入的值,出现空格,键入新值后确认。
注:一旦值被改变或删除,原来的值不能恢复,必须重新键入。
3、编辑时间值:必须重新键入小时、分钟、秒,按《Proceed》。
如何设置一个PCR体系:
一般分为8步:
1、预变性:可用94~95℃,2~10min,一般用5min。
2、变性:一般用94℃,30s~2min,一般45s~1min。
3、退火:温度自定,30s~2min。
4、延伸:70~75℃,一般72℃,对于〈2kb,<1min;>2kb,每增加1kb加1min。
5、循环数:一般25~35个循环。
6、最终延伸:72℃,5~15min。
7、保存:10℃,时间设为0。
8、END
半定量RT-PCR电泳图如何分析
半定量RT-PCR参照的做法一般有两种:
1) 将要比较的两个样品的BETA-ACTIN 调成一样的亮度,然后就可以直接比较目的基因的亮度了。
方法的结果比较直观,但较费事。
2) 不进行调平,一个样品里将目的基因和BETA-ACTIN直接比较,用软件就可以做到,然后将不同样品的这个比值进行比较就可以了。
方法比较简单,但结果不够直观。
1.每个标本都要做自己的内参,不能用同一个内参!
2.每个标本在实际做前都要摸最佳循环数,包括内参,但内参的循环数不一定要和目的基因一样,都要选择上升期的中间数作为最佳循环数,否则进入平台期就没有可比性了!所以内参要有它自己的最佳循环数!
3.电泳扫描后,计算灰度值,先用同一标本的内参和目的进行比较,然后用这个相对值再去和其他你所要比较的平行组进行比较,一般每组4个样本以上。
这样就可以知道各组之间的差别了!。