2015年高中化学西城一模
- 格式:doc
- 大小:2.14 MB
- 文档页数:8

2014-2015学年北京市西城区高中示范校高一(下)调研化学试卷(5)一、选择题(每小题只有一个正确答案)3.(3分)(2015春•西城区月考)图中横坐标均表示11~17号元素顺序排列的原子序数.根B4.(3分)(2010春•思明区校级期中)0.05mol某金属单质与足量的盐酸反应,放出1.12LH 2(标准状况),并转变为具有Ar 原子的电子层结构的离子,该金属元素在元素周期表中的7.(3分)(2009春•西城区校级期末)短周期元素X 、Y 、Z 的原子序数依次递增,其原子的最外层电子数之和为14.X 与Y 、Z 位于相邻周期,Z 原子最外层电子数是X 原子内层38.(3分)(2015春•西城区月考)元素X、Y、Z均为短周期元素且原子序数之和为35,X、+2﹣>9.(3分)(2015春•西城区月考)将体积比1:4的甲烷与氯气混合于一集气瓶中,加盖后10.(3分)(2015春•西城区月考)北京奥运会“祥云”火炬所用燃料的主要成分是丙烷,下和CH3﹣CH2﹣CH2﹣12.(3分)(2010春•西城区期末)某有机物完全燃烧只生成H2O和CO2,对组成该有机物14.(3分)(2015春•西城区月考)使用氢氧燃料电池的汽车已在北京街头出现.下列有关215.(3分)(2007秋•阳江期末)常用的锌锰干电池在放电时总反应可表为:Zn(s)+2MnO2(s)+2NH4+=Zn2++Mn2O3+2NH3+H2O316.(3分)(2013秋•安溪县校级期中)人造地球卫星用一种高能电池﹣银锌电池,该电池的电极反应式为:Zn+2OH﹣﹣2e﹣=ZnO+H2O,Ag2O+H2O+2e﹣=2Ag+2OH﹣,据此判断Ag2O17.(3分)(2009春•朝阳区期末)Fe2O3+3CO2Fe+3CO2是炼铁高炉中发生的一个可逆反应.早在19世纪的欧洲,炼铁工程师就发现在其他条件不变时,增加高炉的高度,高D.18.(3分)(2015春•北京校级期中)在一定条件下,某密闭容器中进行反应:4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g).反应开始时NH3的浓度是1.0mol/L,经过19.(3分)(2015春•西城区月考)室温下,同种规格的铝片分别与下列物质混合,产生氢20.(3分)(2014春•三亚校级期末)过量的锌粉与一定量的稀盐酸反应,为了减慢反应速21.(3分)(2009春•西城区期末)工业生产硫酸过程中的一步反应是2SO2(g)+O2(g)22.(3分)(2015春•北京校级期中)在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图所示.下列叙述中,正确的是()23.(3分)(2012•湖北校级模拟)某固体酸燃料电池以Ca(HSO4)2固体为电解质传递H+,其基本结构如图,电池总反应可表示为:2H2+O2═2H2O,下列有关说法正确的是()24.(3分)(2009•江苏)以葡萄糖为燃料的微生物燃料电池结构示意图如图所示.关于该电池的叙述正确的是()气体25.(3分)(2013•太原模拟)将磁性氧化铁放入稀HNO3中可发生反应:3Fe3O4+28HNO3⇌9Fe二、填空题26.(3分)(2015春•西城区月考)某同学进行图1实验,以检验化学反应中的能量变化.请回答下列问题:实验中发现,反应后①中的温度升高;②中的温度降低.由此判断铝条与盐酸的反应是热反应(填“放”或“吸”,下同),Ba(OH)2•8H2O与NH4Cl的反应是热反应.反应过程(填“①”或“②”)的能量变化可用图2表示.27.(3分)(2015春•西城区月考)电能是现代社会应用最广泛的能源之一.原电池是一种将能转化为电能的装置.如图所示的锌、铜和稀硫酸组成的原电池中,锌片上发生反应(填“氧化”或“还原”).铜片上的电极反应式是.能否根据反应NaOH+HCl=NaCl+H2O 设计成原电池,(填“能”或“否”),原因是.28.(3分)(2015春•西城区月考)A、B、C、D 4种短周期元素,原子序数依次增大.A、C同主族,二者可形成两种常见的化合物,其中一种是常见的严重的大气污染物;B、C、D 同周期,B的最外层电子数比其最内层电子数少1.试回答下列问题:(1)B和D形成的化合物是离子化合物,请写出其电子式.(2)写出实验室制取元素D的单质的化学方程式.(3)D与碘元素可以相互化合生成“互化物”ID,其化学性质跟D单质相似.写出化合物ID 与水反应的化学方程式.(4)写出化合物B2A2的两种用途.29.(3分)(2014春•西城区期中)某同学在实验室进行实验研究化学反应速率的影响因素.(1)研究催化剂对化学反应速率的影响,实验步骤如下:Ⅰ向3支大小相同的试管a、b、c中各加入相同体积(2mL)5% H2O2溶液;Ⅱ向试管a中加入少量MnO2粉末,向试管b中滴加1~2 滴1mol/L FeCl3溶液.得出实验结论:MnO2和FeCl3均能加快H2O2的分解速率,均作催化剂,且前者的催化效率高得多.①步骤I中分别向3支试管中加入相同体积的溶液的目的是.②设计试管c 的目的是.③若继续用上述实验药品研究温度对H2O2分解速率的影响,为了便于观察,选择的催化剂是,原因是.(2)现提供下列实验用品研究化学反应速率的影响因素.实验仪器:试管、烧杯、量筒、天平、秒表实验药品:铝片、铝粉、0.5mol/L 盐酸、5mol/L 盐酸①利用所提供实验用品,可研究的化学反应速率的影响因素是,为了便于观察,你建议记录的数据是.②若要研究温度对化学反应速率的影响,还需用到的主要仪器是.30.(3分)(2015春•北京校级月考)有A、B、C、D四种短周期元素,其原子序数依次增大.A、B可形成A2B和A2B2两种化合物,B、C同主族且B的氢化物在常温下呈液态.回答下列问题.(1)A2B的电子式为.(2)CB2通入A2B2溶液中可被氧化为W,用W的溶液(体积为1L,假设变化前后溶液体积变化忽略不计)组装成原电池(如图1所示)在b电极上发生的反应可表示为:PbO2+4H++SO42﹣+2e﹣=PbSO4+2H2O,则在a电极上发生的反应可表示为.若电池工作一段时间后,a极消耗0.05mol Pb,则W的浓度由质量分数39% (密度1.3g•cm﹣3)变为mol•L ﹣1.(3)金属元素E是中学化学常见元素,位于元素周期表的第四周期.该元素可与D形成ED2和ED3两种化合物.将E的单质浸入ED3溶液中(如图2甲所示),溶液由黄色逐渐变为浅绿色,该反应的离子方程式为.(4)依据(3)中的反应,可用单质E和石墨为电极设计一个原电池,则在该原电池工作时,石墨一极发生的反应可以表示为.比较甲、乙两图,说明石墨除形成闭合回路外所起的作用是.31.(3分)(2011春•黄冈期末)锌锰干电池是最早使用的化学电池,其基本构造如图所示.(1)锌锰干电池的负极是,电路中每通过0.2mole﹣,负极质量减少g;工作时NH4+离子在正极放电产生两种气体,其中一种气体分子是含10e﹣的微粒,正极的电极反应式是.(2)某研究小组对电池内黑色糊状物进行了下列实验.电池内黑色糊状物粉末无色溶液溶解过滤黑色残渣2222示.将等物质的量浓度、等体积H2O2溶液加入烧瓶中,分别进行2个实验(气体的体积在相同条件下测定).实验一、二中参加反应的H2O2的物质的量之比为,实验二中反应的离子方程式为.2014-2015学年北京市西城区高中示范校高一(下)调研化学试卷(5)参考答案与试题解析一、选择题(每小题只有一个正确答案)分)同种非金属元素之间形成极性共价键.3.(3分)(2015春•西城区月考)图中横坐标均表示11~17号元素顺序排列的原子序数.根据图象变化趋势判断,纵坐标表示其最高化合价的是()B可能纵坐标为原子半径的变化规律,故4.(3分)(2010春•思明区校级期中)0.05mol某金属单质与足量的盐酸反应,放出1.12LH2(标准状况),并转变为具有Ar原子的电子层结构的离子,该金属元素在元素周期表中的=0.05mol7.(3分)(2009春•西城区校级期末)短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为14.X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层的最外层电子数为的最外层电子数为=28.(3分)(2015春•西城区月考)元素X、Y、Z均为短周期元素且原子序数之和为35,X、+2﹣9.(3分)(2015春•西城区月考)将体积比1:4的甲烷与氯气混合于一集气瓶中,加盖后10.(3分)(2015春•西城区月考)北京奥运会“祥云”火炬所用燃料的主要成分是丙烷,下CH和CH3﹣CH2﹣CH2﹣题考查了同素异形体、同分异构体、同位素等基本概念,难度不大,明确这几个概12.(3分)(2010春•西城区期末)某有机物完全燃烧只生成H2O和CO2,对组成该有机物14.(3分)(2015春•西城区月考)使用氢氧燃料电池的汽车已在北京街头出现.下列有关2题考查原电池的组成以及工作原理15.(3分)(2007秋•阳江期末)常用的锌锰干电池在放电时总反应可表为:Zn(s)+2MnO2(s)+2NH4+=Zn2++Mn2O3+2NH3+H2O16.(3分)(2013秋•安溪县校级期中)人造地球卫星用一种高能电池﹣银锌电池,该电池的电极反应式为:Zn+2OH﹣﹣2e﹣=ZnO+H2O,Ag2O+H2O+2e﹣=2Ag+2OH﹣,据此判断Ag2O17.(3分)(2009春•朝阳区期末)Fe2O3+3CO2Fe+3CO2是炼铁高炉中发生的一个可逆反应.早在19世纪的欧洲,炼铁工程师就发现在其他条件不变时,增加高炉的高度,高18.(3分)(2015春•北京校级期中)在一定条件下,某密闭容器中进行反应:4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g).反应开始时NH3的浓度是1.0mol/L,经过=mol/=mol/=×19.(3分)(2015春•西城区月考)室温下,同种规格的铝片分别与下列物质混合,产生氢氢离子的浓度最20.(3分)(2014春•三亚校级期末)过量的锌粉与一定量的稀盐酸反应,为了减慢反应速21.(3分)(2009春•西城区期末)工业生产硫酸过程中的一步反应是2SO2(g)+O2(g)该反应达到化学平衡状态的是()D.,故22.(3分)(2015春•北京校级期中)在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图所示.下列叙述中,正确的是()C=判断;C=,23.(3分)(2012•湖北校级模拟)某固体酸燃料电池以Ca(HSO4)2固体为电解质传递H+,其基本结构如图,电池总反应可表示为:2H2+O2═2H2O,下列有关说法正确的是()24.(3分)(2009•江苏)以葡萄糖为燃料的微生物燃料电池结构示意图如图所示.关于该电池的叙述正确的是()气体25.(3分)(2013•太原模拟)将磁性氧化铁放入稀HNO3中可发生反应:3Fe3O4+28HNO3⇌9Fe二、填空题26.(3分)(2015春•西城区月考)某同学进行图1实验,以检验化学反应中的能量变化.请回答下列问题:实验中发现,反应后①中的温度升高;②中的温度降低.由此判断铝条与盐酸的反应是放热反应(填“放”或“吸”,下同),Ba(OH)2•8H2O与NH4Cl的反应是吸热反应.反应过程①(填“①”或“②”)的能量变化可用图2表示.27.(3分)(2015春•西城区月考)电能是现代社会应用最广泛的能源之一.原电池是一种将化学能转化为电能的装置.如图所示的锌、铜和稀硫酸组成的原电池中,锌片上发生氧化反应(填“氧化”或“还原”).铜片上的电极反应式是2H++2e﹣=H2↑.能否根据反应NaOH+HCl=NaCl+H2O 设计成原电池,否(填“能”或“否”),原因是该反应不是氧化还原反应,没有电子转移.、工作原理以及原电池的设计,注意电极反应式书写,28.(3分)(2015春•西城区月考)A、B、C、D 4种短周期元素,原子序数依次增大.A、C同主族,二者可形成两种常见的化合物,其中一种是常见的严重的大气污染物;B、C、D 同周期,B的最外层电子数比其最内层电子数少1.试回答下列问题:(1)B和D形成的化合物是离子化合物,请写出其电子式.(2)写出实验室制取元素D MnO2+4HCl MnCl2+Cl2↑+2H2O.(3)D与碘元素可以相互化合生成“互化物”ID,其化学性质跟D单质相似.写出化合物ID 与水反应的化学方程式ICl+H2O=HIO+HCl.(4)写出化合物B2A2的两种用途漂白剂、供氧剂.故答案为:+4HCl+4HCl29.(3分)(2014春•西城区期中)某同学在实验室进行实验研究化学反应速率的影响因素.(1)研究催化剂对化学反应速率的影响,实验步骤如下:Ⅰ向3支大小相同的试管a、b、c中各加入相同体积(2mL)5% H2O2溶液;Ⅱ向试管a中加入少量MnO2粉末,向试管b中滴加1~2 滴1mol/L FeCl3溶液.得出实验结论:MnO2和FeCl3均能加快H2O2的分解速率,均作催化剂,且前者的催化效率高得多.①步骤I中分别向3支试管中加入相同体积的溶液的目的是控制变量.②设计试管c 的目的是空白对照实验.③若继续用上述实验药品研究温度对H2O2分解速率的影响,为了便于观察,选择的催化剂是FeCl3,原因是FeCl3作催化剂反应速率适中,有利于观察反应速率的变化.(2)现提供下列实验用品研究化学反应速率的影响因素.实验仪器:试管、烧杯、量筒、天平、秒表实验药品:铝片、铝粉、0.5mol/L 盐酸、5mol/L 盐酸①利用所提供实验用品,可研究的化学反应速率的影响因素是盐酸的浓度、铝的表面积,为了便于观察,你建议记录的数据是反应开始到停止所用的时间.②若要研究温度对化学反应速率的影响,还需用到的主要仪器是温度计.支试管中加入相同体积的溶液的目的是控制变量;确定记录数据;根据提供的药品知,盐酸的浓度不同、铝的表面积不同,所以研究的化学反v=30.(3分)(2015春•北京校级月考)有A、B、C、D四种短周期元素,其原子序数依次增大.A、B可形成A2B和A2B2两种化合物,B、C同主族且B的氢化物在常温下呈液态.回答下列问题.(1)A2B的电子式为.(2)CB2通入A2B2溶液中可被氧化为W,用W的溶液(体积为1L,假设变化前后溶液体积变化忽略不计)组装成原电池(如图1所示)在b电极上发生的反应可表示为:PbO2+4H++SO42﹣+2e﹣=PbSO4+2H2O,则在a Pb﹣2e﹣+SO42﹣=PbSO4.若电池工作一段时间后,a极消耗0.05mol Pb,则W的浓度由质量分数39% (密度1.3g•cm﹣3)变为5.07mol•L﹣1.(3)金属元素E是中学化学常见元素,位于元素周期表的第四周期.该元素可与D形成ED2和ED3两种化合物.将E的单质浸入ED3溶液中(如图2甲所示),溶液由黄色逐渐变为浅绿色,该反应的离子方程式为Fe+2Fe3+=3Fe2+.(4)依据(3)中的反应,可用单质E和石墨为电极设计一个原电池,则在该原电池工作时,石墨一极发生的反应可以表示为2Fe3++2e﹣=2Fe2+;.比较甲、乙两图,说明石墨除形成闭合回路外所起的作用是使还原反应和氧化反应在电解质溶液中的不同区域内发生.的电子式,为共价化合物,即水的电子式为:;,故答案为:=5.17mol31.(3分)(2011春•黄冈期末)锌锰干电池是最早使用的化学电池,其基本构造如图所示.(1)锌锰干电池的负极是Zn,电路中每通过0.2mole﹣,负极质量减少6.5g;工作时NH4+离子在正极放电产生两种气体,其中一种气体分子是含10e﹣的微粒,正极的电极反应式是2NH4++2e﹣=2NH3↑+H2↑.(2)某研究小组对电池内黑色糊状物进行了下列实验.电池内黑色糊状物粉末无色溶液溶解过滤黑色残渣NH(3)利用残渣中分离出的MnO2,研究其在H2O2制O2过程中的作用.实验装置如右图所示.将等物质的量浓度、等体积H2O2溶液加入烧瓶中,分别进行2个实验(气体的体积在相同条件下测定).离子实验一、二中参加反应的H2O2的物质的量之比为1:1,实验二中反应的离子方程式为H2O2+2H++MnO2=Mn2++2H2O+O2↑.,正极发生还原反应,工作时,﹣2质的量为。

北京市西城区2014 — 2015学年度第一学期期末试卷高三化学 2015.1说明:1.本试卷满分100分,考试时间120分钟。
2.请将全卷答案填写在答题纸上,在试卷上作答无效。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Fe 56第Ⅰ卷(选择题 共42分)每小题只有1个选项符合题意。
1.下列叙述中不正确...的是 A .SO 2是大气污染物之一 B .食物腐败变质发生了化学变化C .凡含有添加剂的食物对人体健康均有害,不宜食用D .废弃的塑料、金属、纸制品及玻璃都是可回收再利用的资源 2.下列有关物质水解的说法正确的是A .纤维素不能水解成葡萄糖B .油脂水解产物之一是甘油C .蛋白质水解的最终产物是多肽D .蔗糖水解产物仅有葡萄糖 3.下列有关化学用语表示正确的是 A.氮气的电子式: B.羟基的电子式:C.氯离子的结构示意图:D .质子数为92、中子数为146的铀(U)原子的核素符号: 4.下列物质的水溶液:①NaOH 、②CH 3COOH 、③NH 3、④NaHCO 3、⑤Cl 2,不能..溶解CaCO 3的是 A .①③④ B .①④⑤ C .②④ D .②⑤ 5.下列有关钢铁腐蚀与防护的说法不正确...的是 A .生铁比纯铁容易生锈B .钢铁的腐蚀生成疏松氧化膜,不能保护内层金属C .钢铁发生吸氧腐蚀时,正极反应式为:O 2+2H 2O +4e -== 4OH -D .为保护地下钢管不受腐蚀,可使其与直流电源正极相连 6. 下列应用不涉及...氧化还原反应的是 A .铝热法冶炼难熔金属 B .工业上电解熔融状态Al 2O 3制备Al C .Na 2O 2用作呼吸面具的供氧剂 D .实验室用NH 4Cl 和Ca(OH)2制备NH 37.化学与社会密不可分,利用化学反应可实现物质转化和能量转化,下列说法不正确...的是 A .播撒碳酸钙粉末可治理被酸雨污染的湖泊19UB .火力发电是将化学能直接转化为电能C .维生素C 具有还原性,可消除体内具有强氧化性的物质D .过量服用阿司匹林引起酸中毒,可静脉注射NaHCO 3溶液解毒 8.N A 表示阿伏加德罗常数的值,下列说法正确的是A .0.1 mol 甲烷含有的电子数为N AB .1 L 0.1 mol/L Na 2CO 3溶液中含有的CO 3 数目为0.1 N AC .1 L pH=1的硫酸溶液中含有的H + 数为0.2 N AD .标准状况下,2.24 L CO 和CO 2混合气体中含有的氧原子数为0.15N A9.已知34Se 、35Br 位于同一周期,根据元素在周期表中的位置,判断下列说法正确的是 A .离子还原性:Cl ->Br -B .气态氢化物的稳定性:H 2S >H 2SeC .原子半径:Cl >Br >SeD .酸性:H 2SeO 4>HBrO 4>HClO 410.芥子醇是合成工程纤维的单体,结构简式如图。

2015西城区高三一模化学试题与答案6.下列说法不正确...的是 A B C D铝制饭盒聚乙烯盒铁罐车带玻璃塞的试剂瓶不宜长时间存放酸性或碱性的食物能用于盛放食品 可用于运输浓硫酸可用于盛放氢氧化钠溶液7.下列说法正确的是A .鸡蛋清溶液中加入醋酸铅溶液,会发生盐析B .青苹果中富含苹果酸,因此苹果是酸性食物C .过氧化钠可用于呼吸面具或潜水艇中作为氧气的来源D .氢氧化钠、碳酸钙、氢氧化铝等可作为抗酸药 8.用下列装置完成相关实验,不合理...的是A .用a 制备并收集氨气B .用b 制备并检验乙炔C .用c 蒸馏海水得到淡水D .用d 分离Na 2CO 3溶液与CH 3COOC 2H 5 9.下列解释事实的方程式不正确...的是 A .醋酸溶液显酸性:CH 3COOHH ++CH 3COO -B .用氨水除去烟气中的SO 2:SO 2+2NH 3•H 2O =<NH 4>2SO 3+H 2OC .向盐碱地中施放硫酸钙,降低其碱性:Na 2CO 3+CaSO 4=CaCO 3+Na 2SO 4D .用三氯化铁溶液腐蚀线路板:Fe 3++Cu =Fe 2++Cu 2+ 10.下列说法正确的是A .葡萄糖能水解成乙醇和二氧化碳B .氨基乙酸、甲醛、乙二醇均可发生聚合反应C .苯酚能跟碳酸钠溶液反应,则苯酚的酸性比碳酸强D .实验室用溴乙烷在浓硫酸存在并加热条件下制备乙烯11.次磷酸〔H 3PO 2〕是一元弱酸,工业可用下图所示装置电解NaH 2PO 2制H 3PO 2.〔阳离子交换膜和阴离子交换膜分别只允许阳离子、阴离子通过〕下列说法正确的是 A .阳极室有H 2生成B .阴极室溶液pH 减小C .原料室溶液pH 保持不变D .阳极室可能有H 3PO 4生成12.常温下,向1 L pH=10的NaOH 溶液中持续通入CO 2.通入的CO 2的体积〔V 〕与溶液中水电离...出的OH -离子浓度〔φ〕的关系如下图所示. 下列叙述不正确...的是 A .a 点溶液中:水电离出的c <H +>=1×10-10mol/LB .b 点溶液中:c <H +>=1×10-7mol/LC .c 点溶液中:c <Na +>>c <-23CO >>c <-3HCO > D .d 点溶液中:c <Na +>=2c <-23CO >+c <-3HCO >25.〔17分〕有机物E 是制备镇静药安宁G 的中间体,E 和G 的两种合成路线如下.a b c d〔部分反应条件已略去〕〔1〕A 〔2〕A 〔3〕C 〔4〕试剂a 是.〔5〕下列说法正确的是.a .E 能发生取代反应、氧化反应和消去反应b .M 与K 是同系物c .1 mol K 能跟2 molNaOH 发生反应 〔6〕G 的结构简式是.〔7〕在一定条件下E 还能跟COCl 2发生聚合反应生成高分子化合物,该反应的化学方程式是. 〔8〕G 的同分异构体P ,分子中含有结构,P 的核磁共振氢谱有5组峰,P 能水解生成CH 3CH 2NH 2和甲,1 mol 甲跟足量钠反应生成2 mol H 2.则P 的结构简式是.26.〔13分〕硫与其化合物有广泛应用. 〔1〕硫元素在周期表中的位置是.〔2〕硒〔34Se 〕与硫在元素周期表中位于同一主族.下列说法正确的是.a .沸点:H 2Se>H 2S>H 2Ob .H 2Se 比H 2S 稳定性强c .Se 的原子半径比S 原子大d .SeO 2和SO 2含有的化学键类型相同 〔3〕SO 2可用于制H 2SO 4.已知25℃、101kPa 时:2SO 2<g>+O 2<g>+2H 2O<g>=2H 2SO 4<l> △H 1=-545kJ/mol H 2O<g>=H 2O<l> △H 2=-44kJ/mol SO 3<g>+H 2O<l>=H 2SO 4<l> △H 3=-130kJ/mol 则2SO 2<g>+O 2<g>2SO 3<g> △H =kJ/mol.〔4〕为研究H 2SO 4生产中SO 2催化氧化时温度对SO 2平衡转化率的影响,进行如下试验.取100L 原料气〔体积分数为SO 27%、O 2 11%、N 2 82%〕使之发生反应,在101kPa 下达到平衡,得到如下数据:根据上述数据,达平衡态时N 2的体积分数随着温度升高而〔填"增大"、"减小"或"不变"〕;575℃达平衡时,SO 3的体积分数为%〔保留一位小数〕.〔5〕废气中的SO 2可用NaOH 溶液吸收,吸收SO 2后的碱性溶液还可用于Cl 2的尾气处理,吸收Cl 2后的溶液仍呈强碱性.① 吸收Cl 2后的溶液中一定存在的阴离子有OH -、.② 吸收Cl 2后的溶液中可能存在SO 32-,取该溶液于试管中,滴加黄色的溴水,得到无色溶液.此实验不能证明溶液中含有SO 32-,理由是.27.〔13分〕工业上用菱锰矿〔MnCO 3〕[含FeCO 3、SiO 2、Cu 2<OH> 2CO 3等杂质]为原料制取二氧化锰,其流程示意图如下:已知:注:金属离子的起始浓度为0.1 mol/L回答下列问题:〔1〕含杂质的菱锰矿使用前需将其粉碎,主要目的是.盐酸溶解MnCO 3的化学方程式是. 〔2〕向溶液1中加入双氧水时,反应的离子方程式是.〔3〕滤液2中加入稍过量的难溶电解质MnS,以除去Cu 2+,反应的离子方程式是.〔4〕将MnCl 2转化为MnO 2的一种方法是氧化法.其具体做法是用酸化的NaClO 3溶液将MnCl 2氧化,该反应的离子方程式为: □Mn 2++□ClO 3-+□____=□____+□____+□____. 〔5〕将MnCl 2转化为MnO 2的另一种方法是电解法.①生成MnO 2的电极反应式是.②若直接电解MnCl 2溶液,生成MnO 2的同时会产生少量Cl 2.检验Cl 2的操作是. ③若在上述MnCl 2溶液中加入一定量的Mn<NO 3>2粉末,则无Cl 2产生.其原因是. 28.〔15分〕为探究Ag +与Fe 3+氧化性的相关问题,某小组同学进行如下实验:已知:相关物质的溶解度〔20o C 〕AgCl :1.5×10-4 g Ag 2SO 4:0.796 g 〔1〕甲同学的实验如下:注:经检验黑色固体为Ag①白色沉淀的化学式是.②甲同学得出Ag +氧化了Fe 2+的依据是.〔2〕乙同学为探究Ag +和Fe 2+反应的程度,进行实验Ⅱ.a .按右图连接装置并加入药品〔盐桥中的物质不参与反应〕,发现电压表指针偏移.偏移的方向表明:电子由石墨经导线流向银.放置一段时间后,指针偏移减小. b.随后向甲烧杯中逐渐加入浓Fe 2<SO 4>3溶液,发现电压表指针的变化依次为:偏移减小→回到零点→逆向偏移. ① a 中甲烧杯里的电极反应式是.② b中电压表指针逆向偏移后,银为极〔填"正"或"负"〕.2 5③ 由实验得出Ag +和Fe 2+反应的离子方程式是.〔3〕为进一步验证乙同学的结论,丙同学又进行了如下实验:①实验Ⅲ〔填"能"或"不能"〕证明Fe 3+氧化了Ag,理由是. ②用化学反应原理解释实验Ⅳ与Ⅴ的现象有所不同的原因:. 6D7C8B9D10B11D12B 25.〔17分〕〔1〕醛基〔2分〕新制氢氧化铜〔或银氨溶液〕〔2分〕 〔2〕加成反应〔2分〕〔3〕 〔2分〕 〔4〕CH 3Br 〔答CH 3I 得分〕〔1分〕 〔5〕b 、c 〔2分〕 〔6〕 〔2分〕 〔7 〔2〔8〕 〔2分〕26.〔13分〕〔1〕第3周期ⅥA 族〔2分〕〔2〕c d 〔2分〕 〔3〕-197〔2分〕〔4〕减小〔2分〕;5.8〔2分〕 〔5〕①SO 42-、Cl -〔2分〕②NaOH 溶液能跟溴单质反应,使溶液呈无色〔1分〕27.〔13分〕〔1〕增大接触面积,提高反应速率〔2分〕MnCO 3+2HCl=MnCl 2+CO 2↑+H 2O 〔2分〕 〔2〕2Fe2++H 2O 2+4H 2O=2Fe<OH>3↓+4H +〔1分〕 〔3〕MnS +Cu 2+=Mn 2++CuS 〔1分〕〔4〕5Mn 2++2ClO 3-+4H 2O =Cl 2↑+5MnO 2+8H +〔2分〕 〔5〕① Mn 2+-2e -+2H 2O =MnO 2+4H +〔2分〕CH 3CH 2CH 2—CH —CHO+HCHO CH 3CH 2CH 2—C —CHO | CH 3 OH -|CH 3CH 2OH |②将润湿的淀粉碘化钾试纸置于阳极附近,若试纸变蓝则证明有Cl2生成〔1分〕③ 其它条件不变下,增大Mn2+浓度[或增大c<Mn2+>/ c<Cl->],有利于Mn2+放电〔不利于Cl-放电.〕〔2分,其余答案不得分〕28.〔15分〕〔1〕① Ag2SO4 〔2分〕②有黑色固体〔Ag〕生成,加入KSCN溶液后变红〔2分〕〔2〕① Fe2+ -e-=Fe3+〔2分〕②负〔2分〕③ Fe2++Ag+Fe3++Ag〔2分〕〔3〕①不能〔1分〕因为Fe<NO3>3溶液呈酸性,酸性条件下NO3-也可能氧化Ag.〔2分〕②溶液中存在平衡:Fe3++Ag Fe2++Ag+,且AgCl比Ag2SO4溶解度更小,Cl-比SO42-更有利于降低Ag+浓度,所以实验Ⅴ比实验Ⅳ正向进行的程度更大.〔或促使平衡正向移动,银镜溶解〕〔2分〕。
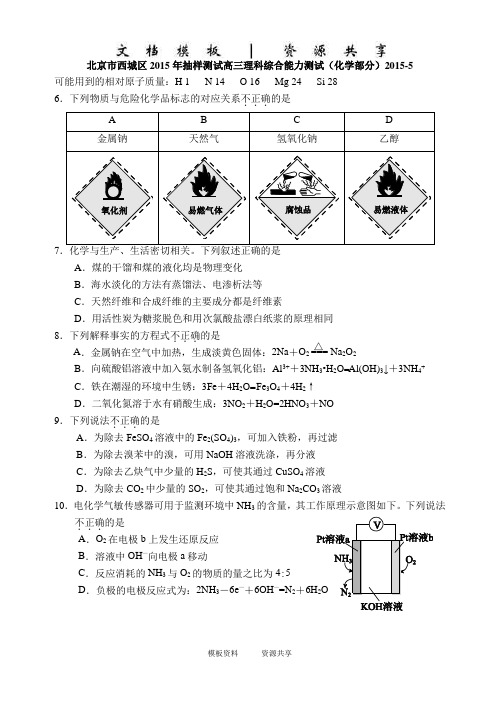
北京市西城区2015年抽样测试高三理科综合能力测试(化学部分)2015-5可能用到的相对原子质量:H 1 N 14 O 16 Mg 24 Si 286.下列物质与危险化学品标志的对应关系不正确...的是A B C D金属钠天然气氢氧化钠乙醇7A.煤的干馏和煤的液化均是物理变化B.海水淡化的方法有蒸馏法、电渗析法等C.天然纤维和合成纤维的主要成分都是纤维素D.用活性炭为糖浆脱色和用次氯酸盐漂白纸浆的原理相同8.下列解释事实的方程式不正确...的是△A.金属钠在空气中加热,生成淡黄色固体:2Na+O2 === Na2O2B.向硫酸铝溶液中加入氨水制备氢氧化铝:Al3++3NH3•H2O=Al(OH)3↓+3NH4+C.铁在潮湿的环境中生锈:3Fe+4H2O= Fe3O4+4H2↑D.二氧化氮溶于水有硝酸生成:3NO2+H2O=2HNO3+NO9.下列说法不正确...的是A.为除去FeSO4溶液中的Fe2(SO4)3,可加入铁粉,再过滤B.为除去溴苯中的溴,可用NaOH溶液洗涤,再分液C.为除去乙炔气中少量的H2S,可使其通过CuSO4溶液D.为除去CO2中少量的SO2,可使其通过饱和Na2CO3溶液10.电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下。
下列说法不正确...的是A.O2在电极b上发生还原反应B.溶液中OH—向电极a移动C.反应消耗的NH3与O2的物质的量之比为4:5D.负极的电极反应式为:2NH3-6e—+6OH—=N2+6H2O11.依据下列实验现象,得出的结论正确的是操作实验现象结论A 将氯水加入NaBr溶液中,再加入淀粉KI溶液溶液先变黄,后变蓝氧化性:Cl2>Br2>I2B 将铝片放入盐酸中产生气泡的速率开始时较慢,随后加快,后来又逐渐减慢H+的浓度是影响反应速率的唯一因素C 向蔗糖溶液中加入稀硫酸,水浴加热后,加入新制氢氧化铜,加热得到蓝色溶液蔗糖水解产物没有还原性D 向漂白粉中滴入稀硫酸,将生成的气体通入品红溶液品红溶液褪色气体中含有Cl226.(13分)氯气是重要的化工原料,有广泛的用途。

化学大练习答案海淀区高三年级第一学期期末练习第I 卷(选择题,共42分)共14道小题,每小题3分,共42分。
15.(13分,未标分数的空,每空1分)(1)① CH 3COOH CH 3COO -+H + (2分)② b 、c (2分,漏选得1分,错选不得分) (2)① I ② 0.1 mol·L -1 醋酸溶液③ < ④ c (CH 3COO -)> c (Na +)> c (H +)> c (OH -)(3)① Fe 3++3SCN-Fe(SCN)3 (2分) ② 出现白色沉淀③ AgSCN(s) Ag +(aq)+SCN -(aq)(1分),加入KI 后,因为溶解度:AgI < AgSCN ,Ag +与I -反应生成AgI 黄色沉淀:Ag ++I - === AgI ↓,AgSCN 的溶解平衡正向移动(1分)。
(2分) 16.(13分,未标分数的空,每空1分) (1)b锌等做原电池的负极,(失电子,Zn -2e - === Zn 2+),不断遭受腐蚀,需定期拆换(2)阴 2Cl - - 2e -=== Cl 2↑湿润的淀粉碘化钾试纸放在阳极附近,试纸变蓝,证明生成氯气(或取阳极附近溶液滴加淀粉、KI 溶液,变蓝)(3)① 负 ClO - + 2e - + H 2O === Cl -+ 2OH -(2分)② Mg + 2H 2O === Mg(OH)2 + H 2↑(4)① HOOC-COOH + 2e -+ 2H + ===HOOC-CHO + H 2O (2分)② 2 (2分)17.(12分,未标分数的空,每空1分) (1)取代反应(或硝化反应)(2)醛基(3) (2分) (4)知:①②③CHOCH 3C OO CCH 3OCH CHCOOHNO 2NH 2Fe/HCl CH 3COOHKMnO 4/H +CH 32+ Br 2CH 32Br HBr+FeBr CH CHCOOH +CH 2CHCH 2OHCH CHCOOCH 2CH CH 2H 2O 浓+(写“→”不扣分)(2分) (5)a(6)(2分)(7)6或18.(10分,未标分数的空,每空1分)(1) 使固体与气体充分接触,加快反应速率 (2)b(3)① 该反应的实质是H +与SO 32-反应,70%的硫酸中含水较多,c (H +)和c (SO 32-)都较大,生成SO 2速率更快 防止倒吸② 2H 2S + SO 2 === 3S + 2H 2O 或 2H 2S + H 2SO 3 === 3S ↓+ 3H 2O (2分) Na 2SO 3 + S Na 2S 2O 3 (2分)(4)FeS 2 + 2HCl === FeCl 2 + H 2S ↑+ S ↓ (2分) 19.(10分,未标分数的空,每空1分) (1)Fe 3+ + 3H 2O Fe(OH)3 + 3H + Cu + 2H 2SO 4(浓) CuSO 4 + SO 2↑ + 2H 2O (2分)(2)H 2O + SO 2 H 2SO 3 H 2SO 3 H ++HSO 3- (1分)Fe 3+ + HSO 3-Fe(HSO 3)2+(1分) (共2分)Fe + H 2O + Fe(HSO 3)=== 2Fe 2+ + SO 42-+ 3H + (2分) (3)生成蓝色沉淀(4)加热、提高FeCl 3溶液的酸性会缩短浅绿色出现的时间 (2分)北京市西城区2014—2015学年度第一学期期末试卷1~6小题,每小题2分;7~16小题,每小题3分。

北京市西城区2015年高三一模试卷理科综合能力化学测试本试卷分为选择题和非选择题两个部分,选择题1-5页,非选择题6-15页,共300分。
考试时长150分钟。
考生务必将答案填写在答题卡上和答题纸的相应区域内,在试卷上作答无效。
考试结束后,将本试卷及答题卡和答题纸一并交回。
可能用到的相对原子质量:H 1 C 12 N 14 O 166A B C D铝制饭盒聚乙烯盒铁罐车带玻璃塞的试剂瓶不宜长时间存放酸性或碱性的食物能用于盛放食品可用于运输浓硫酸可用于盛放氢氧化钠溶液【答案】D【命题立意】本题旨在考查化学与生活相关知识。
【解析】A.长期放置铝会与酸碱发生反应.B.聚乙烯可用于食物包装.C.浓硫酸与铁发生钝化.D.碱性试剂瓶应用橡胶塞.故选:D.7.下列说法正确的是()A.鸡蛋清溶液中加入醋酸铅溶液,会发生盐析B.青苹果中富含苹果酸,因此苹果是酸性食物C.过氧化钠可用于呼吸面具或潜水艇中作为氧气的来源D.氢氧化钠、碳酸钙、氢氧化铝等可作为抗酸药【答案】C【命题立意】本题旨在考查化学与食品药品相关知识。
【解析】A.蛋白质遇重金属会变性.B.酸性食物是指在代谢过程中产生酸的食物.C.过氧化钠可与二氧化碳反应产生氧气.D.氢氧化钠是强碱,会腐蚀肠道.故选:C.8.用下列装置完成相关实验,不合理的是()A.用a制备并收集氨气B.用b制备并检验乙炔C.用c蒸馏海水得到淡水D.用d分离Na2CO3溶液与CH3COOC2H5【答案】B【命题立意】本题旨在考查化学实验相关知识。
【解析】B中制得的乙炔可能含有硫化氢等杂质,该杂质能与酸性高锰酸钾反应.A、C、D均正确.故选:B.9.下列解释事实的方程式不正确的是()A.醋酸溶液显酸性:CH3COOH H++CH3COO-B.用氨水除去烟气中的SO2:SO2+2NH3•H2O=(NH4)2SO3+H2OC.向盐碱地中施放硫酸钙,降低其碱性:Na2CO3+CaSO4=CaCO3+Na2SO4D.用三氯化铁溶液腐蚀线路板:Fe3++Cu=Fe2++Cu2+【答案】D【命题立意】本题旨在考查方程式的书写。
2015西城区高三一模化学试题及答案D验乙炔C.用c蒸馏海水得到淡水 D.用d分离Na2CO3溶液与CH3COOC2H59.下列解释事实的方程式不正确...的是A.醋酸溶液显酸性:CH3COOH H++CH3COO-B.用氨水除去烟气中的SO2:SO2+2NH3•H2O=(NH4)2SO3+H2OC.向盐碱地中施放硫酸钙,降低其碱性:Na2CO3+CaSO4=CaCO3+Na2SO4D.用三氯化铁溶液腐蚀线路板:Fe3++Cu=Fe2++Cu2+10.下列说法正确的是A.葡萄糖能水解成乙醇和二氧化碳B.氨基乙酸、甲醛、乙二醇均可发生聚合反应C.苯酚能跟碳酸钠溶液反应,则苯酚的酸性比碳酸强D.实验室用溴乙烷在浓硫酸存在并加热条件下制备乙烯11.次磷酸(H3PO2)是一元弱酸,工业可用下图所示装置电解NaH2PO2制H3PO2。
(阳离子交换膜和阴离子交换膜分别只允许阳离子、阴离子通过)下列说法正确的是A .阳极室有H 2生成B .阴极室溶液pH 减小C .原料室溶液pH 保持不变D .阳极室可能有H 3PO 4生成12.常温下,向1 L pH=10的NaOH 溶液中持续通入CO 2。
通入的CO 2的体积(V )与溶液中水电离...出的OH -离子浓度(φ)的关系如下图所示。
下列叙述不正确...的是 A .a 点溶液中:水电离出的c (H +)=1×10-10mol/LB .b 点溶液中:c (H +)=1×10-7mol/LC .c 点溶液中:c (Na +)>c (-23CO )>c (-3HCO )D .d 点溶液中:c (Na +)=2c (-23CO )+c (-3HCO )25.(17分)有机物E 是制备镇静药安宁G 的中间体,E 和G 的两种合成路线如下。
(部分反应条件已略去)已知:回答下列问题:(1)A中所含官能团的名称是,检验该分子中官能团的常用试剂是。
(2)A与C含有相同的官能团,B生成C的反应类型是。
北京市西城区普通高中校2014—2015学年度第一学期高一化学期中阶段复习测试卷 2班级姓名相对原子质量H-1 C-12 N-14 O-16 Na-23 Mg-24 Al-27 S-32 Cl-35.5 K-39Ⅰ卷(共100分)一、选择题(本题包括25个小题,每小题2分,每小题只有一个....选项符合题意)1.在下列物质种类中,前者包含后者的是A.混合物溶液B.电解质化合物C.浊液胶体D.单质化合物2.下列仪器中,能在酒精灯火焰上直接加热的是A.烧瓶B.烧杯C.试管D.量筒3.下列物质中,属于电解质的是A.CO2B.H2C.Na2SO4D.Cu4.0.5mol Na2SO4中所含的Na+离子数为A.3.01×1023 B.6.02×1023 C.0.5 D.15.欲除去铜粉中少量的铁粉,可选用的试剂是A.水B.氢氧化钠溶液C.稀硫酸D.稀硝酸6.下列实验操作中错误的是A.用规格为10mL 的量筒量取6mL 的液体B.用钥匙或纸槽将粉末状药品送入试管底部C.过滤时玻璃棒的下端应靠在三层滤纸处D.如果没有试管夹,可以临时手持试管给固体或液体加热7.下列反应一定条件下能够发生且属于离子反应的是A.H2在O2中点燃B.NaCl溶液和K2CO3溶液C.NaOH溶液和CuSO4溶液D.加热KMnO4制备氧气8.从S元素的化合价判断,下列物质只能具有还原性的是A.H2SO4B.SO2C.S D.H2S9.下列说法中正确的是A.凡带有正电荷的离子一定是金属阳离子B.Na2SO4溶液在电流作用下电离出Na+与SO42-而导电C.硫酸在水溶液中电离出的阳离子全部是氢离子,所以硫酸属于酸D.电流不能通过液态氯化氢,所以氯化氢不是电解质10.下列实验操作中正确的是A.蒸发操作时,将蒸发皿中固体完全蒸干停止加热B .蒸馏操作时,应使温度计水银球伸入液面以下C .蒸馏操作时,冷凝水应从冷凝管下口进,上口出D .萃取操作时,所选择的萃取剂密度必须大于水11. 有关氧化还原反应实质的说法中正确的是A .是否有元素的电子转移B .是否有元素的化合价的变化C .是否有氧元素的参加D .是否有原子的重新组合 12.下列叙述错误的是A .1molNaCl 中含有N A 个Na +和N A 个Cl -B .0.012kg 12C 含有约6.02×1023个碳原子C .在使用摩尔表示物质的量的单位时,应用化学式或汉字指明粒子的种类D .摩尔数是国际单位制中七个基本物理量之一13、下列离子方程式书写正确的是A .稀盐酸滴在锌粒上:Zn + H + ==Zn 2+ +H 2 ↑B .氯化钡溶液滴入稀硫酸中:Ba 2+ + SO 42- == BaSO 4↓C .大理石和稀盐酸反应:CO 32- + 2H + == CO 2↑+ H 2OD .澄清石灰水中加入盐酸:Ca (OH )2+2H + == Ca 2+ + 2 H 2O14.在3NO 2+H 2O==2HNO 3+NO 反应中,氧化剂与还原剂的分子数之比是A .2︰1B .1︰2C .3︰1D .1︰315.下列有关物质分离方法的叙述中,不正确的是A .用过滤的方法分离溶液和胶体B .用蒸馏的方法将自来水制成蒸馏水C .用四氯化碳萃取碘水中的碘D .用分液的方法可以分离汽油和水16.关于离子检验和除杂,下列说法不正确的是A .向溶液中加入AgNO 3溶液,有白色沉淀,溶液中有Cl -存在B .CO 32-会干扰氯化钡对SO 42-的检验,需加入HCl 排除干扰C .CO 2可用NaOH 溶液做吸收剂,但不可用Ca (OH )2D .除去NaCl 溶液中少量的Ca 2+,需加入稍过量的Na 2CO 3,过量试剂要除去17.下列反应中,属于氧化还原反应的是A .2 H 2O 2 催化剂2 H 2O + O 2↑ B .CuCl 2 + 2 NaOH = Cu(OH)2↓+ 2NaCl C .FeO + 2 HCl = FeCl 2 + H 2O D .2 Al(OH)3 △Al 2O 3 + 3 H 2O18.下列各物质所含原子数目,按由大到小顺序排列的是①1g 氢气 ②0.5mol NH 3 ③0.2mol H 3PO 4 ④4℃9mL 水A .①④③②B .③②④①C .②③④①D .①④②③19.下列说法正确的是A .非标准状况下,1mol 任何气体的体积不可能为22.4LB.常温常压下22.4L任何气体都含有约6.02×1023个分子C.标准状况下22.4L/mol就是气体摩尔体积D.1mol H2和O2的混合气体在标准状况下的体积约为22.4L20.50 mL 1 mol·L-1的AlCl3溶液中所含Cl-数目是A.0.15 N A B.0.2 N A C.0.05 N A D.0.1N A21.N A代表阿伏加德常数,下列说法正确的是A.在同温同压时,相同体积的任何气体单质所含的原子数目相同B.2g氢气所含原子数目为N AC.在常温常压下,11.2L氮气所含的原子数目为N AD.17g氨气所含电子数目为10N A22、在强酸性溶液中能大量共存且为无色透明的离子组是A.NH4+、Al3+、SO42-、Cl- B.Na+、S2-、K+、CO32-C.K+、NH4+、MnO4-、SO42- D.Na+、K+、NO3-、HCO3-23.下列化学方程式中,不能用H++OH-=H2O表示的是A.2NaOH +H2SO4 =Na2SO4 +2H2OB.Ba(OH)2 +2HCl =BaCl2 +2H2OC.Cu(OH)2 +2HNO3 =Cu(NO3)2 +2H2OD.KOH +HCl =KCl +H2O24.下列变化需要加入适当的氧化剂才能完成的是A.CuO → Cu B.Fe → FeCl2C.H2SO4 → SO2D.HNO3 → N2O25.将xmol/L的H2SO4溶液a mL稀释到bL,稀释后溶液中H+的物质的量浓度是A.ax/1000b B.ax/2000b C.ax/500b D.ax/b二、填空题26.(8分)写出下列反应的离子方程式(1)铁钉放入硫酸铜溶液中(2)碳酸钙与盐酸反应(3)向足量澄清石灰水中通入少量二氧化碳(4)用稀盐酸洗涤铁锈(铁锈主要成分为Fe2O3)27.(6分)Fe(OH)3胶体的实验室制备方法是:将5-6滴滴入中,继续加热煮沸,至停止加热。
海淀区高三年级第二学期期中练习理科综合能力测试(化学)2015.4可能用到的相对原子质量:H 1 C 12 O 16 Mg 246.下列用品的主要成分及其用途对应不正确...的是7.下列有关钢铁腐蚀和防护的说法不.正确..的是A.自行车的钢圈上镀一层铬,防止生锈B.外加直流电源保护钢闸门时,钢闸门与电源的负极相连C.钢铁发生吸氧腐蚀的正极反应:2H2O +O2+4e-=== 4OH-D.钢铁发生析氢腐蚀的负极反应:Fe – 3e-=== Fe3+8.下列说法正确的是A.淀粉和纤维素水解的最终产物都是葡萄糖B.可以用NaOH溶液除去乙酸乙酯中的乙醇C.天然油脂的主要成分是高级脂肪酸D.CH≡CH和CH2=CHCH=CH2互为同系物9.下列解释事实的方程式正确的是A.在空气中切开金属钠,光亮表面变暗:2Na+O2 === Na2O2B.向氯化铝溶液中加入过量氨水,产生白色沉淀:Al3+ + 3OH- === Al(OH)3↓C.将铁粉与水蒸气共热,产生气体:2Fe+3H2O(g)△2O3+3H2D.电解饱和氯化钠溶液,产生气体:2NaCl+2H2O 电解2NaOH+H2↑+Cl2↑10. 下列选项中的反应、现象与结论完全一致的是(夹持、加热装置已略去)11. 已知重铬酸钾(K2Cr2O7)溶液中存在如下平衡:Cr2O72-(橙色)+ H2O2H++ 2CrO42-(黄色)①向2 mL 0.1 mol·L-1 K2Cr2O7溶液中滴入3滴6 mol·L-1 NaOH溶液,溶液由橙色变为黄色;向所得溶液中再滴入5滴浓H2SO4,溶液由黄色变为橙色。
②向2 mL 0.1 mol·L-1酸化的K2Cr2O7溶液中滴入适量(NH4)2Fe(SO4)2溶液,溶液由橙色变为绿色,发生反应:Cr2O72- + 14H++ 6Fe2+ === 2Cr3+(绿色) + 6Fe3+ + 7H2O。
北京市西城区2015年高三一模试卷
理科综合能力测试 2015.4
本试卷分为选择题和非选择题两个部分,选择题1-5页,非选择题6-15页,共300分。
考试时长150分钟。
考生务必将答案填写在答题卡上和答题纸的相应区域内,在试卷上作答无效。
考试结束后,将本试卷及答题卡和答题纸一并交回。
可能用到的相对原子质量: H 1 C 12 N 14 O 16 6.下列说法不正确...
的是 不宜长时间存放酸性或碱性的食物能用于盛放食品可用于运输浓硫酸可用于盛放氢氧化钠溶液7.下列说法正确的是8
9.下列解释事实的方程式不正确...
的是 A .醋酸溶液显酸性:CH 3++CH 3COO -
B .用氨水除去烟气中的SO 2:SO 2+2NH 3•H 2O =(NH 4)2SO 3+H 2O
C .向盐碱地中施放硫酸钙,降低其碱性:Na 2CO 3+CaSO 4=CaCO 3+Na 2SO 4
D .用三氯化铁溶液腐蚀线路板:Fe 3++Cu =Fe 2++Cu 2+
10.下列说法正确的是
A .葡萄糖能水解成乙醇和二氧化碳
B.氨基乙酸、甲醛、乙二醇均可发生聚合反应
C.苯酚能跟碳酸钠溶液反应,则苯酚的酸性比碳酸强
D.实验室用溴乙烷在浓硫酸存在并加热条件下制备乙烯
11.次磷酸(H3PO2)是一元弱酸,工业可用下图所示装置电解NaH2PO2制H3PO2。
(阳离子交换膜和阴离子交换膜分别只允许阳离子、阴离子通过)下列说法正确的是
12
25.(17分)有机物E是制备镇静药安宁G的中间体,E和G的两种合成路线如下。
(部分反应条件已略去)
(1
(2
(3
(4
(5
(6
(7
(8
是。
26.(13分)硫及其化合物有广泛应用。
(1)硫元素在周期表中的位置是。
a.沸点:H2Se>H2S>H2O b.H2Se比H2S稳定性强
c.Se的原子半径比S原子大d.SeO2和SO2含有的化学键类型相同(3)SO2可用于制H2SO4。
已知25℃、101kPa时:
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l) △H1=-545kJ/mol
H2O(g)=H2O(l) △H2=-44kJ/mol
(g)
28.(15分)为探究Ag+与Fe3+氧化性的相关问题,某小组同学进行如下实验:已知:相关物质的溶解度(20o C)AgCl:1.5×10-4 g Ag2SO4:0.796 g
(1)甲同学的实验如下:
①实验Ⅲ(填“能”或“不能”)证明Fe3+氧化了Ag,理由是。
②用化学反应原理解释实验Ⅳ与Ⅴ的现象有所不同的原因:。
北京市西城区2015年高三一模试卷
参考答案及评分标准
理科综合能力测试2015.4 选择题(20个小题每题6分共120分)
25
(1
(2
(3
(4
(5
(6)
(7
(8
26.(13分)
(1)第3周期ⅥA族(2分)
(2)c d(2分)
(3)-197(2分)
(4)减小(2分);5.8(2分)
(5)① SO42-、Cl-(2分)
② NaOH溶液能跟溴单质反应,使溶液呈无色(1分)
27.(13分)
(1)增大接触面积,提高反应速率(2分)
MnCO3+2HCl=MnCl2+CO2↑+H2O(2分)
(2)2Fe2++H2O2+4H2O=2Fe(OH)3↓+4H+(1分)
(3)MnS+Cu2+=Mn2++CuS(1分)
(4)5Mn2++2ClO3-+4H2O=Cl2↑+5MnO2+8H+(2分)
(5)①Mn2+-2e-+2H2O=MnO2+4H+(2分)
②将润湿的淀粉碘化钾试纸置于阳极附近,若试纸变蓝则证明有Cl2生成(1分)
③其它条件不变下,增大Mn2+浓度[或增大c(Mn2+)/ c(Cl-)],有利于Mn2+放电(不利于
Cl-放电。
)(2分,其余答案不得分)
28.(15分)
(1)① Ag2SO4 (2分)
②有黑色固体(Ag)生成,加入KSCN溶液后变红(2分)
(2)① Fe2+ -e-=Fe3+(2分)
②负(2分)
③ Fe2++Ag+Fe3++Ag(2分)
(3)①不能(1分)
因为Fe(NO3)3溶液呈酸性,酸性条件下NO3-也可能氧化Ag。
(2分)
②溶液中存在平衡:Fe3++Ag Fe2++Ag+,且AgCl比Ag2SO4溶解度更小,
Cl-比SO42-更有利于降低Ag+浓度,所以实验Ⅴ比实验Ⅳ正向进行的程度更大。
(或
促使平衡正向移动,银镜溶解)(2分)。