生物分离工程实验-实验一
- 格式:ppt
- 大小:546.00 KB
- 文档页数:15

生物分离工程实验实验一茶多酚标准曲线的测定仪器:紫外分光光度计,比色皿,天平,容量瓶,移液管,pH计、试管药品:没食子酸丙酯或茶多酚,酒石酸钾钠,硫酸亚铁,磷酸氢二钠,磷酸二氢钾。
方法:A溶液配制没食子酸丙酯标准溶液配制准确称取25mg没食子酸丙酯,蒸馏水溶液,移入25mL容量瓶并稀释至刻度,摇匀,配制成1mg/mL的标准溶液酒石酸亚铁溶液配制准确称取0.1g硫酸亚铁,和0.5g酒石酸钾钠,混合,蒸馏水溶解后移入100mL容量瓶,稀释至刻度,摇匀。
pH7.5磷酸盐缓冲液配制磷酸氢二钠:准确称取分析纯磷酸氢二钠2.969g,蒸馏水稀释溶解,移入250mL容量瓶,加水稀释至刻度,摇匀,为a液磷酸二氢钾:准确称取分析纯磷酸二氢钾,、2.2695g,蒸馏水溶解,移入250mL容量瓶,定容,B。
取A液体85mL,B液体15mL混合均匀,即成。
B.标准曲线绘制分别吸取0、0.25、0.50、0.75、1.0、1.25mL的没食子酸丙酯标准液于25mL容量瓶中,加入蒸馏水4mL,再加入酒石酸亚铁溶液5mL,用pH7.5的磷酸盐缓冲溶液稀释至刻度,摇匀,分光光度计在540nm处,1cm比色皿,分别测定吸光度。
空白参比操作同上,不加没食子酸丙酯。
以容量瓶中没食子酸丙酯的绝对含量mg为横坐标,吸光度为纵坐标,绘制标准曲线,做线性回归。
C 样品测定取适量样品加入容量瓶,操作同上,没食子酸丙酯含量乘以换算系数1.5,求得茶多酚。
实验二超声法和回流法提取茶多酚的比较实验仪器:超声提取器、布氏漏斗、抽滤瓶、真空泵、烧瓶、量筒、分光光度计、比色皿、容量瓶等、实验试剂茶叶、纯净水、茶多酚(没食子酸丙酯)、硫酸亚铁、酒石酸钾钠、磷酸氢二钠、磷酸二氢钾等操作方法1、材料准备称取一定量的茶叶,研钵粉碎。
备用2、提取A、超声提取法称取5g粉碎后茶叶末,放入烧瓶(塑料袋密封),加入100mL水,于超声提取器,50℃提取20min,抽滤,定容至100mL,待测。

实验一絮凝技术预处理发酵液及其滤饼的质量比阻测定(见教材)实验三PEG/(NH4)2SO4 两水相系统的相图(见教材)实验二利用盐析和等电点沉淀法从牛奶中制备酪蛋白1 实验目的掌握盐析和等电点沉淀法的原理和基本操作。
2 实验原理乳蛋白广泛存在于乳制品中,牛奶中主要含有酪蛋白,酪蛋白在pH 4.8是沉淀,乳蛋白素则在pH=3左右才会沉淀。
利用这一性质可以先将降至4.8,或者是在加热至40℃的牛奶中加人硫酸钠,将酪蛋白沉淀出来。
酪蛋白不溶于乙醇,利用乙醇可以除去杂质。
将除掉酪蛋白的溶液pH调至3左右,使乳蛋白素沉淀析出。
可以得到乳蛋白素。
3实验器材烧杯;玻璃试管;离心管;磁力搅拌器;pH计;离心机等。
4试剂和材料⑴试剂与材料脱脂牛乳;无水硫酸钠;HCL;氢氧化钠;滤纸;pH试纸;浓盐酸;乙醇;0.2mol/L pH 4.8醋酸-醋酸钠缓冲液。
⑵缓冲溶液的配制0.2mol/L pH 4.8醋酸-醋酸钠缓冲液(先配A液与B液):A液:0.2mol/L醋酸钠溶液称NaAC·3H2O 54.44g,定容至2000mL。
B液:0.2mol/L醋酸溶液,取醋酸(含量大于99.8%)12 mL定容至1000mL。
取A液1770mL,B液1230mL混合即得pH4.8的醋酸—醋酸钠缓冲液3000mL。
5操作步骤1)盐析法制备酪蛋白①将50mL牛乳倒至烧杯中,40℃搅拌;②方法一:在烧杯中缓缓加入10g无水硫酸钠,之后再继续搅拌10min;方法二:在搅拌下慢慢加入预热至40℃、pH 4.8的醋酸缓冲液100mL.用精密pH试纸或酸度计调pH至4.8。
③用细布过滤分别收集沉淀和滤液。
将沉淀放于30mL乙醇中倾倒于布氏漏斗中过滤除去乙醇溶液,抽干。
将沉淀从布氏漏斗中移出,在表面皿中展开除去乙醇,干燥后得到酪蛋白。
准确称量。
2)等电点沉淀法制备乳蛋白素将操作1)所得到的滤液置于烧杯中,一边搅拌,一边利用pH计测量酸度,并用盐酸调整pH至3。

生物物质分离工程实验实验须知:1、认真预习理解每个实验的目的、原理、操作关键步骤和注意事项。
2、按时上课,迟到20分钟以上者建议重做实验;上实验课时须带实验指导、记录本和笔等。
3、分组后应固定,不能随意更换,不大声喧闹,遵守实验室规则。
4、实验前由教师讲解实验原理、实验具体操作方法以及如何写实验报告。
5、每次实验结束,每组的实验用具要清洗,并却待老师检查实验结果后,方能离开实验室6、学生每次实验要写出规范实验报告,报告数据必须如实记录。
7、教师根据实验操作情况、打扫卫生情况、实验报告及最后考核给出成绩(总分100份)。
(说明:生物工程专业本课程实验总学时为32个,因此安排11个实验生物技术专业本课程实验总学时为16个,因此安排6个实验,做前6个实验)2012年2月实验一有机溶剂萃取法中pH对表观分配系数的影响(第一次实验)一、实验目的和要求1.通过实验,加深对表观分配系数的理解并掌握其测定方法。
22.以红霉素为实验对象,了解pH在萃取工艺中的重要性。
二、实验原理1•红霉素为大环内酯类抗生素,呈弱碱性,在不同pH条件下,在水溶液和有机溶液中溶解度不同,故能达到不同程度的分配。
表观分配系数是指在一定温度和压力下,当分配达到平衡时溶质在萃取相和萃余相中总浓度之比,可通过实验方法测定。
对于弱电解质,溶液的pH对表观分配系数影响很大。
一元弱碱性物质溶液pH对表观分配系数K的关系式见式(1-6-4)1+10pK-pH式中:K0――热力学分配系数,在一定的温度和压力下是常数pk——化合物电离平衡常数的负对数由上式可知,随溶液pH升高,K值增大,有利于红霉素萃取到有机溶剂中。
反之,K 值减小,可将红霉素从有机相反萃取到水相。
2.利用红霉素在冰醋酸中被浓盐酸水解后,与对二甲氨基苯甲醛形成有色物质,并在486nm波长处有最大吸收值的特性,可测定其化学效价,从而计算出表现分配系数。
三、实验器材与试剂(一)器材精密电子天平,60ml分液漏斗,分光光度计,恒温水浴锅,pH酸度计,移液管,烧杯,量筒,试管,50ml容量瓶,称量瓶和温度计等。

山西大同大学
生命科学学院教案
课程名称:生物分离工程实验
教材名称:生物分离工程实验
授课对象:11级生工1班
授课学期:2013-2014第二学期
讲课学时:32
授课教师:张睿、张弘弛
技术职务:讲师
工作单位:生科院生工系
编写时间:2014年4月
审阅意见:
温度t = ℃
编号
H2O
加量/g
(NH4)2SO4
溶液加量纯(NH
4
)2SO4
累计量/g
溶液累
计总量/g
PEG400
质量分
数/%
(NH4)2SO4
质量分数/% /ml/g
1 0.5
2 0.3
3 0.3
4 0.3
5 0.5
6 0.5
7 0.5
注:如果实验室的电子台秤(精确至0.01g)能做到每组一台,也可采用在电子台秤上称取质量的方式来加(NH4)2SO4溶液,这样就不需要通过密度转换,更直观。
五、思考题
(一)预习
1.简述两水相萃取中成相的原因。
2.说明实验数据的每步计算方法。
(二)实验结果和讨论
1.将实验结果列入表格,并作出相图。
2.实验操作中应注意哪些问题?分析试验误差。

生物分离工程实验强调一下:下周一、二下午(3月31日、4月1日)一点半在生物楼411上实验,预习实验一、带讲义、不许迟到。
共5次课,缺席一次就没有成绩。
生物分离工程实验吴国峰郑春英二零一四年三月实验一凝胶色谱法分离蛋白质一、实验目的1. 掌握凝胶色谱的基本原理;2. 掌握凝胶色谱的基本操作;3. 了解物质在色谱柱中的洗脱行为与分配系数的关系。
二、实验原理本实验将蓝葡聚糖2000(分子质量2000kD )、细胞色素c (分子质量17kD )和DNFP-甘氨酸(分子质量0.5kD )的混合物通过交联葡聚糖凝胶G-50(Sephadex G-50)的色谱柱,以蒸馏水为洗脱溶剂进行洗脱。
蓝葡聚糖2000分子量最大,全部被排阻在凝胶颗粒的间隙中,而未进入凝胶颗粒内部,因而洗脱速度最快,最先流出柱,其V e =V o 即K d =0。
DNFP-甘氨酸分子量最小,不被排阻而可完全进入凝胶颗粒内部,洗脱速度最慢,最后流出柱,其V e =V i +V o 即K d =1。
细胞色素c 分子量在上述二者之间,其洗脱速度居中。
可以从蓝、红、黄三种不同颜色直接观察到三种物质分离的情况,并通过洗脱体积计算V i 、V o 和各自的K d 。
d K 与e V 、0V 和i V 的关系见下式:d K 0e iV V V -= 式中 K d ——分配系数,表示其被排阻的程度,只与被分离物质分子的大小和凝胶颗粒孔隙的大小分布有关;V t ——柱体积,从柱的底板到凝胶沉积表面的体积,在色谱柱中充满凝胶的部分称为凝胶床;V 0——外水体积,色谱柱内凝胶颗粒间隙,这部分体积称外水体积,亦称间隙体积;V i ——内水体积,因为凝胶为三维网状结构,颗粒内部仍有空间,液体可进入颗粒内部,即分间隙的总和为内水体积,又称定相体积(不包括固体支持物的体积g V );V e ——峰洗脱体积,指被分离物质通过凝胶柱所需洗脱液的体积。
通常情况下,0<K d <1,当K d >1时,说明凝胶对组分有吸附作用。

生物分离工程实验——超声波提取植物总黄酮分离提取及鉴定一、实验目的为充分利用天然植物资源,避免资源的浪费,探讨植物总黄酮的提取及鉴别方法。
二、实验原理采用超声波乙醇浸提法从植物材料(银杏叶或菊花)中提取黄酮类物质,对所提取的黄酮类物质进行验证,并用分光光度法测定含量。
利用超声波产生的强烈振动、高的加速度、强烈的空化效应、搅拌作用等,可加速植物材料中的有效成分进入溶剂,从而增加有效成分的提取率,缩短提取时间,并且还可避免高温对提取成分的影响。
三、实验材料原料:银杏叶、菊花或其它含黄酮化合物的植物材料,如新鲜芹菜买自市农贸市场。
试剂:95%乙醇AR;亚硝酸钠AR;硝酸铝AR;氢氧化钠AR;三氯化铝AR;盐酸AR;氨水AR;冰醋酸AR;醋酸乙酯AR;芦丁标准品(中国药品生物制品检定所)四、实验仪器KQ5200DB型数控超声波清洗器(超声工作频率40kHz、宁波新芝超声仪器有限公司);UV 755B紫外可见分光光度计(上海分析仪器总厂);ZF-I型三用紫外分析仪(上海顾村光电仪器厂);SHB III循环水式多用真空泵(郑州长城科工贸有限公司)。
五、实验步骤(一)总黄酮成分提取取新鲜芹菜叶或干燥植物材料,烘干后粉碎。
称取粉末约6 g,加80 ml 95%乙醇,超声波提取0.5 h或不同时间,抽滤。
滤渣再加80 ml 95 %乙醇,再次超声波提取0.5 h,抽滤,合并两次滤液,减压回收乙醇至滤液仅剩5~7 ml为止,放置100 ml容量瓶中,用60%乙醇稀释至刻度,得样品液。
(二)定量实验-总黄酮的含量测定以芦丁为对照品测定植物材料中总黄酮的含量,加入铝离子试剂,同时控制适宜pH值,使黄酮化合物与铝盐形成络合物,在可见光区能获得稳定的特征吸收峰。
1. 波长的选择取样品液适量,在0.30 ml 5%亚硝酸钠溶液存在的碱性条件下,经硝酸铝显色后,以试剂为空白参比液在420~700 nm波长范围测定络合物的吸光度,络合物于510 nm波长处有最大吸收,故测定时选用此波长。

实验一植物可溶性糖的测定一、实验目的加深对单糖、二糖、多糖化学性质的认识,进一步体会糖类化合物的分子结构与其化学性质的关系。
二、实验原理糖是多羟基醛、多羟基酮或它们的缩合物。
单糖及分子中含有半缩醛(酮)羟基的二糖都具有还原性,能将班氏试剂还原成砖红色的Cu2O沉淀。
蔗糖等不含有半缩醛(酮)羟基的糖则无还原性。
但蔗糖经水解生成了葡萄糖和果糖,因而水解液具有还原性。
多糖是由许多单糖缩合而成的高分子化合物,无还原性。
但多糖在酸存在下加热水解,可生成单糖,随之具有还原性。
淀粉为一多糖,经水解先生成糊精,再水解成麦芽糖,最终水解产物是葡萄糖,因此水解液也具有还原性,能与班氏试剂发生反应。
淀粉遇碘显蓝色,此反应很灵敏,常用于检验淀粉或碘。
糖在浓酸存在下,可与酚类化合物产生颜色反应。
糖在浓硫酸的作用下与α-萘酚反应显紫色,常用于糖类化合物的检出。
己酮糖与间-苯二酚- 盐酸试剂反应很快出现鲜红色,而己醛糖显色缓慢,两分钟后可出现微弱的红色,因此常用于区别酮糖(果糖)和醛糖(葡萄糖)。
三、实验仪器、试剂试剂的配制(1)班氏试剂的配制:称取柠檬酸钠20g,无水碳酸钠11.5g,溶于100ml热水中,在不断搅拌下把含2g硫酸铜晶体的20ml 水溶液慢慢加入。
溶液应澄清,否则需过滤。
(2)2淀粉溶液:将2g可溶性淀粉用10ml 蒸馏水调成糊状,加入90ml沸水中煮沸后冷却。
(3)0.1碘液:在1g碘和5g碘化钾中,加入尽可能少的蒸馏水使其溶解,然后用蒸馏水稀释为1000ml。
(4)α-萘酚试剂的配制:将10gα-萘酚溶于95乙醇中,再用同样的乙醇稀释至100ml,贮于棕色瓶中,一般用前才配制。
(5)间-苯二酚-盐酸试剂的配制:将0.05g间-苯二酚溶于50ml浓盐酸中,再用蒸馏水稀释至100ml。
四、实验方法和步骤(一)糖的还原性:取5支大试管,编号后各加入1ml班氏试剂,再分别加入2葡萄糖、2果糖、2麦芽糖、2蔗糖和2淀粉溶液各10滴。

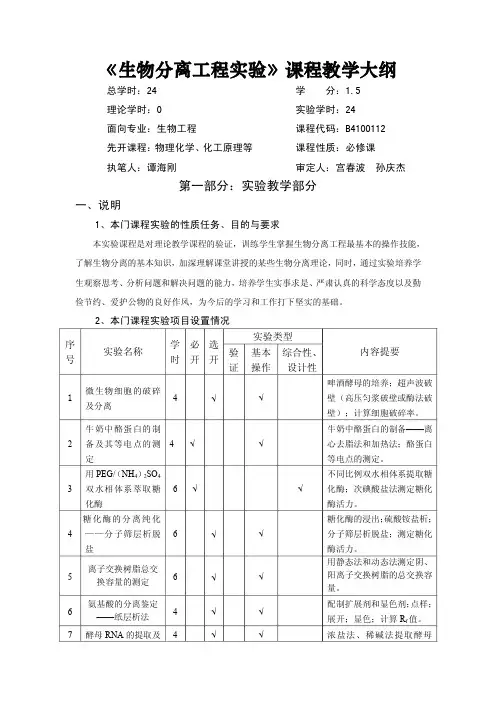
《生物分离工程实验》课程教学大纲总学时:24 学 分:1.5理论学时:0 实验学时:24面向专业:生物工程 课程代码:B4100112先开课程:物理化学、化工原理等 课程性质:必修课执笔人:谭海刚 审定人:宫春波 孙庆杰第一部分:实验教学部分一、说明1、本门课程实验的性质任务、目的与要求本实验课程是对理论教学课程的验证,训练学生掌握生物分离工程最基本的操作技能, 了解生物分离的基本知识,加深理解课堂讲授的某些生物分离理论,同时,通过实验培养学 生观察思考、分析问题和解决问题的能力,培养学生实事求是、严肃认真的科学态度以及勤 俭节约、爱护公物的良好作风,为今后的学习和工作打下坚实的基础。
2、本门课程实验项目设置情况实验类型序号 实验名称学时必开选开验证基本操作综合性、设计性内容提要1 微生物细胞的破碎及分离4 √ √啤酒酵母的培养;超声波破壁(高压匀浆破壁或酶法破壁);计算细胞破碎率。
2 牛奶中酪蛋白的制备及其等电点的测定4 √ √牛奶中酪蛋白的制备——离心去脂法和加热法;酪蛋白等电点的测定。
3 用 PEG/ (NH4) 2SO4双水相体系萃取糖化酶6 √ √不同比例双水相体系提取糖化酶;次碘酸盐法测定糖化酶活力。
4 糖化酶的分离纯化——分子筛层析脱盐6 √ √糖化酶的浸出; 硫酸铵盐析;分子筛层析脱盐;测定糖化酶活力。
5 离子交换树脂总交换容量的测定6 √ √用静态法和动态法测定阴、阳离子交换树脂的总交换容量。
6 氨基酸的分离鉴定——纸层析法4 √ √配制扩展剂和显色剂; 点样;展开;显色;计算 R f 值。
7 酵母 RNA的提取及 4 √ √ 浓盐法、稀碱法提取酵母定性和定量鉴定 ——浓盐法和稀碱 法 RNA;紫外分光光度计测定 酵母 RNA的含量。
8 薄层层析法分离鉴定糖分4 √ √配制扩展剂和显色剂; 制板;点样;展开;显色;计算 Rf值9用超滤技术分离和浓缩碱性蛋白酶 (糖化酶)8 √ √以碱性蛋白酶(糖化酶)粗品为料液超滤,同时进行超滤性能各项指标的研究,包括膜的水通量、截留率、超滤速度随透出液体积而变化的规律。
![生物分离技术综合实验2010[1][1].11--_...](https://uimg.taocdn.com/9b840832bed5b9f3f90f1cd4.webp)

实验一、香菇多糖的分离提取一、实验目的让学生了解香菇多糖的理化性质及提取工艺流程,掌握真空浓缩技术。
二、实验原理香菇是一种药食两用真菌,具有提高免疫力、抗癌、降糖等多种生理功能。
水溶性多糖作为香菇主要活性成分之一,主要以©1,3-葡聚糖的形式,分子量从几万到几十万不等。
通过有机溶剂提取,真空浓缩技术进行分离提取。
三、实验材料与试剂原料:干香菇500g试剂:氯仿、正丁醇、医用纱布、浓硫酸、重蒸酚、工业酒精四、实验仪器组织捣碎机、水浴锅、旋转蒸发器、1cm比色皿、751分光光度计、电子天平、台式离心机、试管、量筒、烧杯、玻璃棒五、提取工艺流程1.1kg干香菇切成小块,以1:10 (重量比)加入水,用组织捣碎机进行均质;2.取200mL均质液放入1L烧杯中,再加入300mL蒸馏水,加热至沸后,温火煮沸1小时,(注意:煮沸过程中用玻璃棒不断搅拌,以免烧杯底部发生糊结;并间歇加入少量水,使杯内液体体积保持在500mL左右;3.加热完毕后,将杯内液体用8层纱布过滤,除去残渣,上清液转入另一烧杯中;4.将上清液倒入圆底烧瓶中,在旋转浓缩仪上进行浓缩,浓缩条件为-0.1MPa、60℃,浓缩液体积至100mL左右停止;5.将浓缩液在1义10000g离心10min,将上清液转入另一烧杯,除去残渣;6.上清液中加入等体积的氯仿正丁醇浓液(体积比为4:1),搅拌5min,静置30分钟;7.将混合液体在1义5000g下离420min,分离水相;8.在水相中加入终浓度为80%的酒精,搅拌均匀,静置20min, 1X5000g下离心10min;9.取出沉淀物,放入已称重的干燥表面皿中,在真空干燥箱中80℃下真空干燥;10.干燥后,称重,计算多糖的产率;11.准确称取干燥后多糖20mg于500ml容量瓶中,加水定容;12.取定容液2ml加入6%苯酚1ml,混匀,再加入浓硫酸5ml,混匀,放置20min后,于490nm测吸光度;13.葡萄糖标准曲线的制定:准确称取葡萄糖20mg定容于500ml容量瓶中,分别取0.4、0.6、0.8、1.0、1.2、1.4、1.6及 1.8ml,补水至2ml,依12步骤反应液,并分别测吸光度,根据葡萄糖浓度和吸光度绘制标准曲线;14.根据香菇多糖吸光度和葡萄糖标准曲线,计算多糖纯度。
生物物质分离工程生物物质分离工程实验李菊娣编辽宁石油化工大学环境工程系二○○七年三月生物物质的分离、提取实验是以实验操作为主的技能课程,是生物工程专业学生的必修课,是在学习《分析化学》、《生物化学》《微生物学》、《发酵工程》、《生物分离工程》等专业基础课及专业实验课的基础上开设的课程。
目的在于通过本课程的实验训练,使学生对整个生物工程下游生产过程有一个全面的认识和理解,既可培养他们实际操作的技能,又可达到提高他们理论联系实际能力的目的。
通过学习,使学生能够掌握物质分离常用的纯化方法和常见的分离设备,为以后的学习和科研工作打下良好的基础。
实验一、微生物细胞的破碎及分离实验二、青霉素的萃取及萃取率的计算实验三、醋酸丁酯萃取红霉素实验四、牛奶中酪蛋白和乳蛋白素粗品的制备实验五、胰凝乳蛋白酶的制备实验六、薄层色谱法鉴定果汁中的糖实验七、离子交换法提取L-精氨酸备注:实验二、三选作其一;实验五、六选作其一。
实验一微生物细胞的破碎及分离一、实验目的与要求实验目的:1、掌握超声波细胞破碎的原理和技术,学习细胞破碎率的评价方法。
2、通过本试验使学生复习以前所学的分离知识及掌握微生物学实验、发酵工程实验技能,同时通过本试验使学生掌握超声波破碎仪的使用。
3、通过按照给定的研究题目,独立的进行试验,并观察试验中的各种现象,分析总结实验得出的各种数据并撰写相应的研究及实验报告等各过程,来培养学动手能力和独立分析问题的能力,并了解学习科学研究的基本过程与要求,提高科学研究的素质,为将来从事科学研究打好基础。
实验要求:1、复习生物物质分离课程所学到的微生物细胞的分离方法,了解影响微生物细胞的破碎因素。
2、独立查阅相关资料,设计实验方案,并对实验所需的各种药品、玻璃仪器及分析设备列出清单,写出详尽的试验过程及需要。
3、三人一组,互相配合,开展实验,动手完成实验,并记录并分析实验中的实验现象、数据,必要时及时修改试验计划。
4、总结试验数据,经教师认定后,撰写实验报告。
大蒜细胞SOD酶的提取分离与活性测定一、实验目的1.掌握SOD酶的提取分离检测一般步骤2.了解酶在提取分离过程中的两个参数:回收率和纯化倍数二、实验原理超氧化物岐化酶(Superoxide dismutase,简称SOD)广泛存在于生物体内的含Cu、Zn、Mn、Fe的金属类酶。
它作为生物体内重要的自由基清除剂,可以清除体内多余的超氧阴离子,在防御生物体氧化损伤方面起着重要作用。
离子(02-)是人体氧代谢产物,它在体内过量积累会引起炎症、肿瘤、色斑沉淀、衰老等疾病,超氧阴离子与生物体内许多疾病的发生和形成有关。
作为药用酶、由于SOD能专一消除超氧阴离子(O2∙-)而起到保护细胞的作用,具有广阔的应用前景,并引起了国内外医药界、生物界和食品界的极大关注。
SOD的活力测定方法很多,常见的有化学法、免疫法和等电点聚焦法。
其中化学法应用最普遍,化学法的原理主要是利用有些化合物在自氧化过程中会产生有色中间物和O2∙-,利用SOD分解而间接推算酶活力。
在化学方法中,最常用的有黄嘌呤氧化酶法,邻苯三酚法,化学发光法,肾上腺素法,NBT-还原法,光化学扩增法,Cyte还原法等。
其中改良的邻苯三酚自氧化法简单易行较为实用。
在一般情况下,SOD酶活性测定只能应用间接活性测定法。
本实验采用邻苯三酚自氧化方法。
邻苯三酚在碱性条件下,能迅速自氧化,释放出O2-,生成带色的中间产物,中间物的积累在滞留30~45s后,与时间成线性关系,一般线性时间维持在4min的范围内,中间物在420nm波长处有强烈光吸收。
当有SOD存在时,由于它能催化O2-与H+结合生成O2和H2O2,从而阻止了中间产物的积累,因此,通过测定光吸收即可求出SOD的酶活性。
酶活力单位定义:在25℃恒温条件下,每毫升反应液中,每分钟抑制邻苯三酚自氧化率达50%的酶量定义为1个酶活力单位。
三、试剂和器材大蒜、冷丙酮、磷酸缓冲液(PH7.8,0.05mol/L)、氯仿-乙醇混合液(3;5v/v)、邻苯三酚、浓盐酸、天平、石英砂、研钵、冷冻离心机、50mL离心管 8个、紫外-可见分光光度计、250mL三角瓶8个、玻璃棒8根、试剂瓶250mL 3个、500mL 3个、250mL烧杯16个、试管带胶塞80根、移液管各5根。
生物分离实验篇一:生物分离工程实验讲义实验一:牛乳中酪蛋白的提取一、实验目的1、掌握等电点法提取蛋白的基本原理及基本操作;2、掌握双缩脲法测定蛋白含量的基本原理及基本操作。
二、实验原理酪蛋白是乳蛋白质中最丰富的一类蛋白质,约占乳蛋白的80~82%,酪蛋白不是单一的蛋白质,是一类含磷的复合蛋白质混合物,以一磷酸酯键与苏氨酸及丝氨酸的羟基相结合。
它还含有胱氨酸和蛋氨酸这两种含硫氨基酸,但不含半胱氨酸。
它在牛乳中的含量约为35g/L,比较稳定,利用这一性质,可以检测牛乳中是否掺假。
酪蛋白在其等电点时由于静电荷为零,同种电荷间的排斥作用消失,溶解度很低,利用这一性质,经牛乳调到pH4.6,酪蛋白就从牛乳中分离出来。
酪蛋白不溶于乙醇,这个性质被利用来从酪蛋白粗制剂中将脂类杂质除去。
在乳制品加工或成品中,酪蛋白含量是一个常需测定的指标。
常用于测定酪蛋白的方法是先将酪蛋白在等电点沉淀,再用凯氏定氮法测定。
本实验采用双缩脲法测定酪蛋白。
其原理为:蛋白质含肽键,肽键在碱性溶液中可与铜离子形成紫红色化合物,在540nm波长处有最大吸收,其颜色深浅与蛋白质浓度成正比,而与蛋白质分子量及氨基酸组成无关。
三、材料与试剂市售牛奶10mg/mL酪蛋白标准溶液(用0.1MNaOH配制)0.1MNaOH溶液、0.2MpH4.6的HAc-NaAc缓冲液双缩脲试剂:称取硫酸铜(CuSO4·5H2O)1.5g,加水100mL,加热助溶;另称取酒石酸钾钠(NaKC4H4O6·4H2O)6.0g、碘化钾5g溶于500mL水中。
两液混匀后,在搅拌下加入10%NaOH300mL,后用水稀释至1000mL,贮存于塑料瓶中。
此液可长期保存,若瓶底出现黑色沉淀则需重新配制。
四、操作步骤1、牛乳中酪蛋白的等电点沉淀用量筒量取25mL牛乳两份分别置于50mL烧杯中,水浴加热至40℃,在搅拌下慢慢加入到已预热至40℃的等体积的0.2MpH4.6的HAc-NaAc缓冲液中,混匀,冷却静置30min沉淀酪蛋白后,3000r/min离心15min,弃上清液,收集沉淀。
生物分离工程实验课程设计一、实验目的这个实验旨在通过炼制毛细管电泳,展示生物分离工程的基本原理和技术手段。
本实验的目的是:•了解毛细管电泳的基本原理和技术;•学习电泳条件对生物分离的影响;•熟悉毛细管电泳实验操作流程,掌握实验技能;•通过实验分析,比较不同物质的分离情况,从而对样品的纯化和鉴定提出合理的建议。
二、实验器材和试剂•毛细管电泳仪器;•水平电泳装置;•电源;•pH计;•10x TBE缓冲液;•聚丙烯酰胺凝胶;•乙醇;•20% SDS;•明胶;•分子量标准品;•DNA样品。
3.1 准备工作•将10x TBE缓冲液用去离子水稀释至1x TBE缓冲液;•准备1L prepared gel solution;3.2 样品制备将不同长度的DNA分子处理,以得到不同长度的DNA片段,然后对DNA片段进行检测。
3.3 水平电泳•将聚丙烯酰胺凝胶放在水平电泳中;•准备样品,将样品加入凝胶槽中;•电泳条件调整:300V,50-55mA,40-60分钟;•取下凝胶板,将凝胶染色。
3.4 后续分析•同标准品比较分子量。
•将电泳结果记录在实验本中。
四、实验注意事项•实验中DNA样品应该做好安全措施,包括低温保存、使用防护手套等;•在电泳前,将电泳槽注满1x TBE缓冲液;•电泳前,还应该确认凝胶是否干燥,样品是否均匀点入凝胶缺口中;•聚丙烯酰胺凝胶、明胶使用过程中,应该使用计量工具、量杯、试管等实验仪器,防止发生误差;本实验通过对生物分离工程的学习与毛细管电泳实验的练习,我们学习到了实验内容以及实验技能。
同时,本实验也拓展了我们的实验思维,培养了我们的动手实际操作能力。
本次实验可以让我们对毛细管电泳的原理和应用有一个更深刻的理解。
所以,在实际实验操作中,应该认真对待每一个环节,尽可能地减少实验误差。