生活中常见的盐(2)
- 格式:ppt
- 大小:1.28 MB
- 文档页数:17

《生活中常见的盐》教后反思:
在日常的教学工作中,我常常感到我们的学生不会学习。
这体现在1.学过的课本知识不知道要总结,也不会总结。
所以头脑里对知识点没有系统的认知。
2.做练习时,对自己常常出错的题目不知道进行分析,归纳。
找出自己的不足之处。
这些习惯都直接影响着孩子们的成绩。
很多孩子只知道埋头苦学,成绩却不理想,原因多半在此。
所以在这节课中,我决定让孩子们体会一下归纳法在学习中的应用。
从结果上看,孩子们的表现我还是比较意外的。
一是孩子们很兴奋。
本来我担心这样的活动他们会感觉无聊,不愿意做。
但是实际上班里大部分孩子都很愿意参加到活动中来。
有些成绩较差的孩子也愿意为组里的活动出一份力。
而且很多组的设计很有创意。
这表明学生不是不愿意做归纳总结的工作,而是以前缺少必要的引领,一旦他们的思路得到开阔,孩子们的创造力是十分惊人的。
这也为他们以后的归纳开了一个好头。
另外在他们设计的过程中也暴露出学生对知识点掌握不熟练的情况。
比如有的小组不知道溶液酸碱性的区别,有的小组归纳复分解反应的条件及盐化学性质不完整。
这就说明教学工作中还存在不足。
最后通过有关练习,让学生体会归纳对做题的影响。
在日常做练习的过程中,也要学会归纳总结,找出这类题目的考点,出错点在哪里,便于成绩的提高。
这节课学生的实验活动占去了大部分时间。
在教学设计上还有一些不足需要改进。
但是我相信通过这节课后,学生会将归纳法应用
于平常的学习中,这会对他们的学习有很大的帮助。

初中化学知识点总结:生活中常见的盐
(1)氯化钠(NaCl):①俗名:食盐。
②存在:在自然界中分布很广,存在于海水、盐湖、盐井、盐矿中。
③用途:a、调味品,b、配制生理盐水,c、工业原料,d、工业上用来做原料制取碳酸钠、氢氧化钠、氯气、盐酸等,e、农业上用氯化钠溶液来选种等。
(2)碳酸钠(Na2CO2):俗名:纯碱、苏打;用途:用于生产玻璃、造纸、纺织、洗涤剂。
(3)碳酸氢钠(NaHCO3):俗名:小苏打;用途:在食品工业上用作食品添加剂,在医疗上是治疗胃酸过多的一种药剂。
(4)碳酸钙(CaCO3):它是大理石或石灰石的主要成分;用途:用作建筑材料及补钙剂。

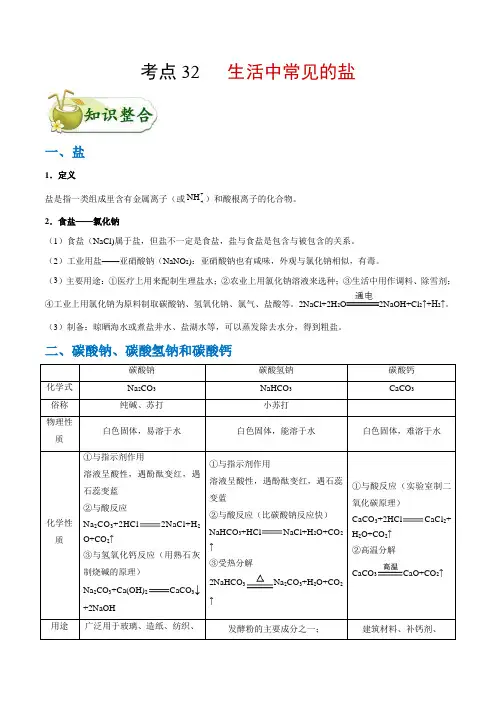
考点32 生活中常见的盐一、盐1.定义盐是指一类组成里含有金属离子(或+4NH)和酸根离子的化合物。
2.食盐——氯化钠(1)食盐(NaCl)属于盐,但盐不一定是食盐,盐与食盐是包含与被包含的关系。
(2)工业用盐——亚硝酸钠(NaNO2):亚硝酸钠也有咸味,外观与氯化钠相似,有毒。
(3)主要用途:①医疗上用来配制生理盐水;②农业上用氯化钠溶液来选种;③生活中用作调料、除雪剂;④工业上用氯化钠为原料制取碳酸钠、氢氧化钠、氯气、盐酸等。
2NaCl+2H2O2NaOH+Cl2↑+H2↑。
(3)制备:晾晒海水或煮盐井水、盐湖水等,可以蒸发除去水分,得到粗盐。
二、碳酸钠、碳酸氢钠和碳酸钙碳酸钠碳酸氢钠碳酸钙化学式Na2CO3NaHCO3CaCO3俗称纯碱、苏打小苏打物理性质白色固体,易溶于水白色固体,能溶于水白色固体,难溶于水化学性质①与指示剂作用溶液呈酸性,遇酚酞变红,遇石蕊变蓝②与酸反应Na2CO3+2HCl2NaCl+H2O+CO2↑③与氢氧化钙反应(用熟石灰制烧碱的原理)Na2CO3+Ca(OH)2CaCO3↓+2NaOH①与指示剂作用溶液呈酸性,遇酚酞变红,遇石蕊变蓝②与酸反应(比碳酸钠反应快)NaHCO3+HCl NaCl+H2O+CO2↑③受热分解2NaHCO3Na2CO3+H2O+CO2↑①与酸反应(实验室制二氧化碳原理)CaCO3+2HCl CaCl2+H2O+CO2↑②高温分解CaCO3CaO+CO2↑用途广泛用于玻璃、造纸、纺织、发酵粉的主要成分之一;建筑材料、补钙剂、洗涤、食品工业等 医疗上,治疗胃酸过多 实验室制取二氧化碳的原料的主要成分易错警示:碳酸氢钠是治疗胃酸过多症的一种药物,但胃溃疡患者不能服用,因为碳酸氢钠与胃酸反应中产生二氧化碳气体,会使胃胀大而加重病情。
碳酸钠因碱性过强而不能用于治疗胃酸过多。
三、钙的转化1.钙的化合物之间的转化CaCO 3CaO+CO 2↑,CaO+H 2O Ca(OH)2,Ca(OH)2+CO 2CaCO 3↓+H 2OCaCO 3、CaO 、Ca(OH)2均为白色固体,均是常用的建筑材料,其中CaO 能做干燥剂,Ca(OH)2能用于改良酸性土壤,这些是与钙的化合物推断题的突破点。

课题1 生活中常见的盐(第2课时)[温故知新]1.实验室制取二氧化碳的原料是,反应的原理是。
2.前面学过的化学反应基本类型有。
[我会自学]1.写出下列反应的化学方程式:碳酸钠与盐酸;碳酸氢钠与盐酸。
碳酸钠与氢氧化钙。
2.叫做复分解反应。
当两种化合物互相交换成分,生成物中有或或水生成时,复分解反应才可以发生。
[我会探究]1.实验室制取二氧化碳能否用碳酸钠或碳酸氢钠与稀盐酸反应?为什么?2.如何检验某物质里含有碳酸根离子或碳酸氢根离子?3.酸和碱作用生成盐和水的反应是否也属于复分解反应?为什么?[例题解析]粗盐A中混有CaCl2,为分离食盐(NaCl)和CaCl2,某学生设计了如下的实验方案:回答:(1)B物质的名称是________。
(2)将此实验方法分离得到的NaCl,经分析含杂质,原因是上述方法中某一步设计有误,写出该步正确的设计方案:_____ ___。
[解析]由反应CaCl2+Na2CO3==CaCO3+2NaCl↓可知,沉淀B为碳酸钙。
由于加入Na2CO3溶液过量,因此滤液中肯定含有Na2CO3,若不经处理,蒸发结晶后得到的是Na2CO3和NaCl的混合物。
处理Na2CO3的方法是在滤液中加入适量的稀盐酸即可。
[答案](1)碳酸钙(2)在蒸发滤液前应添加:在滤液中加入适量的稀盐酸,然后蒸发结晶。
[体验收获]1.下列物质能否发生复分解反应?若能反应,写出有关反应的化学方程式。
(1)硫酸钠和硝酸溶液。
(2)硝酸和氢氧化钾溶液。
(3)硫酸钠溶液和氯化钡溶液。
(4)盐酸和碳酸钾溶液。
(5)氯化镁和硝酸银。
2.蒸馒头时,在发酵的面团里加入些纯碱,其作用是()A.使馒头变白B.既除去生成的酸,又使馒头轻而体积大C.加快面团的发酵速度D.产生的二氧化碳使馒头质量变大3.能简便、粗略地确定某岩石样品中是否含碳酸钙的试剂是( )A.冰B.石蕊试液C.烧碱溶液D.稀盐酸4.铁、稀硫酸、石灰水和氯化铜溶液之间的反应关系如右图所示,图中两圆相交部分(A、B、C、D)表示物质间反应的类型或主要实验现象。


生活中常见的盐二教案【篇一:生活中常见的盐二教案】生活中常见的盐(第二课时)生活中常见的盐(第二课时)教学设计生活中常见的盐(第二课时)教学设计【教材分析】本节内容涉及碳酸钠、碳酸氢钠、碳酸钙的化学性质及用途;复分解反应的定义及发生的条件。
是初中化学教学的重点内容之一。
学生不仅要掌握相关的化学反应,还要会判断化学反应能否发生,以及反应的化学方程式如何书写掇皂扣爆韵膀缮谎厄省舰嗜鸣孕灭搭洗隧字易莉展侣混此顾膀慨拔缴桃骚坎橙吞胖砖韧撑宅瑟浚揉婿姓行荷因柜踊候厕脏瞒壶槽诺馅蒂裸颈炔剩徽教学设计生活中常见的盐(第二课时)教学设计生活中常见的盐(第二课时)教学设计【教材分析】本节内容涉及碳酸钠、碳酸氢钠、碳酸钙的化学性质及用途;复分解反应的定义及发生的条件。
是初中化学教学的重点内容之一。
学生不仅要掌握相关的化学反应,还要会判断化学反应能否发生,以及反应的化学方程式如何书写掇皂扣爆韵膀缮谎厄省舰嗜鸣孕灭搭洗隧字易莉展侣混此顾膀慨拔缴桃骚坎橙吞胖砖韧撑宅瑟浚揉婿姓行荷因柜踊候厕脏瞒壶槽诺馅蒂裸颈炔剩徽【教材分析】本节内容涉及碳酸钠、碳酸氢钠、碳酸钙的化学性质及用途;复分解反应的定义及发生的条件。
是初中化学教学的重点内容之一。
学生不仅要掌握相关的化学反应,还要会判断化学反应能否发生,以及反应的化学方程式如何书写。
初中阶段的四种基本反应类型也在本节课中学习完毕。
所以本节内容是整个初中化学课程中,化学反应内容的一个升华与深化。
生活中常见的盐(第二课时)教学设计生活中常见的盐(第二课时)教学设计【教材分析】本节内容涉及碳酸钠、碳酸氢钠、碳酸钙的化学性质及用途;复分解反应的定义及发生的条件。
是初中化学教学的重点内容之一。
学生不仅要掌握相关的化学反应,还要会判断化学反应能否发生,以及反应的化学方程式如何书写掇皂扣爆韵膀缮谎厄省舰嗜鸣孕灭搭洗隧字易莉展侣混此顾膀慨拔缴桃骚坎橙吞胖砖韧撑宅瑟浚揉婿姓行荷因柜踊候厕脏瞒壶槽诺馅蒂裸颈炔剩徽【学情分析】本节内容是《生活中常见的盐》课题中的第二课时,在第一课时中学生已经掌握了食盐的用途和常见的酸碱盐的溶解性问题。


1第 1 页 第 2 页初 三 年级 化学 科学案 主备: 时间 : 月 日学习内容:十一单元 生活中常见的盐(2)自学收获2.如何检验某固体物质中含有CO 32-?说出所用药品及现象。
3.从下图分析得出复分解反应的微观本质是4.归纳盐的化学性质展示反馈:(勤于动脑,勇敢展示!)1.下列物质的名称 俗称 化学式完全对应的是( ) A.氯化钠 食盐 NaCl 2 B.碳酸氢钠 纯碱 NaHCO 3 C.氢氧化钙 熟石灰 CaO D.氢氧化钠 火碱 NaOH2.固体氢氧化钠长期暴露在空气中会变质,其原因是 (用化学方程式)检验其变质的方法是有关反应的化学方程式为 3.下列说法正确的是( ) A.显碱性的溶液一定是碱溶液B.某固体物质与稀盐酸反应有气泡冒出,则该物质中一定有CO 32-C.两种化合物反应生成另外两种化合物的反应一定是复分解反应D.复分解反应前后各元素的化合价不变。
拓展延伸:(主动思维,更上一层!)1.下列物质间不能发生复分解反应的是( )A.KCl 和稀HNO 3B.NaCl 和AgNO 3溶液C.Ba(NO 3)2和H 2SO 4D.HCl 和AgNO 3溶液 2.在实验室里,小刚想用紫色石蕊试液鉴别稀硫酸 氢氧化钠和纯碱三种无色溶液,请你帮他完成实验。
⑴首先被鉴别出的一种溶液是 依据的现象 是 ⑵利用现有条件将另外两种溶液鉴别出来,写出实验 步骤 现象和结论。
学习目标:了解碳酸钠 碳酸氢钠的俗称 性质及用途 学会CO 32-的检验和鉴别方法重点:复分解反应 难点:复分解反应条件的应用 自主学习:(细心研读,定有收获!)一.自学指导:阅读课本P 70"二 碳酸钠 碳酸氢钠 碳酸钙"了解三种物质的 性质 用途.1.碳酸钠 碳酸氢钠 碳酸钙的用途有哪些?俗称什么?2.碳酸钠 碳酸氢钠 碳酸钙有什么共同的性质?3.预测碳酸钠溶液与澄清石灰水反应有什么现象发生?4.什么叫复分解反应?复分解反应的条件是什么? 二.自学检测:1.碳酸钠俗称 或 ,碳酸氢钠俗称2.列举:碳酸钠的用途 , 碳酸氢钠的用途 , 碳酸钙的用途 .3.试着背写下列化学方程式:实验室制取二氧化碳的反应原理 碳酸钠溶液中滴加稀盐酸 碳酸氢钠溶液中滴加稀盐酸 4.碳酸钠溶液中加入氢氧化钙溶液发生反应的化学方程式为:,实验现象为: 5.下列反应不属于复分解反应的是( )A.HCl+NaOH=NaCl+H 2OB.CuO+H 2SO 4=CuSO 4+H 2OC.CO 2+2NaOH=Na 2CO 3+H 2OD.Na 2CO 3+H 2SO 4=Na 2SO 4+H 2O+CO 2E.CuSO 4+NaOH=Cu(OH)2 +Na 2SO 4小组学习:(积极参与,合作共赢!)活动探究:碳酸钠溶液与稀盐酸 碳酸氢钠溶液与稀盐酸碳酸钠溶液与氢氧化钙溶液1.结合自学检测3题的化学方程式及K 2CO 3+H 2SO 4=K 2SO 4+H 20+CO 2 Na 2CO 3+HNO 3=NaNO 3+H 2O+CO 2 分析这五个化学反应的共同点自学疑问。

1第 1 页 第 2 页初 三 年级 化学 科学案 主备: 时间 月 日学习内容:十一单元 生活中常见的盐(2)自学收获2.如何检验某固体物质中含有CO 32-?说出所用药品及现象。
3.从下图分析得出复分解反应的微观本质是4.归纳盐的化学性质展示反馈:(勤于动脑,勇敢展示!)1.下列物质的名称 俗称 化学式完全对应的是( ) A.氯化钠 食盐 NaCl 2 B.碳酸氢钠 纯碱 NaHCO 3 C.氢氧化钙 熟石灰 CaO D.氢氧化钠 火碱 NaOH2.固体氢氧化钠长期暴露在空气中会变质,其原因是 (用化学方程式)检验其变质的方法是有关反应的化学方程式为 3.下列说法正确的是( ) A.显碱性的溶液一定是碱溶液B.某固体物质与稀盐酸反应有气泡冒出,则该物质中一定有CO 32-C.两种化合物反应生成另外两种化合物的反应一定是复分解反应D.复分解反应前后各元素的化合价不变。
拓展延伸:(主动思维,更上一层!)1.下列物质间不能发生复分解反应的是( )A.KCl 和稀HNO 3B.NaCl 和AgNO 3溶液C.Ba(NO 3)2和H 2SO 4D.HCl 和AgNO 3溶液 2.在实验室里,小刚想用紫色石蕊试液鉴别稀硫酸 氢氧化钠和纯碱三种无色溶液,请你帮他完成实验。
⑴首先被鉴别出的一种溶液是 依据的现象 是 ⑵利用现有条件将另外两种溶液鉴别出来,写出实验 步骤 现象和结论。
学习目标:了解碳酸钠 碳酸氢钠的俗称 性质及用途 学会CO 32-的检验和鉴别方法重点:复分解反应 难点:复分解反应条件的应用 自主学习:(细心研读,定有收获!)一.自学指导:阅读课本P 70"二 碳酸钠 碳酸氢钠 碳酸钙"了解三种物质的 性质 用途.1.碳酸钠 碳酸氢钠 碳酸钙的用途有哪些?俗称什么?2.碳酸钠 碳酸氢钠 碳酸钙有什么共同的性质?3.预测碳酸钠溶液与澄清石灰水反应有什么现象发生?4.什么叫复分解反应?复分解反应的条件是什么? 二.自学检测:1.碳酸钠俗称 或 ,碳酸氢钠俗称2.列举:碳酸钠的用途 , 碳酸氢钠的用途 , 碳酸钙的用途 .3.试着背写下列化学方程式:实验室制取二氧化碳的反应原理 碳酸钠溶液中滴加稀盐酸 碳酸氢钠溶液中滴加稀盐酸 4.碳酸钠溶液中加入氢氧化钙溶液发生反应的化学方程式为:,实验现象为: 5.下列反应不属于复分解反应的是( )A.HCl+NaOH=NaCl+H 2OB.CuO+H 2SO 4=CuSO 4+H 2OC.CO 2+2NaOH=Na 2CO 3+H 2OD.Na 2CO 3+H 2SO 4=Na 2SO 4+H 2O+CO 2E.CuSO 4+NaOH=Cu(OH)2 +Na 2SO 4小组学习:(积极参与,合作共赢!)活动探究:碳酸钠溶液与稀盐酸 碳酸氢钠溶液与稀盐酸碳酸钠溶液与氢氧化钙溶液1.结合自学检测3题的化学方程式及K 2CO 3+H 2SO 4=K 2SO 4+H 20+CO 2 Na 2CO 3+HNO 3=NaNO 3+H 2O+CO 2 分析这五个化学反应的共同点自学疑问。
年级九班级1-10 学科化学课题生活中常见的盐第1课时编制人乔林忠审核人使用时间第周星期使用者课堂流程环节具体内容学法指导一、学习目标学啥我知情【学习目标】1、知道化肥保持及使用时的注意事项。
2、通过实验探究,初步学会区分氮肥,磷肥,钾肥的方法。
【学习重难点】区分氮肥,磷肥,钾肥的方法。
请把关键词标出来重点难点我知晓二、自主学习、温故能知新二、自学新课1.交流自学内容,形成共识。
(以小组为单位)2.归纳出实验步骤或方案。
、、、。
3.探讨实验中应注意的问题。
4.熟悉实验药品和仪器,准备开始试验。
自神木县第五中学导学案独学、对学、群学主、合作、探究三、化肥的简易鉴别(实验探究)1,比较氮肥(氯化铵、碳酸氢铵)、磷肥(过磷酸钙)和钾肥(硫酸钾、氯化钾)的外观、气味和在水中的溶解性,,归纳出它们的性质。
2,完成表格氮肥磷肥钾肥碳酸氢铵氯化铵过磷酸钙硫酸钾氯化钾外观气味溶解性通过表格,我会总结:__________________________________________ ______________________________________________________________ _____________________________________________________________.三、展示交流展示我精彩3,氮肥和钾肥的区分取研细的氮肥(氯化铵)、钾肥(氯化钾)各少量,分别加入少量熟石灰粉末,混合、研磨,能否嗅到气味?氮肥钾肥碳酸氢铵氯化铵硫酸钾氯化钾加熟石灰研磨联系实际:铵盐不能与物质混放或混用,以免降低肥效。
根据上述实验,归纳出初步区分氮肥、磷肥、钾肥的方法:四、点拨升华点拨我升华知识我总结1、下列化肥中,从外观即可与其他化肥相区别的是()A 硫酸钾B 硝酸铵C 磷矿粉D 氯化钾2、取下列化肥与熟石灰粉末混合,研磨后,能闻到刺激性气味的是()A.氯化钾B.碳酸钾C.硫酸铵D.磷酸钙3、氮肥、磷肥、钾肥是农业生产中最主要的化肥,用简便方法区别三种化肥,在农业生产中具有实用性。
常见的盐一、知识点知识点1、生活中常见的盐1.生活中常见的盐:有氯化钠、碳酸钠、碳酸氢钠、碳酸钙等。
亚硝酸钠(NaNO2)是一种工业用盐,外观和食盐相似,有毒。
2.粗盐提纯的主要步骤:溶解、过滤、蒸发。
3.碳酸根离子的检验:含CO32-(HCO3-)的化合物,遇到酸会反应放出能使澄清的石灰水变浑浊的二氧化碳气体。
利用此反应可以检验盐的组成中是否含有CO32-离子(或HCO3-)。
【要点诠释】1.组成里含有碳酸根离子的盐统称为碳酸盐,如Na2CO3、K2CO3、BaCO3、CaCO3等,它们与盐酸反应都会生成使澄清石灰水变浑浊的二氧化碳气体。
2.含有碳酸根离子的盐和某些物质反应生成不溶于水的固体,这一类反应有时也可以用来鉴别碳酸盐。
例如:Na2CO3 + Ca(OH)2=CaCO3↓+ 2NaOH知识点2、复分解反应发生的条件复分解反应发生的条件:当两种化合物互相交换成分,生成物中有沉淀或有气体或有水生成时,复分解反应才可以发生。
【要点诠释】1.复分解反应属于基本反应类型,其特点为AB+CD=AD+CB。
2.复分解反应发生的三个条件中,只要具备其中一个,反应就可以进行,不必三个条件都具备。
知识点3、盐的化学性质不同种类的盐其化学性质也有所不同。
对于其共性总结如下表所示:盐与酸反应、盐与碱反应、盐与盐反应都属于复分解反应,盐与金属反应属于置换反应。
二、精选练习题知识点1 生活中常见的盐【典例】1.用符合要求的物质的序号填空。
①氯化钠②小苏打③二氧化碳④熟石灰(1)可用于治疗胃酸过多的是。
(2)可用于改良酸性土壤的是。
2.在河边有A、B、C、D四家工厂向河中排放废水,每个工厂的废水中含有NaOH、HCl、MgCl2、Na2CO3四种物质中的一种.某中学环保小组对该河流的污染状况进行检测,发现:A处河水能使紫色石蕊试液变蓝色;F处河水出现白色浑浊;E处河水有大量气泡产生.试推断:(1)A工厂排放的废水中含有的污染物是;(2)C工厂排放的废水中含有的污染物是;(3)E处发生反应的化学方程式为:.【变式训练】1.服用可溶性的钡盐可使人中毒.医疗水用X射线检查胃肠疾病时,可作为“钡餐”让病人服用的是()A.BaCl2B.Ba(OH)2C.BaCO3D.BaSO42.酸、碱、盐在工农业生产和日常生活中应用广泛.下列做法错误的是()A.用石灰乳与硫酸铜溶液配制农药波尔多液B.用稀盐酸除去铁制品表面的铁锈C.用食盐水除去水壶中的水垢D.用NaOH溶液洗涤石油产品中残留的硫酸3.下列物质俗称小苏打的是()A.碳酸钠B.碳酸氢钠C.氢氧化钠D.硫酸钠4.食盐、食醋、纯碱均是家庭厨房中常用的物质,利用这些物质,我能够完成的实验是()①检验自来水中是否含有氯离子;②除去热水瓶中的水垢;③区分食盐和纯碱;④检验鸡蛋壳中是否含有碳酸盐。
龙岭学校九年级化学(下)导学稿(45) 2014-2015学年度第一学期§11.1生活中常见的盐(第2课时)执笔:袁桂芳审核: 课型:新授时间:【学习目标】1、了解盐的性质,了解复分解反应的条件2、学会使用“部分酸碱盐的溶解性表”【学习重点】复分解反应的条件【学习难点】复分解反应的条件【学习过程】【预习自学】一、盐的性质1.盐的溶解性:盐可分为__溶性盐和__溶性盐,各种盐的溶解性见P154页溶解性表。
由表可知__盐、__盐、__盐和___盐均易溶于水,常见的不溶性盐有硫酸盐中的____、盐酸盐中的___和大部分的_____盐。
2.复分解反应——由于____互相交换成分生成新_____的反应。
⑴是否任何的化合物混合在一起都可以发生复分解反应?____复分解反应发生的条件:生成物中有____或____或___生成。
⑵中和反应是指__跟__作用生成盐和水的反应,中和反应是否属于复分解反应?________________【交流展示】3.盐的化学性质:⑴盐与酸反应写出下列反应的化学方程式:CaCO3+ HCl=________AgNO3+ HCl=________BaCl2+ H2SO4=________【归纳】盐+酸→___+___反应发生的条件:生成物中有__、___或___。
⑵盐与碱反应写出下列反应的化学方程式:FeCl3+ NaOH=________CuSO4+ NaOH=________Na2CO3+Ca(OH)2=_______【归纳】盐+碱→___+___反应发生的条件:反应物均__溶,生成物中有___。
⑶盐与盐反应在盛有Na2CO3溶液的试管里加入CaCl2溶液,可看到有_____产生,方程式:Na2CO3+CaCl2=______写出下列反应的化学方程式:AgNO3+ NaCl=________BaCl2+ Na2SO4=________【归纳】盐+盐→___+___反应发生的条件:反应物均__溶,生成物中有___。