羧酸衍生物
- 格式:doc
- 大小:609.50 KB
- 文档页数:14



羧酸衍生物知识点羧酸衍生物是一类化合物,它们在化学反应和有机合成中有着广泛的应用。
羧酸衍生物的结构中包含一个羧酸基团,它们的化学性质也与羧酸有关。
本文将从羧酸衍生物的性质、合成和应用三个方面进行阐述。
一、羧酸衍生物的性质羧酸衍生物中含有一个羧酸基团(-COOH),这个基团可以参与许多化学反应。
例如,在碱性条件下,羧酸基团会失去一个质子,形成相应的负离子,即羧酸盐,这种反应叫做羧化反应。
除此之外,羧酸衍生物还能与醇、胺等反应,生成相应的酯、酰胺等衍生物。
二、羧酸衍生物的合成羧酸衍生物的合成方法非常多,下面介绍两种常用的方法:1.羧化反应羧化反应是一种重要的合成羧酸衍生物的方法。
在这种反应中,通常使用羧酸和一定量的碱反应,生成相应的羧酸盐。
羧酸盐再与酸反应,失去一个水分子,形成相应的酯。
这种反应常用的催化剂有酸性离子交换树脂、三氧化硫等。
2.加成反应加成反应是另一种合成羧酸衍生物的方法。
在这种反应中,羧酸衍生物的反应物通常是烯烃或炔烃。
它们与羧酸在催化剂的存在下发生加成反应,生成相应的羧酸衍生物。
加成反应的催化剂有酸性离子交换树脂、钯等。
三、羧酸衍生物的应用羧酸衍生物在有机合成、材料科学、生物化学等领域有着广泛的应用。
1.有机合成羧酸衍生物是有机合成中常用的反应物和中间体。
它们可以通过羧化反应、加成反应等多种方法进行合成。
羧酸衍生物可以与醇、胺等反应,生成相应的酯、酰胺等衍生物。
2.材料科学羧酸衍生物可以与金属离子、聚合物等反应,形成新的材料。
例如,聚丙烯酸可以与铁离子反应,生成Fe3O4/聚丙烯酸复合材料。
这种材料具有磁性,可以应用于磁性材料、制备催化剂等领域。
3.生物化学羧酸衍生物在生物化学中也有着重要的应用。
例如,羧酸基团是许多生物分子的一部分,例如脂肪酸、氨基酸等。
羧酸衍生物还可以用于制备生物活性分子,例如药物、抗生素等。
羧酸衍生物是一类重要的化合物,在化学反应和有机合成中有着广泛的应用。
通过羧化反应、加成反应等方法可以合成羧酸衍生物。

羧酸的衍生物知识点总结一、羧酸的结构及性质1.1 结构羧酸是一类含有一个或多个羧基(-COOH)官能团的有机化合物。
在羧酸中,羧基结构可以与芳香环或脂肪烃环相连,也可以存在于分子中的其他位置。
羧酸的基本结构可以表示为R-COOH,其中R代表羧基所连接的有机基团。
1.2 性质羧酸的结构使其具有一系列特定的物理化学性质。
常见的羧酸通常以无色或白色晶体的形式存在,有时也呈液态。
它们在水中易溶解,并能够与碱反应生成相应的盐,因此具有一定的酸性。
此外,羧酸还表现出一些特定的化学反应活性,如酯化反应、醛化反应等。
1.3 羧酸的共振结构羧酸分子中的羧基(-COOH)可以发生共振结构,即通过π电子的转移,使得羧基中碳与氧之间的键产生双键和单键的交替存在。
这种共振结构的存在使得羧酸分子更加稳定,同时也对其化学性质产生影响。
二、羧酸的主要衍生物类型2.1 酯酯是由羧酸和醇经酯化反应生成的产物。
在这种反应中,羧基上的氧原子与醇中的羟基发生酯键结合,形成一种新的有机化合物。
酯具有独特的香味,因此广泛用于食品、香精等行业。
2.2 醛醛是由羧酸通过脱羧反应生成的产物。
在脱羧反应中,羧酸失去一个CO2分子,生成相应的醛。
醛化反应是一种重要的有机合成反应,广泛应用于制备醇、醚等化合物。
2.3 酰胺酰胺是由羧酸与氨或胺反应生成的产物,它是一类重要的有机化合物。
酰胺在生物体内起着重要的生物活性作用,同时也广泛应用于有机合成领域。
2.4 酰氯酰氯是由羧酸与氯化亚砜、硫酰氯等发生酰化反应生成的一种有机化合物。
酰氯是一类重要的有机合成试剂,广泛用于有机化学合成反应中。
2.5 醛酸醛酸是羧酸分子失去一个羧基而形成的产物,它在有机合成及医药领域有着重要的应用价值。
醛酸可以被还原成相应的醇,也可以通过酰化反应生成酯等化合物。
2.6 酰胺酰胺是由羧酸与胺类化合物经过缩合生成的有机化合物,它在生物体内发挥着重要的生理活性作用。
在有机合成中,酰胺也是一类重要的合成中间体。



羧酸衍生物羧酸衍生物是有机化学中最重要的一类化合物,这类化合物由羧酸和其衍生物组成,它们在医药及其他领域有着广泛的应用,是有机化学研究的主要焦点之一。
羧酸衍生物是由羧酸分子和其他不同化学结构的分子组合形成的有机化合物。
羧酸是一种具有一个羧基及以上的有机酸,按照水溶性的大小分为酒精型,醇型,酸型和碱型。
羧酸衍生物的其他分子可以是碳氢化合物、不饱和烃、烃类、碳氮化合物、醛类、酮类等等。
一般来说,羧酸衍生物具有很强的湿润性、高抗蚀性和良好的抗氧化性,可以用于改善纤维素,提高其物理性能以及防止其被氧化老化。
它也具有解吸性能,能够有效溶解纤维素结构,增强其耐受性和抗水性,从而改善纤维素的物理性质。
羧酸衍生物也可以用于保护植物,制备植物类医药剂,减少植物的损害,如光及抗盐的胁迫,从而促进植物的发育健康。
羧酸衍生物还可以用于制备多种医药产品,具有良好的药性,可以用来治疗各种疾病。
它们可以作为抗生素使用,增强机体免疫力,杀灭病原体,防止病原体的复制,从而有效治疗感染性疾病。
此外,它们还可以作为抗炎药使用,降低炎症的发生,减少肿痛,缓解疼痛,从而抑制肿瘤细胞的生长。
羧酸衍生物还可以用于制备抗癌药,有效抑制癌细胞的增殖,降低肿瘤恶化等。
羧酸衍生物还可以用于制造日常用品,如洗发水、洗衣液等。
由于其良好的抗菌性和卫生性,羧酸衍生物可以有效杀灭污染源,减少细菌的滋生,从而维护卫生,保护人们的健康。
羧酸衍生物的应用由于其独特的性质而受到广泛的重视,在有机化学研究中有着重要的地位,经过长期的研究,学者们发现它们具有多种重要的功能,在不同的领域都能发挥重要作用。
未来,羧酸衍生物将在药物研究中发挥更为重要的作用,为人类的健康和生命贡献更多。
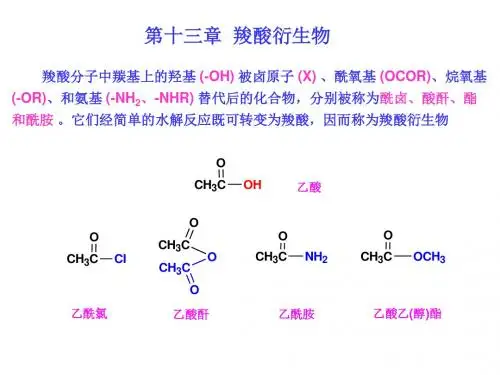
第十三章羧酸衍生物一、基本内容1.定义与分类羧酸分子中羧基上的羟基被其他原子或原子团取代后生成的化合物称为羧酸衍生物,羧酸衍生物包括酰卤、酸酐、酯、酰胺和腈,除腈以外,都含有酰基。
本章重点讨论重要的羧酸衍生物—酰卤、酸酐、酯和酰胺。
酰卤是羧酸分子中的羟基被卤原子取代后的生成物,其通式为RCOX,X为卤原子(F、Cl、Br、I)。
酸酐是两个羧酸分子间脱水后的生成物,酸酐的通式为(RCO)2O。
两个相同的羧酸分子脱水后生成单纯的酸酐(R相同),两个不同的羧酸分子脱水后生成混酐(R 不相同),羧酸还可以与另一分子的无机酸脱水而成混酐,某些二元羧酸后生成环状的酸酐,如邻苯二甲酸酐。
酯可分为有机酸酯和无机酸酯两种,前者如硫酸氢乙酯和三硝酸甘油酯。
有机酸酯中的羧酸酯是羧酸和醇的脱水产物,其通式可表示为RCO2R′。
酰胺为羧酸分子中的羟基被氨基或胺基(-NHR,-NR2)取代后的生成物,酰胺的通式为RCONR′R″(R′R″为氢、烃基或其他取代基)。
2.反应羧酸衍生物是一类重要的有机合成原料或有机合成中间体,在有机合成中起着重要的作用。
其主要反应有亲核取代反应(包括水解、醇解、氨解、酸解、与有机金属化合物的反应)、还原(Rosenmund还原,Bouveault-Blanc还原和LiAlH4还原等)及它们各自的特殊反应(霍夫曼降解、克莱森酯缩合,里特反应等)。
羧酸衍生物的亲核取代反应是分两步进行:第一步先加成,形成一个四面体中间体;第二步发生消去,转变成另一个羧酸衍生物。
一般来说,总反应速率和这两步反应速率都有关,但第一步更为重要。
第一步四面体中间体形成的影响因素:吸电子作用有利于反应,因为它使负电荷稳定;大体积基团存在由于位阻效应会阻碍反应进行。
第二步反应取决于离去基团的碱性,碱性越弱的基团愈容易离去,因而羧酸衍生物反应活性次序为:酰卤>酸酐>酯~羧酸>酰胺。
3.羧酸衍生物在有机合成中的应用本章主要阐述乙酰乙酸乙酯和丙二酸二乙酯在有机合成中的应用。
羧酸的四大衍生物
羧酸的四大衍生物
羧酸是一类含有羧基(-COOH)的有机化合物,可作为各种化学反应
的重要中间体。
羧酸有多种衍生物,其中最常见的是如下四种。
一、酰氯(Acyl chloride)
酰氯是羧酸最常见的反应产物,它可以通过将羧酸与氯化物反应制得。
酰氯是一个非常重要的中间体,可用于合成酯、醚、酰胺等多种化合物。
酰氯有弱腐蚀性,可多用于有机合成实验室中。
二、酐(Anhydride)
酐是两个羧酸分子缩合而成的产物,分为内酐和外酐两种。
内酐是指
两个羧基在同一分子内缩合而成的环状产物,外酐则是指两个羧基不
在同一分子内缩合而成的非环状产物。
酐也可作为中间体用于合成酯、酰胺等化合物。
三、酸酐(Acid anhydride)
酸酐是两个不同羧酸分子缩合而成的产物,以其极强的反应性而闻名。
酸酐可用于合成酸酐酯、酸酰胺、酸酐酸等化合物。
但由于其极易水解,因此在使用过程中需要特别注意。
四、酯(Ester)
酯是羧酸的一种重要衍生物,它由羧酸和醇反应而成。
酯具有良好的挥发性和揮發性,并可用于制备香精、香料、油漆等多种化合物。
酯也可作为用于制硝化纤维、炸药等的重要中间体。
在有机合成中,酰氯、酐、酸酐和酯均属于常见的重要中间体。
它们在不同条件下均可相互转化,因此在尝试合成某种化合物时,应根据需要灵活选择相应的羧酸衍生物。
第十三章羧酸衍生物一、基本内容1.定义与分类羧酸分子中羧基上的羟基被其他原子或原子团取代后生成的化合物称为羧酸衍生物,羧酸衍生物包括酰卤、酸酐、酯、酰胺和腈,除腈以外,都含有酰基。
本章重点讨论重要的羧酸衍生物—酰卤、酸酐、酯和酰胺。
酰卤是羧酸分子中的羟基被卤原子取代后的生成物,其通式为RCOX,X为卤原子(F、Cl、Br、I)。
酸酐是两个羧酸分子间脱水后的生成物,酸酐的通式为(RCO)2O。
两个相同的羧酸分子脱水后生成单纯的酸酐(R相同),两个不同的羧酸分子脱水后生成混酐(R 不相同),羧酸还可以与另一分子的无机酸脱水而成混酐,某些二元羧酸后生成环状的酸酐,如邻苯二甲酸酐。
酯可分为有机酸酯和无机酸酯两种,前者如硫酸氢乙酯和三硝酸甘油酯。
有机酸酯中的羧酸酯是羧酸和醇的脱水产物,其通式可表示为RCO2R′。
酰胺为羧酸分子中的羟基被氨基或胺基(-NHR,-NR)取代后的生成物,酰胺的通式为RCONR′R″2(R′R″为氢、烃基或其他取代基)。
2.反应羧酸衍生物是一类重要的有机合成原料或有机合成中间体,在有机合成中起着重要的作用。
其主要反应有亲核取代反应(包括水解、醇解、氨解、酸解、与有机金属化合物的反应)、还原(Rosenmund还原,Bouveault-Blanc还原和LiAlH4还原等)及它们各自的特殊反应(霍夫曼降解、克莱森酯缩合,里特反应等)。
羧酸衍生物的亲核取代反应是分两步进行:第一步先加成,形成一个四面体中间体;第二步发生消去,转变成另一个羧酸衍生物。
一般来说,总反应速率和这两步反应速率都有关,但第一步更为重要。
第一步四面体中间体形成的影响因素:吸电子作用有利于反应,因为它使负电荷稳定;大体积基团存在由于位阻效应会阻碍反应进行。
第二步反应取决于离去基团的碱性,碱性越弱的基团愈容易离去,因而羧酸衍生物反应活性次序为:酰卤>酸酐>酯~羧酸>酰胺。
3.羧酸衍生物在有机合成中的应用本章主要阐述乙酰乙酸乙酯和丙二酸二乙酯在有机合成中的应用。
乙酰乙酸乙酯和丙二酸二乙酯中,由于相邻两个吸电子基团使中间的亚甲基酸性加强,与碱作用生成碳负离子,可以发生亲核反应,使它们在有机合成上占重要的地位。
乙酰乙酸乙酯的应用:(1)合成甲基酮;(2)合成酮酸。
丙二酸二乙酯:(1)合成一元羧酸;(2)合成二元羧酸。
二.重点与难点评述本章的重点是羧酸衍生物中羰基上的亲核取代反应和亲核取代反应历程(特别是酯的水解反应历程)、羧酸衍生物在有机合成中的应用和几个重要的有机人名反应等。
难点是对不同结构的羧酸衍生物中羰基上的亲核取代反应历程的理解。
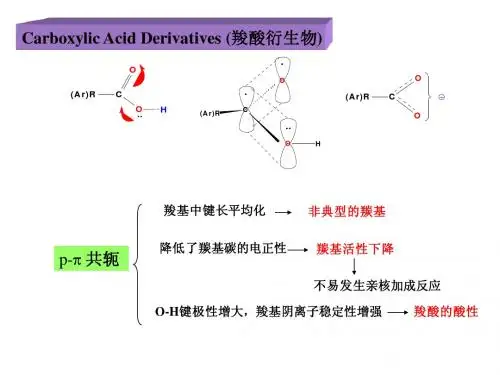
1.结构与反应活性羧酸衍生物中除了腈以外,都含有酰基。
由于羰基的存在,就决定了这些化合物的特征活性,这是了解羧酸衍生物化学性质的关键。
羧酸衍生物羰基碳原子直接相连的原子(O,N,Cl )上都有孤电子对,它与羰基上的π电子共轭,它们的结构式最好用共振式表示。
对于酰氯,氯具有较强的吸电子诱导效应和较弱的供电子的共轭效应,使羰基的正电性增强,有利于亲核试剂的进攻,同时,Cl -碱性较弱,即稳定性较高,易于离去,因此酰氯表现出很大的反应活性。
相反,对酰胺来说,氨基的吸电子诱导效应较弱,而供电子的共轭效应很强,不有利于亲核试剂的进攻,同时,NH 2-碱性较强,即稳定性较差,难于离去,因此酰胺表现出较小的反应活性。
不难得出,羧酸衍生物的亲核取代(加成-消去)反应活性次序为:RCOCl > (RCO)2O > RCO 2R ′> RCONH 22. 羰基上的亲核取代(加成—消去)反应历程羧酸衍生物的亲核取代(加成-消去)反应一般分为两步,首先是亲核试剂进攻羰基碳原子,发生亲核加成反应,形成一个带负电荷的四面体中间体。
然后,中间体消去一个负离子,恢复碳-氧双键,形成另一个羧酸衍生物。
Nu(亲核试剂) = H 2O 、ROH 、NH 3等 Z ˉ(离去基团) =―X 、―OR 、―OCOR 、―NH 2等3. 羧酸衍生物的水解反应历程羧酸衍生物可被水、醇、氨等亲核试剂进攻,其中酯的水解历程研究得最多。
因此,本章主要对酯的酸催化和碱催化水解历程进行讨论。
酯的水解是酯化反应的逆反应,水解时可能是酰氧键断裂,也可能是烷-氧键断裂;每种断裂方式都可按单分子或双分子历程进行,所以有四种可能的历程。
同样碱性水解也有四种可能历程。
这八种酯水解机理中,以酯的酸性(A Ac 2)或碱性(B Ac 2)水解双分子酰氧键断裂最为常见,以(B Ac 2)为例作一说明。
由于四面体中间体具有负电荷,同时比较拥挤,酯的碱性水解将受极性和立体效应的影响。
当酯的酰基上连有吸电子基时,将加速反应的进行,且随其吸电能力的增强,反应速度增大。
值得注意的是,若酯的水解能生成稳定的碳正离子,则有利于单分子烷-氧键断裂。
4. 几个重要的有机人名反应1. Rosenmund 反应R+C RZRO ZNuCR CO OR'OH -R+++RCO 2H RO -R CO 2-ROH2. Bouveault-Blanc 反应 3. Baeyer-Villiger 氧化不对称酮用过酸氧化,在重排步骤中,两个烃基都可能迁移,烃基迁移的近似次序为:H>叔烷基>仲烷基,苯>伯烷基>甲基。
4. Ritter 反应在强酸性溶液中,由叔醇生成的碳正离子同质子一样,可以进攻氰基氮原子,生成的正离子迅速加水,转变为N-烃基取代酰胺,水解后生成胺:5. Claisen 缩合6. Dieckmann 缩合7.Reformatsky 反应8.Perkin 反应9.Knoevenagel 缩合10.Hofmann 重排RCOClH 25%Pd/BaSORCHO HCl++(g)RCOOR'+25RCH 2OH R'OH+OCOOHO OOCOOHClCl++EtOOC (CH 2)4COOEtEtOHOCOOEtO BrCH 2COOEtOH CH 2COOEt+ZnH 3O++PhCHO(CH 3CO)2OKOAcPh COOH+PhCHOCH 2(COOEt)2C H NPhCH CH(COOEt)22CH 3CO 2Et()NaOEt,EtOH 2322CH 3COCH 2CO 2EtEtOH+RCONH 22RNH 2(CH 3)3COH H +-2(CH 3)3C +RC NC(CH 3)3+2+R C NC(CH 3)3OHRC ONHC(CH 3)3RCO 2H(CH 3)3CNH 2+2+在Hofmann 重排中,迁移的烃基的构型保持不变。
三、 精选题及其解13-1.在一个含有醋酸、丁醇、水、硫酸和醋酸丁酯的混合物中,如何提纯醋酸丁酯? 解 将混合物蒸馏,去除硫酸,加入饱和的碳酸钠溶液洗涤,分液去除醋酸,有机相加入饱和氯化钙溶液,使酯游离出来,分液、干燥、蒸馏得纯的醋酸丁酯。
13-2.写出下列反应或反应系列的主要有机产物。
CH 3CH 2CH 2COOHCH 3OH +ACH 3MgBr3+BCH 3COCH 2COOEt22ACH 3IEtONa/EtOHB(1)OH -/H 2O (2)H 3O +,CCH 2COOEt CH 2COOEtEtONaA(1)OH -/H 2O (2)H 3O ,BC22CH 3H 6H 5C 6H 5OOLiAlH 47.8.9.10.11.COOCH 34Et 2OA+B+COOH2A3B2-CH 3CH 2CH 2OH 3A500CBC+CONH2H 2NCH 2CO 2H12(2)C 2H 5OHCH 3CH 2CH 2COOH(CH )NH 1.2.3.4.5.6.CO65312.OOPhCH 3NH 213.解16.N OH()LiAlH (2)H 3O CN65252H 3O +17.18.CH 3CH 2COOC 2H 5AB+19.CH 3OCOCH 2CH 2COCl20.C 6H 5COCH 3ClCH 2CO 2EtNaOEt+CH 2OH A B CH 3OH 1.COClCONH 2NH 2ABC2.A CH 3CH 2CH 2OCCH 3OBCH 3CH CH 2C CH 3COOHCH 3CH 2CH 2CON(CH 3)24.5.H 2NCH 2CO 2CH 2CH 3.HCl6.CH 3CH 2CH 2CO 2CH 3CH 3CH 2CH 2C(CH 3)2OH7.AB8.OOCOOEtCOOEtOOCOOEt COOEtABCOOCH 2CH 2CO 2C 2H 52CH 2CO 2C 2H 5NaOC H 5C 2H 5OH14.15.OHCO 2H3NaOHOOPhCOCH 2CONHCH 3CO 2C 2H 5OOCOCH 3CO 2-N H12.13.14.15.16.C 6H 5O17.18.A CH 3CH 2CH 2OH BC 2H 5OHOO 2C 2H 59.ABCOHHC 6H 5DC 6H 510.11.13-3.甲基环己基酮在三氯甲烷中用过氧苯甲酸在25℃处理16小时,从反应混合物中得到化合物A,A 的部分光谱数据如下:IR :1740,1250cm -1有吸收;1HNMR:δ2.0(s,3H),4.0(m,1H);MS :m/z M +142, 最强峰43。
求A 的结构并推测该反应的反应机理。
解 从反应条件可知该反应为Baeyer-Villiger 氧化反应。
IR :1740cm -1为羰基的红外吸收;1HNMR:δ2.0(s,3H,CH 3CO-),4.0(m,1H,-O-CH=);MS :m/z M + 142,即A 的分子量,最强峰43为CH 3C ≡O +碎片吸收。
由此可知,A 的结构为:该反应的反应机理:13-4.由丙二酸二乙酯合成下列化合物;(1)庚二酸 (2)3-甲基丁酸 (3)环丁基甲酸 (4)2-苄基丁酸解13-5.由乙醇为原料经乙酰乙酸乙酯合成:(1)3-乙基-2-戊酮,(2)2,5-己二酮,(3)2-甲基-4-戊酮酸。
解CH 3C OOCH 3CO +CH+C OHO O CC 6H 53O+CH 3C O O HC H CO -H +CH 3C OO (EtOCO)2CH(CH 2)3CH(COOEt)(HO 2C)2CH(CH 2)3CH(CO 2H)2EtOH EtONa(2) CH 2(COOC 2H 5)232(CH 3)2CHCH(COOEt)2(CH 3)2CHCH(CO 2H)T.M.T.M.(3) CH 2(CO 2Et)2EtONaBr(CH 2)3BrCO 2EtCO 2Et (2)HCl1(2)H Cl(1)N aOH (2)HCl(1)NaOH T.M.EtOHEtONa (4) CH 2(COOC 2H 5)2Br(CH 2)3BrEtOHEtONa (1) CH 2(COOC 2H 5)2CH 3CH 2ClCH 3CH 2CH(CO 2Et)2EtONa EtOH652C 6H 5CH 22Et)2C 2H 51(2)HClT.M.CH 3OCOCH 2CH 2CHO 19.20.C O2EtCH 3C 6H 513-6.反应机理解释: 1.反应速度(1)》(2),解释为什么? 2.反应(1)和(2)中的平衡混合物各以什么占优势,并解释为什么? 解 1. 反应式(1)中反应物之-OCOPh 基团处于直立键,与离去基团-Ots 处于反式位置,它很容易起邻基参与作用促使-OTs 迅速离去,反应速度很快;而反应式(2)中,反应物中-OCOPh 与离去基团-OTs 处于顺式,难起邻基参与作用。