羧酸及其衍生物的化学性质
- 格式:ppt
- 大小:359.50 KB
- 文档页数:19

第十章羧酸及其衍生物【教学重点】羧酸及其衍生物的化学性质、丙二酸二乙酯和乙酰乙酸乙酯在合成上的应用。
【教学难点】诱导效应、酰基上的亲核取代反应机理。
【教学基本内容】羧酸的结构;羧酸的制备方法;羧酸及其衍生物的物理性质;羧酸的化学性质——羧酸的酸性及影响酸性强度的因素(诱导效应、共轭效应和场效应);羧酸衍生物的生成;羧基的还原反应;脱羧反应;α-氢原子的卤代反应。
羟基酸的制备方法(卤代酸水解、羟基腈水解、Refomatsky反应)、羟基酸的化学性质——酸性、脱水反应、α-羟基酸的分解。
羧酸衍生物的化学性质——酰基上的亲核取代反应(水解、醇解、氨解)及其反应机理;还原反应;与Grignard反应;酰胺氮原子上的反应(酰胺的酸碱性、脱水反应、Hofmann降解反应)。
乙酰乙酸乙酯的制备方法(Claisen酯缩合);乙酰乙酸乙酯的化学性质——酮式-烯醇式互变异构、酸式分解和酮式分解;乙酰乙酸乙酯在合成上的应用。
丙二酸二乙酯的制备及在合成上的应用。
Ⅰ目的要求羧酸是含有羧基(—COOH)的含氧有机化合物,我们平常所说的有机酸就是指的这类化合物。
所谓羧酸衍生物,包括的化合物种类很多,诸如羧酸盐类、酰卤类、酯类(包括内酯、交酯、聚酯等)、酸酐类、酰胺类(包括酰亚胺、内酰胺)等都是羧酸衍生物,有人甚至把腈类也包括在羧酸衍生物的范围之内。
其实,比较常见的而又比较重要的是酰卤、酸酐、酯和酰胺这四类化合物。
羧酸盐与一般无机酸盐在键价类型上没大区别,不作专门介绍。
至于腈类,将放在含氮化合物中加以介绍。
这四类化合物都是羧酸分子中,因酰基转移而产生的衍生物,所以又叫羧酸的酰基衍生物。
羧酸及其衍生物RCOL(L:-OH、-X、-OOCR′、-OR′、-NH2)在许多重要天然产物的构成以及在生物代谢过程中均占有重要地位。
本章将以饱和一元脂肪酸为重点,讨论羧酸及其衍生物的结构和性质。
鉴于乙酰乙酸乙酯和丙二酸二乙酯在有机合成上的重要地位,本章作概括介绍。



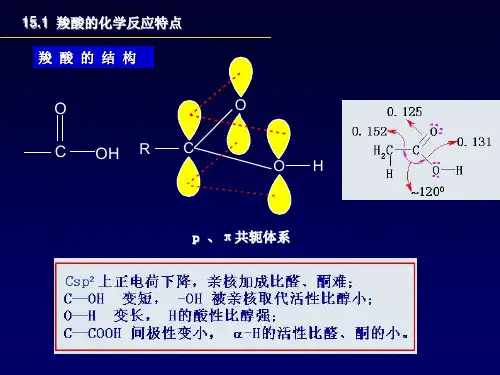
第十一章羧酸及其衍生物的结构与性质引言羧基()是羧酸的官能团,是由羰基和羟基组成的。
由于羰基的碳氧双键与羟基氧原子的共轭效应的作用,使羟基中氧原子电子向羰基转移,羟基的氢易离解而显酸性。
羧基中羟基也能被其它基团取代生成羧酸衍生物。
羧基是吸电子基,α-H具有活性,可以被卤代。
此外羧酸还能被还原和发生脱羧反应。
这里所讨论的羧酸衍生物主要是指羧基中羟基被取代后生成的酰卤(),酸酐(),酯(),酰胺()以及由酰胺脱水后生成的产物腈()。
在羧酸衍生物中羰基与卤素,酰胺基,烷氧基和氨基相连,由于卤素,氧原子和氮原子的负电性以及孤对电子的作用,使羰基碳上正电性不同,因此它们发生亲核反应性质也有差别。
羧酸衍生物还能发生还原反应。
11.1 羧酸的酸性羧酸是弱酸,能与强碱反应生成盐:羧酸酸性的强弱与所连的基团有关,连吸电子基团的羧酸酸性较强,而连供电子基团的酸性相对较弱。
如下列化合物酸性强弱顺序为:11.2 羧酸衍生物的生成羧基中的羟基被卤素、酰胺基、烷氧基和氨基取代形成酰卤、酸酐、酯和酰胺等羧酸衍生物。
1、酰卤的形成羧酸与SO2Cl,PCl5,PCl3等氯化剂直接反应生成酰卤:因为POCl3沸点低易除去,此法可制备高沸点的酰氯。
H3PO3沸点高,可制备低沸点的酰氯。
该法产生的SO2,HCl易除去,因此生成的酰氯纯度高,后处理容易。
2、酸酐的形成羧酸在脱水剂(如乙酰氯、乙酸酐)存在下加热,失去一分子水而生成酸酐。
二元酸可以分子内脱水生成二酸酐:3、酯化反应羧酸和醇在催化剂(H2SO4、HCl或苯磺酸等)作用下回流生成酯:酯化反应由多种机理,在大多数情况下,是羧酸中羟基与醇中羟基氢结合生成水,表观上看是一种亲核取代反应,实际上是一个亲核加成-消除反应的机理:决定反应速度的一步是亲核加成,因此羧基中碳的正电性以及羧基所连的基团大小核亲核试剂R'OH中R'体积大小都影响反应的速度,下列羧酸与甲醇酯化反应的相对速度的快慢顺序为:4、形成酰胺的反应羧酸与氨立即反应生成盐,在加热条件下,脱水生成酰胺,生成酰胺的反应是可逆的,如果把生成的水从反应体系中除去,反应可趋于完全。


实验19 羧酸及羧酸衍生物的性质1.实验目的(1)了解羧酸衍生物的水解反应;(2)了解羧酸的酯化反应及其衍生物的醇解反应;(3)了解羧酸衍生物与盐酸羟胺生成异羟肟酸的反应。
2.实验原理羧酸可与醇反应生成酯。
羧酸衍生物与H2O、醇等发生水解、醇解等反应,生成羧酸及相应产物。
他们的反应活性次序为:酰卤>酸酐>酯>酰胺,故水解和醇解的反应条件均有较大差异。
通过本实验可考察羧酸成酯反应情况和羧酸衍生物水解、醇解的产物及其反应活性。
3.仪器与试剂仪器:试管,试管夹,酒精灯,石绵铁丝网,量筒,滴管,烧杯,表面皿。
试剂:乙酰氯(CH3COCl),2%AgNO3,乙酐(CH3COOCOCH3),6mol·L-1H2SO4,浓H2SO4,6mol·L-1NaOH,乙酰胺(CH3CONH2),C2H5OH,饱和Na2CO3,0.5 mol·L-1盐酸羧胺乙醇溶液,5%HCl,1%FeCl3,蒸馏水,冰醋酸。
4.实验内容(1)羧酸衍生物与水的反应①乙酰氯与水的作用在试管中加入1mL蒸馏水,加3滴乙酰氯,轻轻摇动。
观察现象。
让试管冷却,加入1~2滴2%AgNO3溶液,观察现象。
②乙酐与水的作用在试管中加入1mL蒸馏水,加3滴乙酐。
乙酐不溶于水,呈珠粒状沉于管底。
把试管略微加热,乙酐与水作用,观察现象。
③乙酸乙酯的水解在3支试管中各加1mL乙酸乙酯和1mL水。
然后在1支试管中加1mL 6 mol·L-1H2SO4,在另1支试管中加1mL 6 mol·L-1NaOH溶液。
把3支试管同时放入70~80℃的水浴中,一边摇动,一边观察,比较3支试管中酯层消失的速度。
④酰胺的水解a.碱性水解在试管中加入0.5g乙酰胺和3mL 6 mol·L-1 NaOH溶液,煮沸,嗅一嗅有何气味。
b.酸性水解在试管中加入0.5g乙酰胺和3mL 6 mol·L-1 H2SO4,煮沸,嗅一嗅有何气味。

第六章羧酸及羧酸衍生物得性质及重要反应机理一、羧酸得化学性质1、酸性羧酸具有酸性,诱导、共轭、场效应等对酸性强弱有影响。
利用羧酸得酸性可以制备羧酸酯与羧酸盐。
2、亲核取代反应这就是羧酸在一定条件下转变成羧酸生物得反应。
大多数亲核取代反应就是通过加成-消除历程完成得。
3、还原反应羧酸能被LiAlH4与B2H6还原成相应得伯醇。
4、α-H得卤化(Hell-Volhard-Zelinsky反应)通过控制卤素得用量可以制备一元或多元得卤代羧酸,并进一步制备羟基酸与氨基酸。
5、脱羧反应羧酸在适当得条件下,一般都能发生脱羧反应,这就是缩短碳链得反应。
通常得脱羧反应表示如下:A为-COOH、-CN、-(C=O)R、-NO2、-CX3、-C=O、C6H5-等吸电子基团时,脱羧反应相当容易进行。
此外还有一些特殊得脱羧方法。
二元羧酸得脱羧规律就是:乙二酸、丙二酸、加热失羧,丁二酸、戊二酸加热就是水生成分子内酸酐,己二酸、庚二酸加热就是水、失羧生成环酮。
根据以上反应可以得出一个结论,在有机反应中有成环可能时,一般易形成五元环或六元环。
这称为布朗克(Blanc)规则。
二、羧酸衍生物得化学性质1、亲核取代反应这就是羧酸衍生物得转换反应。
转换得活性顺序为:RCOX>CRCOOOCR>RCOOR′>RCONR2酸与碱都能催化反应。
2、与有机金属化合物得反应选用空阻大得酰卤,反应能控制在酮得阶段。
选用甲酸酯,可以制备对称二级醇。
选用碳酸酯,可制备三个烃基相同得三级醇。
二元酸得环状酸酐可用来制备酮酸。
酰胺氮上有活泼氢,一般不宜使用。
3、还原反应反应物还原剂NaBH4LiAlH4催化氢化B2H6RCOCl Rosenmund法RCHO+ + RCH2OH RCOOOCR + + + + 2RCH2OHRCOOR′+ +特殊催化剂+ RCH2OHR′OHRCONH2+ +特殊催化剂+ RCH2NH2RCN + + RCH2NH2反应、Bouveault-Blanc反应、酮醇反应、酯得热裂等见重要反应机理。

羧酸及其衍生物的化学性质羧酸及其衍生物是一类含有羧基(-COOH)的有机化合物。
它们常常具有酸性,因为羧基可以给出质子(H+)。
羧酸和其衍生物在水中可以形成水合物,而这些水合物在中性或酸性条件下可以存在,但在碱性条件下容易发生水解。
下面将对羧酸及其衍生物的化学性质进行一些介绍。
1. 酸性羧酸的羧基可以给出质子,因此羧酸有一定的酸性。
在水中,羧酸可以形成羧酸离子(-COO^-)和质子(H+)。
由于质子是暂时性的,因此羧酸是一个弱酸。
羧酸的酸性可以通过pKa值来衡量,pKa值越小,酸性越强。
羧酸的pKa通常在3-5之间。
2. 水解在碱性条件下,羧酸及其衍生物容易发生水解反应。
以酯为例,当酯和水在碱性条件下反应时,产生的产物是羧酸和醇。
羧酸的水解可以通过以下反应来表示:RCOOR' + NaOH → RCOO^-Na+ + R'OH3. 脱羧反应在一些情况下,羧酸中的羧基可以被脱除,形成烯丙基化合物。
这种反应叫做脱羧反应。
脱羧反应通常在高温下进行,而且需要使用强碱或强酸催化剂。
例如,苯甲酸在高温、强碱条件下可以脱羧成为苯乙烯:C6H5COOH → C6H5CH=CH2 + CO24. 共轭碱羧酸和其衍生物的共轭碱是指它们失去羧基后的化合物。
在水中,共轭碱可以受到水分子的配位,形成水合离子。
共轭碱的性质类似于胺,因为它们都有可供质子接受的孤对电子对。
共轭碱的酸性比羧酸弱,因为它们缺少羧基的酸性贡献。
5. 还原性羧酸和其衍生物在还原条件下可以发生还原反应,还原成相应的醇。
还原反应通常需要使用还原剂,如锌、氢气或铁(II)离子。
以乙酸为例,下面是它们的还原反应:6. 酰化反应羧酸和酰化试剂在酸性条件下可以发生酯化反应,生成酯。
酰化试剂通常是醇或酚,如甲醇或苯酚。
酯化反应通常需要强酸或酸性催化剂,如硫酸或氯化铝。
下面是酯化反应的示意式:总之,羧酸及其衍生物具有多种化学性质。
它们可以形成羧酸离子和质子,发生水解、脱羧、酰化等反应。

大学化学实验-(取代)羧酸及其衍生物、胺的性质大学化学实验-(取代)羧酸及其衍生物、胺的性质实验二十五(取代)羧酸及其衍生物、胺的性质【实验目的】1. 熟悉羧酸、羧酸衍生物和取代羧酸的化学性质;2. 掌握胺类化合物的性质及其鉴别方法;3. 了解酰化反应和缩二脲反应的应用。
【实验原理】羧酸一般为弱酸性(但酸性比碳酸强)。
羧酸能发生脱羧反应,而且不同各种羧酸的脱羧的条件各有不同,如草酸、丙二酸经加热即易脱羧,放出CO2;羧酸与醇在酸的催化下,加热可以发生酯化反应。
甲酸含有醛基,故能还原托伦试剂。
羧酸除能生成酯外,也能生成酰卤、酸酐和酰胺(四者统称为羧酸衍生物)。
它们的化学性质相似,能发生水解机、醇解和氨解。
活泼顺序为:酰卤酸酐酯酰胺。
取代羧酸中重要的有羟基酸和酮酸。
羟基酸中的羟基比醇分子中的羟基易被氧化,如乳酸能被托伦试剂氧化成丙酮酸;,在碱性高锰酸钾溶液中,则因高锰酸钾被乳酸还原而使紫色褪去。
乙酰乙酸乙酯是酮型和烯醇型两种互变异构体的平衡混合物,这两种异构体借分子中氢原子的移位而互变转换,所以它既具有酮的性质(如与2,4-二硝基苯肼反应生成2,4-二硝基苯腙),又具有烯醇的性质(如能使溴水褪色并能与FeCl3溶液作用呈现紫色)。
胺可以看做是氨分子中的氢原子被羟基取代的衍生物。
胺类化合物有碱性,能与酸反应生成盐。
芳香胺由于氨基的存在使苯环活化,易发生取代反应。
在酰化反应中,伯胺和仲胺由于氮上有氢原子可被酰基取代,生成相应的酰胺类化合物,叔氨氮上无氢原子则无此反应。
大多数酰胺为结晶固体,故可利用酰化反应鉴别胺类化合物。
胺类容易被氧化,氧化产物往往很复杂。
将尿素缓慢加热至熔点以上,则二分子尿素可脱去一分子氨生成缩二脲。
缩二脲在碱性溶液中与稀的硫酸铜溶液反应能产生紫红色,这种反应叫做缩二脲反应。
【仪器材料】小试管10支,烧杯(100 mL)2个,玻璃棒1根,小橡皮塞1个,酒精灯1个,温度计1个,石棉网1个,铁架台1个,铁圈1个,铁夹1个,大试管1个,带孔橡皮塞1个,导管1个,药匙1个。
羧酸及衍生物的性质
与应用
羧酸是一类半碱性有机物质,它们含有–COOH的一般结构,简称COOH。
羧酸的电解质可以充分的溶解在水中,如HCL、HC及其它的羧酸,它们都是酸性的,具有电解质性质。
因此,它们常被用于工业作业中,用作缩点常用试剂,在农业中用于加工有机物质,以用作植物生长的营养成分,在工业用途上,羧酸也用作有机化合物的中间产物等。
羧酸的衍生物主要包括羧酸酯、羧酸盐和羧酸酸酯。
羧酸酯常被用作活性材料,根据它们的不同类型,它们在化工、精细化学、农化、颜料行业有着广泛的应用。
羧酸盐的主要用途在于改善饮料的口感,在食品中很容易添加到食物中,用于调节酸碱度,增加细菌的活力。
羧酸酸酯可以用于提高涂料、油漆、油墨等涂料的水散不稳定性,以及增加涂料抗化学污染和耐水性能。
第十章羧酸及其衍生物羧酸及其衍生物❖羧酸及其衍生物的结构特征;❖羧酸及其衍生物的物理和化学性质;❖乙酰乙酸乙酯和丙二酸酯的特性及其在有机合成上的应用;❖蜡和油脂,碳酸衍生物重点要求掌握羧酸及其衍生物的化学性质;乙酰乙酸乙酯在有机合成上的应用。
10.1 羧酸10.1.1 羧酸的构造、分类和命名1、羧酸的构造和分类分子中具有羧基的化合物,称为羧酸。
它的通式为 RCOOH。
2、命名由它的来源命名:甲酸最初是由蚂蚁蒸馏得到的,称为蚁酸。
乙酸最初是由食用的醋中得到,称为醋酸。
还有草酸、琥珀酸、苹果酸、柠檬酸。
系统命名:含羧基最长的碳链作为主链,根据主链上碳原子数目称为某酸.编号从羧基开始.3,4-二甲基戊酸3-甲基-2-丁烯酸芳香族羧酸可以作为脂肪酸的芳基取代物命名:羧酸常用希腊字母来标名位次,即与羧基直接相连的碳原子为α,其余位次为β、γ…,距羧基最远的为ω位。
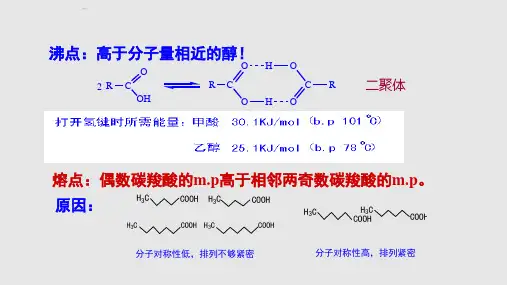
二元酸命名:10.1.2 羧酸的物理性质在室温下10个碳原子以下的饱和一元羧酸是液体。
10个碳原子以上的羧酸为石蜡固体,挥发性很低,无气味。
4~9个碳原子的脂肪酸具有腐败恶臭、动物的汗液和奶油发酸变坏的气味。
饱和一元羧酸的沸点比相对分子质量相似的 醇还要高。
饱和一元羧酸的熔点随分子中碳原子数目的增加呈锯齿状的变化。
低级脂肪酸易溶于水,但随分子量的增高而降低。
甲酸与水通过氢键缔合在固态和液态,羧酸主要以二聚体形式存在。
低级的羧酸,在气相时仍以双分子缔合状态存在。
10.1.3 羧酸的化学性质OOH H HOH O HH HHOCRCOOHOORHO ORHCC2HOR H O HC Cα10.1.3.1 酸性羧酸具有弱酸性,在水溶液中存在着如下平衡:乙酸的离解常数K a 为1.75×10-5 甲酸的K a =2.1×10-4 , p Ka =3.75其他一元酸的K a 在1.1~1.8×10-5之间, p Ka 在4.7~5之间。