氨基酸性质及分类
- 格式:doc
- 大小:604.00 KB
- 文档页数:2

试书写氨基酸的通式及氨基酸的特点一、氨基酸的通式氨基酸是构成蛋白质的基本单位,其通式为H2NCH(R)COOH,其中R代表了氨基酸侧链的基团。
每种氨基酸都是基于这个通式通过改变R基团而形成的。
二、氨基酸的特点1.化学性质:氨基酸是有机酸,具有羧基和氨基。
其氨基呈碱性,羧基呈酸性,因此氨基酸具有两性性质。
2.结构特点:氨基酸的碳原子是连接四个基团的中心,其中两个是固定的:一个连接在氨基(—NH2),一个连接在羧基(—COOH)。
另外两个位置由R基团占据。
3.种类多样性:由于R基团的多样性,自然界中存在超过一百种的氨基酸。
4.光学活性:除了甘氨酸外,其他所有天然存在的氨基酸都具有旋光性,它们可以是左旋或右旋。
5.稳定性:大部分氨基酸在正常温度和酸碱度下是稳定的。
三、氨基酸的分类1.根据R基团的化学结构:氨基酸可以分为脂肪族、芳香族和杂环族。
2.根据R基团的极性:氨基酸可以分为极性氨基酸和非极性氨基酸。
3.根据连接的羧基数目:有α-氨基酸和β-氨基酸等类型。
4.根据构型:左旋、右旋和消旋型。
四、氨基酸的合成1.体内合成:许多氨基酸可在体内由其他简单分子如氨、糖和脂肪酸合成。
这种合成方式被称为生物合成。
2.微生物发酵法:部分氨基酸可通过微生物发酵法进行工业生产。
五、氨基酸的代谢1.分解代谢:氨基酸可以分解并释放能量,或作为生物合成的原料。
2.转氨基作用:通过转氨基作用,氨基酸可以互相转化。
3.脱羧基作用:某些氨基酸通过脱羧基作用可产生特定的胺类和酸类物质。
六、氨基酸的功能1.作为蛋白质的基本单位:构成生命活动的基本物质,如酶、激素和血红蛋白等。
2.营养和生长:是动物体的重要营养来源,促进生长发育。
3.作为生物合成的前体物质:在三羧酸循环、核苷酸和血红素的合成中起到重要作用。
4.维持氮平衡:对于动物,通过尿液和汗液排出多余的氮,保持氮平衡。
5.其他功能:有些氨基酸如谷氨酸、天冬氨酸等在动物体内有特殊的代谢和生理功能。


有机化学基础知识点氨基酸的结构和性质氨基酸是有机化合物中的一类重要分子,它具有特殊的分子结构和多种性质。
本文将围绕氨基酸的结构和性质展开相关探讨。
一、氨基酸的结构氨基酸的基本结构由一个氨基(NH2)、一个羧基(COOH)、一个带有特定侧链的碳原子组成。
其中,碳原子与氨基和羧基相连,形成一个称为α-碳的中心原子。
氨基酸的侧链(R基团)可以是疏水性的烃基、亲水性的羟基或带电离子的酸基等,这些不同的侧链决定了氨基酸的特性和功能。
二、氨基酸的分类根据氨基酸的侧链特征,可以将其分为以下几类:1. 脂溶性氨基酸:侧链为非极性的疏水性基团,如甲基(Alanine),苯基(Phenylalanine)等;2. 极性氨基酸:侧链含有氢键形成原子,具有一定的亲水性,如羟基(Serine),酸基(Aspartic acid)等;3. 硫氨基酸:侧链含有硫原子,具有特殊的性质,如半胱氨酸(Cysteine);4. 离子型氨基酸:侧链带有正电荷或负电荷,如精氨酸(Arginine),谷氨酸(Glutamic acid)等。
三、氨基酸的性质氨基酸具有以下几种重要的性质:1. 生理性质:氨基酸是构成生物体内蛋白质的基本组成单元,参与细胞代谢和生命活动的调控。
其中人体无法自行合成的氨基酸称为必需氨基酸,必须从外部食物中摄入。
2. 光学性质:氨基酸的α-碳上存在手性中心,可以分为D-型和L-型两种异构体。
天然氨基酸大部分为L-型,而工业合成的氨基酸多为D-型。
3. 缔合性质:氨基酸能够通过脱羧和脱氨反应与其他分子发生缔合,形成肽键和蛋白质。
这个过程称为蛋白质的合成。
4. 缓冲性质:氨基酸中的羧基和氨基可以接受或释放质子,并能维持生物体内pH的稳定。
5. 亲水性和疏水性:由于氨基酸的不同侧链,其溶解度和溶液中的行为也会不同,包括溶解度、水合作用等。
四、应用举例1. 蛋白质合成:氨基酸是构成蛋白质的基本单元,了解氨基酸的结构和性质对研究蛋白质的合成机制和调控具有重要意义。




氨基酸的分类特点和理化性质氨基酸是构成蛋白质的基本单位,具有多种功能和作用。
根据它们的理化性质和分类特点,氨基酸可以分为非极性氨基酸、极性氨基酸和特殊氨基酸。
1.非极性氨基酸:非极性氨基酸的中心原子由一个氨基基团(NH2)、一个羧基(COOH)、一个氢原子(H)和一个碳原子(C)组成。
这类氨基酸的侧链由多种有机基团组成,不带任何阳离子或阴离子功能性团。
它们通常不溶于水,但溶于有机溶剂。
在生物体内,非极性氨基酸主要负责蛋白质的折叠和稳定。
在非极性氨基酸中,最简单的是甘氨酸、丙氨酸和异亮氨酸等。
这些氨基酸的侧链中带有碳和氢原子,由于不带电荷,属于非极性,因此有亲水性较强。
2.极性氨基酸:这类氨基酸的侧链通常包含含氧或氮等具有强电负性的原子,可以形成氢键、离子键等。
大多数极性氨基酸具有亲水性,能与水进行相互作用,因此溶解度较高。
极性氨基酸可以进一步分为酸性和碱性氨基酸。
-酸性氨基酸:这类氨基酸的侧链含有羟基和羧基,具有负电荷。
代表性的酸性氨基酸有天冬氨酸和谷氨酸等。
这些氨基酸在水溶液中具有酸性,能够释放出负电荷的氢离子,与基性氨基酸发生中和反应。
-碱性氨基酸:这类氨基酸的侧链含有氨基和胺基等功能性团,在水溶液中带正电荷。
代表性的碱性氨基酸有赖氨酸和精氨酸等。
这些氨基酸能够接受负电荷的氢离子,与酸性氨基酸发生中和反应。
3.特殊氨基酸:这是一类在生物体中含量较少,具有特殊功能和结构的氨基酸。
代表性的特殊氨基酸有脯氨酸、半胱氨酸、甲硫氨酸等。
这些氨基酸的结构中具有额外的官能团,能够参与特殊的生化反应和代谢途径。
总的来说,氨基酸的分类特点主要根据其理化性质和功能特点来区分。
非极性氨基酸主要由碳和氢原子组成,溶解度较低,主要负责蛋白质的结构稳定;极性氨基酸具有亲水性,溶解度较高,包括酸性和碱性两种,具有酸碱中和的作用;特殊氨基酸则具有特殊的结构和功能,用于特定的生化反应和代谢途径。
这些特征使得氨基酸能够在生物体内进行多种功能的发挥,并形成复杂的蛋白质结构。

氨基酸高中知识点总结氨基酸是身体内最基础的有机化合物之一,在人体内有着重要的作用。
它被广泛应用于食品工业、医药工业以及农业等领域。
本文将对高中生物中与氨基酸相关的知识进行总结。
1. 氨基酸的分类按照氨基酸的化学性质和植物/动物起源来分类,可以将氨基酸分为以下几类:(1)必需氨基酸:人体无法自行合成而需要外界摄入的氨基酸,包括赖氨酸、苏氨酸、色氨酸、缬氨酸、异亮氨酸、亮氨酸、组氨酸、苯丙氨酸、蛋氨酸等。
(2)非必需氨基酸:人体可以自行合成而无须从外界摄入的氨基酸;包括丝氨酸、甘氨酸、谷氨酸、天冬氨酸、天门冬氨酸、脯氨酸、丙氨酸、酪氨酸、天冬酰胺酸、胱氨酸等。
(3)极性氨基酸和非极性氨基酸:极性氨基酸在水中有较好溶解性,而非极性氨基酸则相对较难溶于水。
极性氨基酸包括精氨酸、天门冬氨酸、谷氨酸、天冬氨酸、组氨酸、甘氨酸等;非极性氨基酸包括天冬酰胺酸、苯丙氨酸、异亮氨酸、脯氨酸等。
(4)酸性氨基酸和碱性氨基酸:酸性氨基酸主要是指谷氨酸和天门冬氨酸,它们可在碱性环境中,释放出质子而表现出酸性;碱性氨基酸则包括赖氨酸、精氨酸、组氨酸等,它们可在酸性环境中接受质子而表现出碱性。
2. 氨基酸的结构氨基酸分子由一个氨基(end group)、一个羧基(carboxyl group)和一个R基团组成。
R基团的不同决定了氨基酸的物理性质和生化性质。
氨基和羧基两个官能团上均带有反应性的活化位点,如氨基上的α-位点和羧基上的β-位点。
α-位点紧密相关于氨基酸的蛋白质结构和功能,β-位点则与羧酸的代谢有关。
3. 氨基酸的生物作用(1)构建蛋白质:氨基酸是蛋白质的基本组成部分,通过氨基酸的字符串合成蛋白质,是热能、酶催化等基本生命功能的保证。
(2)能量来源:在代谢过程中,氨基酸被分解产生能量。
(3)合成激素:包括性激素、生长激素等。
(4)生物体内的重要辅酶:像植酸酰转移酶辅酶、尿素生物合成中的肉酸盐辅酶和甲硫氨酸辅酶等。
(5)体内代谢产物:儿茶酚、色氨酸、甘氨酸等化合物在人体代谢中生成代谢产物,如甲基异戊二酰酚、血中的谷氨酸等。

氨基酸的结构与性质氨基酸是生命中的基本分子之一,它是构成生物体内蛋白质的组成单元,同时还在许多代谢反应中发挥重要作用。
氨基酸的结构与性质涉及到它的化学组成、空间结构以及在生物体内的功能。
以下将详细介绍氨基酸的结构与性质。
一、氨基酸的化学结构:氨基酸由中心碳原子(α-C)和与之相连的四个基团组成:氨基(-NH2)、羧基(-COOH)、一个氢原子(-H)和一个侧链基团(R)。
1.氨基:-NH2,和一个氢原子连接,是氨基酸的一个常见特点。
2.羧基:-COOH,和一个氢原子连接,为氨基酸的另一个特点。
3.氢原子:-H,连接在中心碳原子上,可以与侧链基团相互作用。
4.侧链基团:R是氨基酸的特异性标志,不同的R导致了不同的氨基酸种类。
二、氨基酸的分类:氨基酸可以根据其侧链基团的性质被分为极性、非极性、酸性和碱性氨基酸。
1.极性氨基酸:侧链中含有氢键供体或受体,可以与其他极性物质相互作用。
酪氨酸、赖氨酸、组氨酸等就是极性氨基酸的代表。
2.非极性氨基酸:侧链中没有明显的极性基团,通常是脂溶性的。
丙氨酸、丝氨酸、亮氨酸等都属于非极性氨基酸。
3.酸性氨基酸:侧链中含有羧基,可以失去质子。
谷氨酸、门冬氨酸是常见的酸性氨基酸。
4.碱性氨基酸:侧链中含有氨基,在适当的条件下可以接受质子。
赖氨酸、精氨酸等属于碱性氨基酸。
三、氨基酸的空间结构:氨基酸通常以L型存在,这是由于侧链基团的位置而决定的。
在L型氨基酸中,羧基位于左侧,而氨基位于右侧。
D型氨基酸存在于一些细菌细胞壁中,而在自然界中D型氨基酸几乎不见。
氨基酸的侧链基团的位置和性质决定了氨基酸的生物功能和化学反应。
侧链基团的大小、电荷、极性、亲水性等属性对蛋白质的结构和功能起着重要的影响。
四、氨基酸的性质:1.酸碱性:氨基酸可以通过羧基中的羟基(-OH),羟基的质子(H+),以及氨基中的氨基质子(NH3+)与其他分子发生酸碱反应。
2.缔合特性:在生物体内,通过形成酯、肽和烷基缔合等化学反应,氨基酸可以与其他分子形成化学连接。

氨基酸的结构及性质氨基酸是生物体内重要的有机分子,它们包含一个氨基(NH2)基团和一个酸基(COOH)基团。
我们常常会将它们简写为“R-氨基酸”,其中“R”代表一个不同的侧链基团。
氨基酸是构成蛋白质的基本组成单位,也是生物体内许多重要分子的前体。
氨基酸的性质与其侧链基团的差异有关。
氨基酸可以分为两类:极性和非极性的。
极性氨基酸的侧链含有亲水基团,例如酪氨酸(tyrosine)和丝氨酸(serine)。
非极性氨基酸的侧链则不含有亲水基团,例如丙氨酸(alanine)和异亮氨酸(isoleucine)。
氨基酸还可以根据其侧链的不同特点进一步分类。
以下是几种常见的氨基酸及其性质:1. 酸性氨基酸:这些氨基酸的侧链中含有一个可解离的羧基(COOH),因此它们在溶液中具有酸性。
酸性氨基酸包括谷氨酸(glutamic acid)和天冬氨酸(aspartic acid)。
2. 碱性氨基酸:这些氨基酸的侧链中含有一个或多个可离子化的氨基基团(NH2)。
碱性氨基酸包括赖氨酸(lysine)和精氨酸(arginine)。
这些氨基酸在溶液中具有碱性。
3. 非极性氨基酸:这些氨基酸的侧链基团不带有电荷,因此它们在溶液中是非极性的。
非极性氨基酸包括甲硫氨酸(methionine)和苯丙氨酸(phenylalanine)。
4.极性氨基酸:这些氨基酸的侧链中含有亲水基团,因此它们在溶液中具有亲水性。
极性氨基酸可以进一步分为两类:带有极性非带电侧链的和带有偏极性侧链的。
• 带有极性非带电侧链的氨基酸包括色氨酸(tryptophan)和酪氨酸(tyrosine)。
它们在溶液中与水分子进行氢键形成稳定的结构。
• 带有偏极性侧链的氨基酸包括苏氨酸(threonine)和丝氨酸(serine)。
它们的侧链含有可以与水分子形成氢键的羟基基团。
此外,氨基酸还具有缔合成蛋白质的能力。
在蛋白质合成中,氨基酸通过肽键连接形成多肽链。
肽键是氨基酸之间的共价键,连接氨基酸的α-氨基与α-酸基。
天然氨基酸种类一、定义天然氨基酸是指在生物体内自然合成或通过生物体内代谢途径产生的氨基酸。
它们是构成蛋白质的基本单位,对生命活动起着至关重要的作用。
(一)按结构和性质分类1. 非极性脂肪族氨基酸甘氨酸(Gly,G)结构特点:是结构最简单的氨基酸,侧链基团为氢原子。
性质:具有一定的灵活性,在蛋白质结构中常出现在转角等特殊部位。
丙氨酸(Ala,A)结构特点:侧链为甲基(-CH₃)。
性质:是一种中性、非极性氨基酸,在许多蛋白质中含量较高。
缬氨酸(Val,V)结构特点:侧链为异丙基(-CH(CH₃)₂)。
性质:属于疏水性氨基酸,对维持蛋白质的三级结构有重要作用。
亮氨酸(Leu,L)结构特点:侧链为异丁基(-CH₂CH(CH₃)₂)。
性质:是一种必需氨基酸,在蛋白质的疏水区有重要功能。
异亮氨酸(Ile,I)结构特点:侧链为仲丁基(-CH(CH₃)CH₂CH₃)。
性质:也是必需氨基酸,在蛋白质结构和功能中发挥独特作用。
脯氨酸(Pro,P)结构特点:是一种亚氨基酸,其侧链与氨基氮原子形成环状结构。
性质:会使肽链产生特殊的弯曲结构,对蛋白质的折叠和稳定性有影响。
2. 极性不带电荷氨基酸丝氨酸(Ser,S)结构特点:侧链含有羟基(-OH)。
性质:具有亲水性,可参与磷酸化等修饰反应,在酶的活性中心等部位常见。
苏氨酸(Thr,T)结构特点:侧链含有羟基(-OH),且为手性碳原子。
性质:是必需氨基酸,可被磷酸化修饰,在蛋白质功能调节中有作用。
半胱氨酸(Cys,C)结构特点:侧链含有巯基(-SH)。
性质:巯基具有还原性,两个半胱氨酸可通过二硫键(-S S -)连接,对稳定蛋白质的高级结构非常重要。
甲硫氨酸(Met,M)结构特点:侧链含有甲硫基(-SCH₃)。
性质:是必需氨基酸,在蛋白质合成起始中有特殊作用。
天冬酰胺(Asn,N)结构特点:侧链含有酰胺基(-CONH₂)。
性质:具有一定的极性,在蛋白质结构中与其他氨基酸相互作用。
20种氨基酸的分类氨基酸是构成蛋白质的基本单元,共有20种不同的氨基酸。
这些氨基酸可以根据它们的化学性质和功能分为不同的类别。
下面将对这20种氨基酸进行分类介绍。
1. 碱性氨基酸碱性氨基酸包括精氨酸、赖氨酸和组氨酸。
它们的特点是在水溶液中呈现出碱性,可以与酸性氨基酸中的羧基结合形成盐桥,从而稳定蛋白质的结构。
2. 酸性氨基酸酸性氨基酸包括天冬酰胺酸和谷氨酸。
它们的特点是在水溶液中呈现出酸性,可以与碱性氨基酸中的氨基结合形成盐桥,从而稳定蛋白质的结构。
3. 疏水氨基酸疏水氨基酸包括丙氨酸、异亮氨酸、亮氨酸、甲硫氨酸、苯丙氨酸、苏氨酸、缬氨酸和脯氨酸。
它们的特点是在水溶液中不溶,通常位于蛋白质的内部,与其他疏水氨基酸相互作用,形成蛋白质的核心结构。
4. 极性氨基酸极性氨基酸包括丝氨酸、苏氨酸、酪氨酸、天冬氨酸、谷氨氨酸、组氨酸和赖氨酸。
它们的特点是在水溶液中呈现出极性,可以与其他极性氨基酸或水分子相互作用,形成蛋白质的表面结构。
5. 硫氧化氨基酸硫氧化氨基酸只有一种,即半胱氨酸。
它的特点是含有硫原子,可以与其他半胱氨酸形成二硫键,从而稳定蛋白质的结构。
6. 芳香氨基酸芳香氨基酸包括酪氨酸、苯丙氨酸和色氨酸。
它们的特点是含有芳香环结构,可以与其他芳香氨基酸或其他分子相互作用,形成蛋白质的结构。
7. 硫代氨基酸硫代氨基酸只有一种,即甲硫氨酸。
它的特点是含有硫原子和氨基,可以与其他硫代氨基酸或其他分子相互作用,形成蛋白质的结构。
8. 稀有氨基酸稀有氨基酸包括脯氨酸、异亮氨酸和甲硫异亮氨酸。
它们的特点是在自然界中很少出现,通常只存在于某些特殊的蛋白质中。
9. 磷酸化氨基酸磷酸化氨基酸包括丝氨酸、苏氨酸和酪氨酸。
它们的特点是可以被磷酸化修饰,从而影响蛋白质的功能和结构。
10. 糖基化氨基酸糖基化氨基酸包括赖氨酸和赖氨酸酰胺。
它们的特点是可以被糖基化修饰,从而影响蛋白质的功能和结构。
11. 氨基酸前体氨基酸前体包括色氨酸、苯丙氨酸和酪氨酸。
氨基酸高考知识点在高考化学考试中,氨基酸是一个重要的知识点。
氨基酸是构成蛋白质的基本单位,对于了解蛋白质的结构与功能具有重要意义。
本文将介绍氨基酸的结构和分类、氨基酸的性质及在生物体中的重要作用等知识点。
一、氨基酸的结构和分类氨基酸的结构由一个氨基(-NH2)、一个羧基(-COOH)和一个官能团(R)组成。
氨基酸的R官能团决定了其特定的属性。
根据R官能团的不同,氨基酸可以分为疏水性氨基酸(例如丙氨酸、丙氨酸、异亮氨酸等)、亲水性氨基酸(例如丝氨酸、谷氨酸、肽和脯氨酸等)、酸性氨基酸(例如天门冬氨酸、谷氨酸等)和碱性氨基酸(例如精氨酸、赖氨酸等)等几种类别。
二、氨基酸的性质氨基酸具有酸碱性,其R官能团可以产生酸碱中心。
当氨基酸中的羧基失去H+时,形成负离子,称为离子化氨基酸。
离子化氨基酸在生物体内起着重要的生理作用,如维持血液的酸碱平衡。
氨基酸还具有光学活性,大多数天然氨基酸都存在于左旋型和右旋型两种异构体中。
左旋和右旋异构体的旋光性质是由氨基酸结构中的手性碳原子所决定的。
氨基酸还具有吸湿性,因此在自然界中很少存在单一的氨基酸,多数情况下氨基酸以二聚体或多聚体的形式存在。
例如,两个丙氨酸分子通过水解反应形成二丙氨酸。
三、氨基酸在生物体中的重要作用在生物体内,氨基酸不仅构成蛋白质的基本单元,还参与许多生理过程。
首先,氨基酸通过蛋白质合成参与了生物体的生长与发育。
蛋白质是身体细胞和组织的重要组成部分,包括肌肉、骨骼、器官和酶等。
因此,摄取足够的氨基酸对于维持正常的身体功能至关重要。
其次,氨基酸还是抗体、激素和神经递质的合成物质。
抗体是免疫系统的重要组成部分,可以识别和抵御外来物质。
激素则参与调节生理过程,如生长激素控制生长发育,胰岛素调节血糖水平等。
神经递质则在神经系统中起着传递神经冲动的作用。
此外,一些氨基酸也被用于合成体内的非蛋白质物质,如色素、尿素、嘌呤和嘧啶等。
综上所述,氨基酸作为构成蛋白质的基本单元,在高考化学考试中是一个重要的知识点。
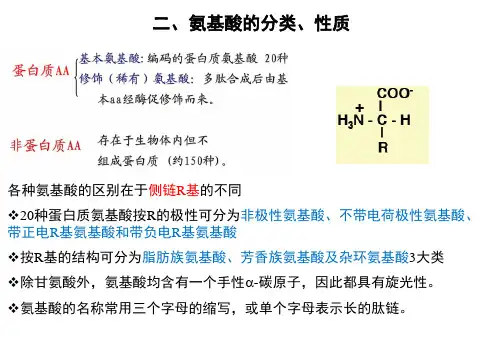
第一章氨基酸(amino acid)的结构与性质第一节氨基酸的结构与分类一、氨基酸的结构组成蛋白质的基本单位是氨基酸。
如将天然的蛋白质完全水解,最后都可得到约二十种不同的氨基酸。
从氨基酸的结构通式可以看出:构成蛋白质的氨基酸均为L—α—氨基酸。
除R 为H(甘氨酸)外,其余氨基酸均具有旋光性。
*在空间各原子有两种排列方式:L—构型与D—构型,它们的关系就像左右手的关系,互为镜像关系,下图以丙氨酸为例:二、氨基酸的分类:1.按氨基酸分子中羧基与氨基的数目分:酸性氨基酸:一氨基二羧基氨基酸,有天冬氨酸、谷氨酸;碱性氨基酸:二氨基一羧基氨基酸,有赖氨酸、精氨酸、组氨酸;中性氨基酸:一氨基一羧基氨基酸,有甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、甲硫氨酸、半胱氨酸、苯丙氨酸、色氨酸、酪氨酸、脯氨酸、天冬酰胺、谷氨酰胺、丝氨酸、苏氨酸。
2.按侧基R 基的结构特点分:脂肪族氨基酸芳香族氨基酸:苯丙氨酸、色氨酸、酪氨酸杂环氨基酸:脯氨酸、组氨酸3.按侧基R 基与水的关系分:非极性氨基酸:有甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、甲硫氨酸、半胱氨酸、苯丙氨酸、色氨酸、酪氨酸、脯氨酸;极性不带电氨基酸:天冬酰胺、谷氨酰胺、丝氨酸、苏氨酸;极性带电氨基酸:天冬氨酸、谷氨酸、赖氨酸、精氨酸、组氨酸。
4. 按氨基酸是否能在人体内合成分:必需氨基酸:指人体内不能合成的氨基酸,必须从食物中摄取,有八种:赖氨酸、色氨酸、甲硫氨酸、笨丙氨酸、缬氨酸、亮氨酸、异亮氨酸、苏氨酸。
非必需氨基酸:指人体内可以合成的氨基酸。
有十种。
半必需氨基酸:指人体内可以合成但合成量不能满足人体需要(特别是婴幼儿时期)的氨基酸,有两种:组氨酸、精氨酸。
三、稀有氨基酸:参加天然蛋白质分子组成的氨基酸,除了上述20 种有遗传密码的基本氨基酸之外,在少数蛋白质分子中还有一些不常见的氨基酸,称为稀有氨基酸。
它们都是在蛋白质分子合成之后,由相应的常见氨基酸分子经酶促化学修饰而成的衍生物。