饲料中粗蛋白质的测定
- 格式:doc
- 大小:46.00 KB
- 文档页数:4

饲料中粗蛋白测定方法 Document serial number【KKGB-LBS98YT-BS8CB-BSUT-BST108】饲料中粗蛋白测定方法1、原理凯氏法测定试样中的含氮量,即在催化剂作用下,用硫酸破坏有机物,使含氮物转化成硫酸铵。
加入强碱进行蒸馏使氨逸出,用硼酸吸收后,再用酸滴定,测出氮含量,将结果乘以换算系数6.25,计算出粗蛋白含量。
2、试剂2.1硫酸(GB625):化学纯,含量为98%,无氮。
2.2混合催化剂:0.4g硫酸铜,5个结晶水(GB665),6g硫酸钾(HG3—920)或硫酸钠(HG3—908),均为化学纯,磨碎混匀。
2.3氢氧化钠(GB629):化学纯,40%水溶液(m/V)。
2.4硼酸(GB628):化学纯,2%水溶液(m/V)。
2.5混合指示剂:甲基红(HG3—958)0.1%乙醇溶液,溴甲酚绿(HG3—1220)0.5%乙醇溶液,两溶液等体积混合,在阴凉处保存期为三个月。
2.6盐酸标准溶液:邻苯二甲酸氢钾法标定,按GB601制备。
2.6.1盐酸标准溶液:c(HCl)=0.1mol/L。
8.3mL盐酸(GB622,分析纯),注入1000mL蒸馏水中。
2.6.2盐酸标准溶液:c(HCl)=0.02mol/L。
1.67mL盐酸(GB622,分析纯),注入1000mL蒸馏水中。
2.7蔗糖(HG3—1001):分析纯。
2.8硫酸铵(GB1396):分析纯,干燥。
2.9硼酸吸收液:1%硼酸水溶液1000mL,加入0.1%溴甲酚绿乙醇溶液10mL,0.1%甲基红乙醇溶液7mL,4%氢氧化钠水溶液0.5mL,混合,置阴凉处保存期为一个月(全自动程序用)。
3、仪器设备3.1实验室用样品粉碎机或研钵。
3.2分样筛:孔径0.45mm(40目)。
3.3分析天平:感量0.0001g。
3.4消煮炉或电炉。
3.5滴定管:酸式,10、25mL。
3.6凯氏烧瓶:250mL。
3.7凯氏蒸馏装置:半微量水蒸气蒸馏式。
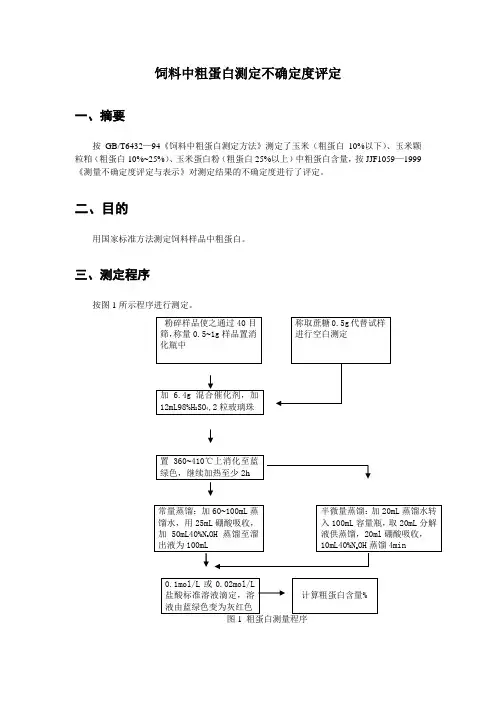
饲料中粗蛋白测定不确定度评定一、摘要按GB/T6432—94《饲料中粗蛋白测定方法》测定了玉米(粗蛋白10%以下)、玉米颗粒粕(粗蛋白10%~25%)、玉米蛋白粉(粗蛋白25%以上)中粗蛋白含量,按JJF1059—1999《测量不确定度评定与表示》对测定结果的不确定度进行了评定。
二、目的用国家标准方法测定饲料样品中粗蛋白。
三、测定程序按图1所示程序进行测定。
图1 粗蛋白测量程序四、被测量粗蛋白含量以占样品质量的百分比表示式中:V 1—滴定试样时所需酸标准溶液体积,mL ; V 2—滴定空白时所需酸标准溶液体积,mL ; C — 酸标准溶液浓度,mol/L ; m — 试样质量,g ;V — 试样分解液总体积,mL ; V 3—试样分解液蒸馏用体积,mL ; 0.0140— 每毫摩尔质量氮的克数;6.25— 氮换算成蛋白质的平均系数。
五、不确定度来源分析不确定度来源见图2— 因果关系图图2 因果关系图10025.60140.0)(321⨯⨯⨯⨯⨯-=Vm C V V P称样m滴定试样(空白)用标液体积V 1、V 2重复性(r)摩尔质量M(N)六、不确定度分量的量化1、 标准溶液浓度标准溶液浓度不确定度是测量不确定度的主要分量之一,同时,标准溶液浓度不确定度也是由多个分量合成所得,按GB601—88《化学试剂 标准溶液制备方法》,使用的盐酸标准溶液是采用标定法配制而成,下面详细描述配制过程。
1.1目的以无水碳酸钠(Na 2CO 3)基准标定0.1mol/L (或0.02mol/L )盐酸溶液。
1.2标定程序见图3,按GB601—88标准有标定程序框图图3 标定程序框图 1.3被测量按下式计算盐酸标准溶液的浓度(GB601-88)05299.0)V V (m C 21⨯=-式中:m —无水碳酸钠质量,g;V 1—滴定用盐酸溶液体积,mL;量取9mL 盐酸注入1000mL 水中V 2—空白试验用盐酸溶液体积,mL;0.05299—每1/2毫摩尔质量碳酸钠的克数。

实验三、饲料中粗蛋白质的测定【学习目标】掌握饲料中粗蛋白质的测定方法,并能用此方法测定饲料中粗蛋白质的含量。
一、原理饲料中纯蛋白质和非蛋白氮总称粗蛋白质。
凯氏法的基本原理是用浓H2SO4在催化剂(CuSO4、K2SO4、Na2SO4等)的催化作用下消化饲料样本,使其中的蛋白质和非蛋白氮都转变为 (NH4)2SO4,(NH4)2SO4在浓碱作用下放出NH3,通过蒸馏,氨气随水蒸汽沿冷凝管流入硼酸吸收液被硼酸吸收并与之结合成为四硼酸铵,然后以甲基红、溴甲酚绿作指示剂,用标准HCL溶液滴定,求出氮含量,根据氮含量再乘以系数(通常为 6.25),即为粗蛋白质的含量。
上述原理的主要化学反应如下:催化剂1.2CH3CHNH2COOH+13H2SO (NH4)2SO4+6CO2↑+12SO2↑+16H2O加热2.(NH4)2SO4+2NaOH 2NH3↑+2H2O+Na2SO43.4H3BO3+NH3 NH4HB4O7+5H2O4.NH4HB4O7+5H2O+HCL NH4CL+4H3BO3系数6.25是根据饲料蛋白质平均含氮量为16.0%而来的,而实际上,各种样本的蛋白质种类不同,含氮量有差异,变动为14.7~19.5%之间,故一般饲料换算系数用6.25,已确定的最好用实际系数。
为方便使用,将已知几种饲料的系数介绍如下:肉类6.25,玉米6.00,小麦、燕麦、黑麦、大豆、箭舌豌豆、蚕豆5.70,牛奶及制品6.28,坚果及油饼类5.30。
二、仪器设备1.样品粉碎机 40目分样筛;2.分析天平感量0.0001g;3.电子天平感量0.0001g;4.工业天平感量0.01g;5.六联电炉 6×800-1000W;6.半微量凯氏定氮仪或改良式半微量凯氏定氮仪(图1、图2);7.酸式滴定管 25.0ml或50.0ml;8.凯氏烧瓶 100.0ml;9.烧杯 250.0ml;10.三角瓶 150.0ml;11.容量瓶 100.0ml;12.移液管 10.0ml;13.量筒 10.0ml、25.0ml。


饲料中粗蛋白的测定一、实验目的通过饲料样品中粗蛋白的测定,掌握饲料粗蛋白质含量的测定方法。
二、适用范围本方法适用于配合饲料、浓缩饲料和单一饲料。
三、实验原理凯氏法测定试样中的含氮量,即在催化剂作用下,用浓硫酸破坏有机物,使含氮物转化成硫酸铵。
加入强碱进行蒸馏使氨逸出,用硼酸吸收后,再用酸滴定,测出氮含量,将结果乘以换算系数,计算出粗蛋白含量。
四、试剂(1)硫酸:化学纯,含量为98%,无氮。
(2)混合催化剂:0.4g硫酸铜,5个结晶水;6g硫酸钾或硫酸钠,均为化学纯,磨碎混匀。
(3)氢氧化钠:化学纯,40%水溶液(m/V)。
(4)硼酸:化学纯,2%水溶液(m/V)。
(5)混合指标剂:甲基红%乙醇溶液,溴甲酚绿%乙醇溶液,两溶液等体积混合,在阴凉处保存期为3个月。
(6)盐酸标准溶液:基准无水碳酸钠法标定;① L盐酸标准溶液:盐酸注入1000ml蒸馏水中。
② L盐酸标准溶液:盐酸注入1000ml蒸馏水中。
(7)蔗糖:分析纯。
(8)硫酸铵:分析纯,干燥。
(9)硼酸吸收液:1%硼酸水溶液1000mL,加入%溴甲酚绿乙醇溶液10mL,%甲基红乙醇溶液7mL,4%氢氧化钠水溶液,混合,置阴凉处保存期为1个月(全自动程序用)。
五、仪器设备(1)实验室用样品粉碎机或研钵。
(2)分样筛:孔径0.45mm(40目)。
(3)分析天平:感量0.0001g。
(4)消煮炉或电炉。
(5)滴定管:酸式,10、25mL。
(6)凯氏烧瓶:250mL。
(7)凯氏蒸馏装置:常量直接蒸馏式或半微量水蒸汽蒸馏式。
(8)锥形瓶:150、250mL。
(9)容量瓶:100mL。
(10)消煮管:250mL。
(11)定氮仪:以凯氏原理制造的各类型半自动、全自动蛋白质测定仪。
六、分析步骤试样的选取和制备: 选取具有代表性的试样用四分法缩减至200g,粉碎后全部通过40目筛,装于密封容器中,防止试样成分的变化。
(1)仲裁法①试样的消煮称取试样~1g(含氮量5~80mg)准确至0.0002g,放入凯氏烧瓶中,加入6.4g混合催化剂,与试样混合均匀,再加入12mL硫酸和2粒玻璃珠,将凯氏烧瓶置于电炉上加热,开始小火,待样品焦化,泡沫消失后,再加强火力(360~410℃)直至呈透明的蓝绿色,然后再继续加热,至少2h。


饲料中粗蛋白的测定-定氮仪法参照GB/T 6432-941 适用范围本方法适用于配合饲料、浓缩饲料及单一饲料。
2 测定原理在催化剂(如硫酸铜、硫酸钾、硫酸钠或硒粉)作用下,试样中有机物质被浓硫酸消化分解,使含氮物质(蛋白质,氨态氮等)转化为硫酸铵,而非含氮物质则以二氧化碳、水蒸气、二氧化硫等气态逸出。
消化液在强碱作用下蒸馏,释放出氨气,氨气冷凝后被硼酸吸收,并与其结合成硼酸铵,然后以甲基红-溴甲酚绿作混合指示剂,用盐酸标准滴定溶液滴定,求出氮的含量,再乘以一定的换算系数(通常用6.25计算),即得出试样中粗蛋白质的含量。
3 试剂和材料未特殊标注的试剂均为分析纯。
水至少应为GB/T 6682-1992规定的3级3.1 浓硫酸:化学纯。
3.2 400g/L氢氧化钠溶液:400 g氢氧化钠(化学纯),溶于1000 mL水中。
3.3 混合催化剂:取质量比为1:9的五水合硫酸铜(预处理:研磨至粉末状)和无水硫酸钾混合并研磨混匀,装入试剂瓶中密封备用。
3.4 1 g/L甲基红乙醇溶液:称取0.10g甲基红溶于100 mL乙醇中,棕色瓶中保存3个月。
3.5 1 g/L溴甲酚绿乙醇溶液:称取0.10g溴甲酚绿溶于100 mL乙醇中,棕色瓶中保存3个月。
3.6 硼酸吸收液:称取40 g硼酸溶于1 L水中,缓慢加热搅拌溶解,注意加热时不能将溶液加热沸腾,加入溴甲酚绿乙醇溶液(1 g/L)10 ml和甲基红乙醇溶液(1 g/L)6.8 mL,充分混匀。
向其中加入2%的氢氧化钠溶液,直到达到以下要求:取30mL上液于锥形瓶中,加入100 mL水,观察溶液颜色,应为接近盐酸滴定终点的暗灰绿色,以利于蛋白测定中空白的滴定(每10升硼酸溶液约加2%的氢氧化钠溶液3.8mL)。
混合均匀后置阴凉处保存,保存期为1个月。
3.7 0.1 mol/L或0.05mol/L盐酸标准滴定溶液:8.3 ml(或4.15ml)盐酸注入1000 mL水中,用无水碳酸钠法标定。




饲料中粗蛋白质的测定
一、目的
掌握饲料中粗蛋白质的测定方法,并测定饲料中粗蛋白质的含量。
二、原理
饲料中纯蛋白质和非蛋白氮总称粗蛋白质。
凯氏法的基本原理是用浓H2SO4在还原性催化剂(CuSO4、K2SO4、Na2SO4等)的催化作用下消化饲料样本,使其中的蛋白质和非蛋白氮都变为NH4+,NH4+立即被浓H2SO4吸收成为(NH4)2SO4,(NH4)2SO4在浓碱作用下放出NH3,通过蒸馏,氨气随水蒸汽沿冷凝管流入硼酸吸收液被硼酸吸收并与之结合成为四硼酸铵,然后以甲基红溴甲酚绿混合指示剂作指示剂,用标准HCL溶液滴定,求出氮含量,根据不同饲料再乘以一定的换算系数(通常用6.25计算),即为粗蛋白质的含量。
上述原理的主要化学反应如下:
2.(NH4)2SO4+2NaOH→2NH3↑+2H2O+Na2SO4
3.H3BO3+NH3→NH4H2BO3
4.NH4H2BO3+HCL→NH4CL+H3BO3
三、仪器设备
1.实验室用样品粉碎机:40目网筛。
2.分析天平:感量0.0001。
3.电子天平: 感量0.001。
4. 六联电炉: 6×1000W。
5.改良式半微量凯氏定氮仪(图1)。
6.酸式滴定管:25ml。
7.凯氏烧瓶:100ml。
8.烧杯:250ml。
9.三角瓶:150ml。
10.容量瓶:100ml。
11.移液管:10ml。
12.量筒: 10ml 。
13.量筒:25ml。
四、试剂
1.浓H2SO4:化学纯,含量为98%,无氮。
2.混合催化剂:CuSO4:Na2SO4=1:10 化学纯。
3.甲基红—溴甲酚绿混合指示剂:0.1%甲基红酒精溶液与0.5%溴甲酚绿酒精溶液等体积混合,阴凉处保存期不超过三个月。
此混合指示剂在碱性溶液中呈蓝色,中性溶液中呈灰色,强酸性溶液中呈红色。
在硼酸吸收液中呈暗紫色,在吸收氨的硼酸溶液中呈兰色。
4.2%硼酸吸收液:溶2g化学纯硼酸于100ml蒸馏水中,加甲基红—溴甲酚绿混合批示剂0.4ml。
5.40%饱和NaOH溶液:溶40克氢氧化钠(化学纯)于100ml蒸馏水中。
6.0.05mol/l的HCL标准液:取分析纯浓HCL(比重1.19)4.2ml,加蒸馏水稀释至1000ml,用基准物质标定。
将基准无水碳酸钠(分析纯)于270-300℃灼烧40分钟称重,至恒重,准确称取0.013-0.015克,溶于50ml 蒸馏水中,加2滴甲基红—溴甲酚绿混合指示剂,用欲配的0.05mol/lHCL滴定至暗紫红色,记录HCL用量
五、测定步骤
1.样本的消化:
精确称取饲料样本0.5-1g,以硫酸纸卷无损的移入消化管中,再加入5氺硫酸铜0.4克,无水硫酸钾或硫酸钠6克,加10ml浓硫酸后将凯氏烧瓶放于通风橱的电炉子上消化(为防止消化时液体溅失,可再加两粒玻璃珠)。
注意:先低温加热(100-200℃),注意防止泡沫浮起,待泡沫消失后,提高加热温度(约360-410℃)
至沸腾。
消化时要经常转动凯氏烧瓶,如果有黑色炭粒不能全部消化,待烧瓶冷却后,补加少量浓硫酸后继续消化至溶液澄明无黑点并呈蓝绿色为止,移出电炉,放于凯氏消化架上冷却。
2.转移:将冷却的消化液加少许蒸馏水约20ml,摇匀后无损移入100ml容量瓶,再用蒸馏水反复冲洗烧瓶数次,直至消化液全部转入容量瓶中,冷却至室温后以蒸馏水定容至刻度。
即为试样分解液。
3.空白实验:另取凯氏烧瓶一个,加入混合催化剂(同前),浓硫酸10ml,同样消化至澄清,冷却后按上述方法转移至容量瓶中,定容至刻度备用。
4.蒸馏:取35ml 2%硼酸溶液于锥形瓶中,加混合指示剂2滴,将冷凝管的末端浸入硼酸液面下,准确移取试样分解液10-20ml,注入蒸馏反应室中,用少量蒸馏水冲洗进样入口,塞好入口玻璃塞,再加400g/L 氢氧化钠溶液10ml,小心的拉起玻璃塞使之进入反应室,将玻璃塞好,入口处加水封好,防止漏气,蒸馏4分钟,式冷凝管离开液面,在蒸馏1分钟,然后停止蒸馏。
(说明:就蒸馏方法来看,商业部门多用半微量法,农业部门多用常量法,本书主要介绍半微量凯氏定氮法。
)1-蒸馏瓶反应室
5.滴定:先将酸式滴定管准备妥当,装入0.02mol/l(0.1mol/l)的HCL标准液,然后将吸收液用HCL滴定,至瓶中溶液由蓝绿色变成灰红色为止,记录HCL用量(ml)。
空白消化液的测定与上述方法相同。
六、测定结果的计算
式中:V1—样品滴定时HCL的用量(ml) 。
V0—空白滴定时HCL的用量(ml)。
V2—样品消化后定容的体积(ml)。
V3—蒸馏时,吸收样品消化液的体积(ml)。
C—标准盐酸溶液的浓度(mol/L)。
W—样品重(克)。
6.25—氮换算成蛋白质的平均系数。
0.0140—每ml吸收HCL相当于0.0140克氮。
七、注意事项
1.消化时开始时一定要用小火,当泡沫停止产生后才能加大火力。
2.消化时间一般为4小时左右即可,时间过长会引起氮的损失,但若样品中赖氨酸或组氨酸较多时,时间需延长1-2倍。
因为此二种氨基酸中的氮短时间内不易消化完全。
3.样本含脂肪或糖较多时,消化时间要延长,同时应避免产生气泡而溢出瓶外,一旦产生大量泡沫,可摇动烧瓶并减少火焰,必要时停止加热一段时间。
4.蒸馏过程中,要严防仪器接头处漏气现象。
5.重复性:每个试样取两个平行样进行测定,结果取其平均值。
7.精密度要求:粗蛋白含量在25%以上者允许相对误差1%;粗蛋白含量在10-25%者允许相对误差2%;粗蛋白含量在10%以下者允许相对误差3%。