药品微生物检验替代方法
- 格式:ppt
- 大小:515.00 KB
- 文档页数:53
药品微生物检验替代方法验证指导原则本指导原则是为所采用的试验方法能否替代药典规定的方法用于药品微生物的检验提供指导。
随着微生物学的迅速发展,制药领域不断引入了一些新的微生物检验技术,大体可分为三类:(1)基于微生物生长信息的检验技术,如生物发光技术、电化学技术、比浊法等;(2)直接测定被测介质中活微生物的检验技术,如固相细胞技术法、流式细胞计数法等;(3)基于微生物细胞所含有特定组成成分的分析技术,如脂肪酸测定技术、核酸扩增技术、基因指纹分析技术等。
这些方法与传统检查方法比较,或简便快速,或具有实时或近实时监控的潜力,使生产早期采取纠正措施及监控和指导优良生产成为可能,同时新技术的使用也促进了生产成本降低及检验水平的提高。
在控制药品微生物质量中,微生物实验室出于各种原因如成本、生产量、快速简便及提高药品质量等需要而采用非药典规定的检验方法(即替代方法)时,应进行替代方法的验证,确认其应用效果优于或等同于药典的方法。
微生物检验的类型及验证参数药品微生物检验方法主要分两种类型:定性试验和定量试验。
定性试验就是测定样品中是否存在活的微生物,如无菌检查及控制菌检査。
定量试验就是测定样品中存在的微生物数量,如菌落计数试验。
由于生物试验的特殊性,如微生物检验方法中的抽样误差、稀释误差、操作误差、培养误差和计数误差都会对检验结果造成影响,因此,药品质量标准分析方法验证指导原则(附录XIX A)不完全适宜于微生物替代方法的验证。
药品微生物检验替代方法的验证参数见表1。
表1 不同微生物检验类型验证参数注:尽管替代方法的验证参数与药品质量标准分析方法验证参数有相似之处,但是其具体的内容是依据微生物检验特点而设立的。
替代方法验证的实验结果需进行统计分析,当替代方法属于定性检验时,一般采用非参数的统计技术;当替代方法属于定量检验时,需要采用参数统计技术。
进行微生物替代方法的验证时,若替代方法只是针对药典方法中的某一环节进行技术修改,此时,需要验证的对象仅是该项替代技术而不是整个检验方法。
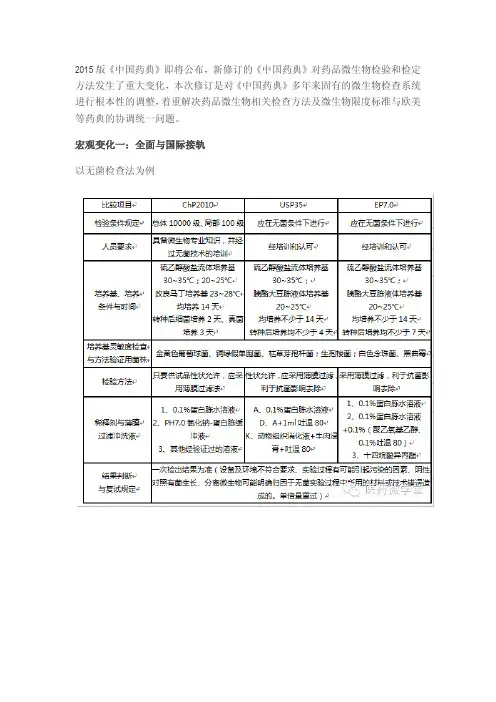
2015版《中国药典》即将公布,新修订的《中国药典》对药品微生物检验和检定方法发生了重大变化,本次修订是对《中国药典》多年来固有的微生物检查系统进行根本性的调整,着重解决药品微生物相关检查方法及微生物限度标准与欧美等药典的协调统一问题。
宏观变化一:全面与国际接轨以无菌检查法为例从上述无菌检查法的比较中我们不难看出,新药典参考EP7.0、USP35、JPXV 标准,修订中国药典的微生物标准;参考欧美日药典标准修订菌数标准表达方式;以需氧菌总数替代细菌数、耐胆盐的格兰阴性菌替代大肠菌群等等,并增加新的概念:如含菌量较低的供试品细菌总数测定使用最大可能数法、分散均匀并非一定要溶解等等,同时新药典引入的偏差调查概念和内容更具体等等方面说明,微生物检验技术与国际标准要求接轨已成定势。
微观变化二:实验环境的修订2015年版药典中对无菌检查环境洁净度规定:无菌检查应在B 级背景下的A 级单向流洁净区域或D级背景下的隔离器中进行。
限度检查要求在受控洁净环境下的局部不低于B级单向流空气区域进行。
环境的提升,除了对药品检测设备硬件的要求提高,还有验证和维持环境要求的提高。
洁净或无菌室应配备独立的空气机组或空气净化系统,以满足相应的检验要求,包括温度和湿度的控制,压力、照度和噪声等都应符合工作要求。
空气过滤系统应定期维护和更换, 并保存相关记录。
微生物实验室应划分成相应的洁净区域和活菌操作区域,同时应根据实验目的,在时间或空间上有效分隔不相容的实验活动,将交叉污染的风险降低到最低。
活菌操作区应该配备生物安全柜,以避免危害性的生物因子对实验人员和实验环境造成的危害。
实验室环境监测要求提高,增加人员进出表面微生物的监测,以降低人员操作时带来的风险。
对微生物室使用的消毒剂和清洁剂进行验证,从而有效控制微生物,保证无菌环境达到要求。
微生物实验室需要加强人员在环境监测时的操作规范,保证环境监测数据的准确性。
而且实验人员应经过实验室生物安全方面的培训,保证自身安全,防止微生物在实验室内部污染。


<1223>微生物检验替代方法的验证引言本通则目的是为使用法定药典微生物检查方法之外的替代方法所进行的验证提供指南。
对于微生物的回收和鉴定,微生物检验实验室出于各种不同的原因,如成本、工作量和效率,有时会使用药典附录方法之外的替代方法。
这些方法必须经过验证。
在凡例与要求中的检测与含量测定中提供了一些使用替代方法的验证指南。
这一节还说明,在发生争议时,只有使用药典方法所得到的结果才是决定性的。
微生物替代方法的验证研究应考虑到很大程度的变异。
例如,在使用常规平板计数法进行微生物检测时,经常要面对比通常使用化学分析方法所得到的(RSD为1%〜3%)更为宽泛的结果范围(RSD为15%〜35%)。
许多常用的微生物检验方法容易受到抽样误差、稀释误差、浇碟误差、培养误差和操作误差的影响。
药典分析方法验证<1225>定义了一些在分析方法验证中需要应用的术语,如准确度、精密度、专属性、检测限、定量限、线性、范围、重现性和耐用性。
这些定义对于回答“至少与药典方法相当”这一问题所进行的微生物检验替代方法的验证而言是不很适宜的。
(见凡例与要求中的检测与含量测定)。
关键的问题是替代方法将产生的结果能否相当于或优于传统方法。
其他行业组织也提供了微生物检验替代方法的验证指导原则。
通过比较研究USP方法和替代方法来证明新方法或修改后的方法的适用性。
本章定义的特性,可用于建立这种比较。
微生物检验的类型验证的关键点是要确认检验方法中使用了替代技术的哪部分。
例如,有各种技术可用于检测活细胞的存在。
这些技术可能会被各种检验方法所采用(例如,生物负荷,无菌检查),但亊实上,并没有完全地替代检验方法的关键方面。
例如,使用结合有回收培养基的特殊过滤器并按药典规定的程序用薄膜过滤法进行无菌检査,然后使用一些现有的技术来证明活细胞的存在。
对这种方法进行验证,只需要针对所使用的回收系统而不必是整个方法。
针对微生物检验主要有三种检验类型。

新版药典微生物学检查方法增修定内容大家下午好:今天我和大家一起共同学习2010年版《中国药典》微生物学检查方法增修定内容。
首先我们先了解2010年版《中国药典》新增内容,2010年版《中国药典》分为三部出版,一部为中药,二部为化学药,三部为生物制品。
各部内容主要包括凡例、标准正文和附录三部分,其中附录由制剂通则、通用检测方法、指导原则及索引等内容构成。
药典二部收载化学药品、抗生素、生化药品、放射性药品以及药用辅料等。
药典三部收载生物制品。
新版药典在凡例、品种的标准要求、附录的制剂通则和检验方法等方面均有较大的改进和发展,特别是对药品的安全性、有效性和质量可控性方面尤为重视。
新版药典在继承前版药典的基础上,做了大量发展和创新性的工作。
本版药典具有以下几个特点:一是新增与淘汰并举,收载品种有较大幅度的增加;二是药品检测项目和检测方法增加,标准提高;三是中药标准有突破和创新;四是新版药典在凡例、品种的标准要求、附录的制剂通则等方面均有较大的变化和进步;五是力求覆盖国家基本药物目录品种和社会医疗保险报销药品目录品种。
2010年版《中国药典》在2005年版的基础上,做了大幅度的增修订和新增品种的工作。
本版药典共收载品种4598种,新增1462种。
其中:一部收载品种2136种,新增990种、修订612种;二部收载品种2220种,新增341种、修订1549种;三部收载品种131种,其中新增27种、修订104种。
药用辅料、标准新增130多种。
附录其中药典一部新增14个、修订54个;药典二部新增15个、修订70个;药典三部新增18个、修订38个。
主要特色与2005年版药典相比,新版药典新增加品种总计1358个,总数达到4615个,形成了中药材、中药饮片、中成药、化学药品、药用辅料、生物制品等各类齐全的药品标准体系,基本覆盖国家基本药物目录品种的需要。
新版药典广泛收载国内外先进成熟的检测技术和分析技术,品种标准进一步扩大对新技术的应用使化学药品标准与国际先进水平趋于一致,中药的专属性质量控制方法进一步提高。




单选题1、三糖铁培养基用于鉴定:()A、大肠埃希菌B、沙门菌C、金黄色葡萄球菌D、铜绿假单胞菌你的答案: B2、微生物鉴定方法的确认一般参考:()A、<9201>药品微生物检验替代方法指导原则B、<9202>非无菌制剂微生物限度检查法指导原则C、<9203>药品微生物实验室质量管理指导原则D、<9204>微生物鉴定方法指导原则你的答案: D3、微生物大小的测量单位:()A、毫米B、微米C、纳米D、皮米你的答案: D4、聚合酶链式反应的循环,以下说法错误的是:()A、变性B、退后C、复性D、延伸你的答案: B5、《中国药典》2015年版收载的基因型鉴定方法是:()A、PFGEB、RiboPrinterC、RT-PCRD、RFLP你的答案: B6、Sanger测序技术指的是:()A、第一代测试技术B、第二代测试技术C、第三代测试技术D、第四代测试技术你的答案: A7、对污染微生物进行溯源最适宜的方法是:()A、表型鉴定B、基因型鉴定C、微生物限度检查D、无菌检查你的答案: B8、以下哪一项不是微生物的表型鉴定方法:()A、革兰染色B、氧化酶试验C、聚合酶链式反应鉴定D、VITEK2生化鉴定你的答案: C9、分子生物学检测技术用于药品质量控制综合技术平台建设包括:()A、技术要求体系B、应用信息平台C、国家标准核酸信息数据库D、以上全对你的答案: D10、PDA TR13建议产品污染事件(涉及培养基灌装、无菌检查试验)和环境严重异常事件时,微生物鉴定应达到的水平为:()A、菌落和细胞形态B、属C、种D、菌株分型或分子水平鉴定你的答案: D本次得分= 非主观题分数+ 主观题分数= 80.0 + 0.0 = 80.0 分最高得分:80 分。

细菌内毒素检测无法完全取代家兔热原法关键词细菌内毒素热原鲎试剂试验用家兔在药品药理检测中,目前有两种常用的热原检测方法细菌内毒素法(鲎试剂法)和家兔法。
虽然细菌内毒素检测法具有简便、快速、灵敏、重现性好等优点,且原来许多利用家兔热原检查法检测的药品均被细菌内毒素检查法所替代。
但由于部分中药注射剂成分较复杂无法通过稀释法消除干扰,再加上鲎试剂对革兰阴性菌以外的内毒素不够灵敏,故细菌内毒素检测法无法完全取代家兔热原检测法。
概述热原系指由微生物产生的能引起恒温动物体温异常升高的致热物质。
它包括细菌性热原、内源性高分子热原、内源性低分子热原及化学热原等。
通常所指的“热原”,主要是指细菌性热原,是某些细菌的代谢产物、细菌尸体及细菌内毒素。
可见细菌内毒素是热原之一种。
细菌内毒素一般可分为外毒素和内毒素两类:外毒素是一种毒性蛋白质,是细菌在生长过程中分泌到菌体外的毒性物质,产生外毒素的细菌主要是革兰阳性菌。
内毒素是革兰阴性菌细胞壁的产物,一般活体细菌不会产生,只有当细菌死亡或黏附在其它细胞时,才会释放出内毒素,而脂多糖是内毒素的主要成分,具有特别强的热原活性。
热原按检查法可分为两种,一种是内毒素热原,是革兰阴性细菌细胞壁的组分;另一种是非内毒素热原,除内毒素外的热原。
目前热原常用的检测方法主要是家兔法和细菌内毒素检测法(鲎试剂法)。
热原检查法(家兔法)可用于检测上述两种原因产生的热原反应;细菌内毒素检查法只检测产品的细菌内毒素含量。
当前医药工业中普遍接受的观点是:在生产质量管理规范(GMP)条件下控制内毒素污染就等于控制了热原污染,这也是内毒素检查法迅速普及的原因。
热原检查法家兔热原检测法的建立:由于家兔对热原的反应与人基本相似,所以半个世纪以来用家兔来检测热原,为保障药品质量和人类用药安全发挥了重要作用。
目前家兔法仍为各国药典规定的检查热原的法定方法。
《中国药典》2010年版规定的热原检查法系将一定剂量的供试品,静脉注入家兔体内,在规定时间内,观察家兔体温升高的情况,以判定供试品中所含热原的限度是否符合规定。