生活中常见的溶液】酸碱指示剂一
- 格式:doc
- 大小:52.00 KB
- 文档页数:4

常见酸碱指示剂的性质及应用酸碱指示剂是化学实验中常见的一种试剂,它们可以帮助我们判断溶液的酸碱性质。
常见的酸碱指示剂有酚酞、溴酚蓝、甲基橙、酸性橙、那种蓝等。
这些指示剂的性质和应用都不同,下面将分别介绍。
一、酚酞酚酞是一种弱酸性指示剂,它在酸性溶液中为红色,碱性溶液中为无色。
因此,酚酞常被用于中和反应时的指示剂。
例如,我们可以将一些酚酞溶解在氯化钠溶液中,如果该溶液被加入到酸性溶液中,溶液颜色变红时,说明酸性溶液已经中和完毕。
二、溴酚蓝溴酚蓝是一种强酸性指示剂,它在酸性溶液中为黄色,碱性溶液中为蓝色。
溴酚蓝可以用于检测溶液的酸碱性质,也可以用于检测硝酸的浓度。
例如,我们可以将溴酚蓝溶液加入到硝酸溶液中,当溶液颜色变为绿色时,说明硝酸的浓度为0.01mol/L。
三、甲基橙甲基橙是一种弱酸性指示剂,它在酸性溶液中为红色,碱性溶液中为黄色。
甲基橙常被用于检测碳酸盐的存在。
例如,我们可以将一些甲基橙溶解在氯化钠溶液中,如果该溶液被加入到含有碳酸盐的溶液中,溶液颜色变为橙色时,说明溶液中存在碳酸盐。
四、酸性橙酸性橙是一种弱酸性指示剂,它在酸性溶液中为橙黄色,碱性溶液中为黄色。
酸性橙常被用于检测食品中的酸碱度。
例如,我们可以用酸性橙测试葡萄酒的酸度,如果溶液颜色变为橙黄色,说明葡萄酒为酸性饮料。
五、那种蓝那种蓝是一种弱碱性指示剂,它在酸性溶液中为红色,碱性溶液中为蓝色。
那种蓝常被用于检测食品中的酸碱度。
例如,我们可以用那种蓝测试牛奶的pH值,如果溶液颜色变为蓝色,说明牛奶为碱性饮料。
总之,酸碱指示剂在化学实验中起到了至关重要的作用,不同的指示剂可以用于不同的实验室工作。
了解酸碱指示剂的性质和应用,可以帮助我们更好地进行化学实验。

酸碱溶液的鉴别和常见指示剂酸碱溶液是我们在日常生活中经常接触到的化学物质。
为了准确鉴别酸碱溶液的性质,并进行正确的实验操作,我们需要了解一些酸碱溶液的鉴别方法和常见的指示剂。
一、酸碱溶液的鉴别方法1. 颜色鉴别法酸碱溶液在物质的性质上有所不同,这些差异在一些颜色上也有所体现。
通过颜色鉴别法,我们可以初步判断溶液的酸碱性质。
酸性溶液通常是呈现红色、橙色或黄色。
例如盐酸(HCl)、硝酸(HNO3)都是无色透明的,但若与酚酞等指示剂混合,溶液会变为红色。
碱性溶液则会呈现蓝色、绿色或紫色,如氢氧化钠(NaOH)、氨水(NH3)等都呈现淡蓝色。
2. PH试纸法PH试纸也是常用于酸碱溶液鉴别的简便方法。
PH试纸通常是在试纸上涂有各种指示剂,通过试纸在溶液中的变色反应来鉴别酸碱性质。
PH试纸的颜色变化是根据溶液中的氢离子浓度来确定的。
普通的PH试纸通常在4到7之间的酸性溶液下变红,7到9之间的中性溶液无色,9到14之间的碱性溶液则变蓝。
3. 测试导电性由于酸碱溶液中的离子含量不同,其导电性也会有所不同。
我们可以通过导电性测试来初步判断溶液的酸碱性质。
通常来说,酸性溶液和盐溶液能够导电,而纯净水则不会导电。
碱性溶液的导电性也较高,但具体情况还需要根据溶液的离子含量来确定。
二、常见的指示剂指示剂是一种可以改变溶液颜色的化学物质,通过与溶液中某种特定物质发生反应,从而可以鉴别溶液的酸碱性质。
1. 酚酞酚酞是一种常用的酸碱指示剂,它是一种粉末状物质,呈现黄色。
酚酞可以用来鉴别酸性溶液和中性溶液。
当酚酞与酸性溶液混合时,溶液会变为红色。
而当酚酞与中性或碱性溶液混合时,溶液则会保持黄色。
2. 甲基橙甲基橙是另一种常见的酸碱指示剂,它呈现橙色。
甲基橙可以用来区分酸性溶液和碱性溶液。
当甲基橙与酸性溶液混合时,溶液会变为红色。
而当甲基橙与碱性溶液混合时,溶液则会变为黄色。
3. 酚酞与甲基橙混合指示剂酚酞与甲基橙混合指示剂是一种常用的鉴别酸碱溶液的指示剂,它含有酚酞和甲基橙的混合物。

常见酸碱指示剂变色范围及颜色
酸碱指示剂是化学实验中常用的一种工具,用于测试溶液的酸碱性质。
不同的酸碱指示剂在不同酸碱值条件下会发生变色,并且每种指示剂的变色范围与颜色也不同。
本文将会分步骤详细阐述常见酸碱指示剂的变色范围及颜色。
1. 酚酞:酚酞是一种常见的酸碱指示剂,常用于测试弱酸或中性溶液的酸碱性质。
当酚酞与酸性物质反应时,会从白色变成黄色;当酚酞与碱性物质反应时,会从红色变成紫色;而在pH值大约为8.2时,则呈现出深红色的颜色。
2. 甲基橙:甲基橙是另一种常见的酸碱指示剂,常被用于测试弱碱性溶液的酸碱性质。
当甲基橙与酸性物质反应时,会从橙黄色变成淡黄色;当甲基橙与碱性物质反应时,会从橙黄色变成红色。
在pH值为3.1时,化学品呈现出橙黄色,pH值为4.4时呈现出红色。
3. 酸性橙:酸性橙是被广泛使用的酸碱指示剂之一,可用于测试弱酸性溶液的酸碱性质。
当酸性橙与酸性溶液反应时,会呈现出红色;当酸性橙与碱性溶液反应时,则会从橙黄色变成黄色。
在pH值为3.4时,酸性橙呈现出红色,在pH值为4.5时,呈现出橙黄色。
4. 溴酚蓝:溴酚蓝是一个平衡指示剂,常用于测试中性溶液的酸碱性质。
当溴酚蓝与酸性物质反应时,会从蓝色变成黄色;当溴酚蓝与碱性物质反应时,则会从黄色变成蓝色。
在pH值为6.0时呈现出黄色,在pH值为7.6时呈现出蓝紫色。
总体而言,每个酸碱指示剂都有其独特的变色范围和颜色,正确使用和理解仅仅是化学实验和相关学科的基础。
希望本文能够让读者对化学实验有更深刻的理解和认识。



酸碱指示剂变色表
酸碱指示剂是一种能够在酸碱溶液中发生颜色变化的化学物质。
它们的变色机理主要是基于分子结构和酸碱性质的变化。
不同的指示剂在不同的pH值下会呈现出不同的颜色,因此它们被广泛应用于化学实验、水质检测、生物学等领域。
以下是几种常见的酸碱指示剂及其变色范围:
1. 酚酞指示剂:pH 范围为 8.0-10.0,由无色变为红色。
2. 甲基橙指示剂:pH 范围为
3.1-
4.4,由红色变为黄色。
3. 酚酞红指示剂:pH 范围为 6.8-8.4,由黄色变为红色。
4. 甲基红指示剂:pH 范围为 4.2-6.3,由红色变为黄色。
5. 甲基紫指示剂:pH 范围为 0.0-1.6,由黄色变为紫色。
6. 酚酸指示剂:pH 范围为
7.2-9.8,由无色变为蓝色。
7. 酸性橙指示剂:pH 范围为 3.5-4.5,由橙色变为黄色。
8. 碘化钾淀粉指示剂:pH 范围为 5.0-7.0,由蓝色变为无色。
以上指示剂变色表仅供参考,实际使用时应根据具体的实验要求进行选择。
同时,在使用指示剂时也应注意其对溶液的影响,尽量减少指示剂的使用量,以免产生误差。
- 1 -。

常见的酸碱指示剂有哪些酸碱指示剂是在酸碱中发生颜色变化的化学物质,广泛应用于化学实验和工业生产中。
它们的作用是通过改变溶液的颜色来指示溶液的酸碱性质。
常见的酸碱指示剂有以下几种:1. 酚酞酚酞是最常见的一种酸碱指示剂,它呈现红色和无色两种状态。
在酸性溶液中呈现红色,而在中性和碱性溶液中则呈现无色。
它广泛应用于酸碱中和反应的检测和分析。
2. 酸性甲基橙酸性甲基橙是一种在酸性溶液中呈现红色,而在中性和碱性溶液中则呈现橙色的指示剂。
它常用于测定碱的滴定过程中。
3. 甲基红甲基红是一种在酸性溶液中呈现红色,而在碱性溶液中则呈现黄色的指示剂。
它广泛应用于测定酸的滴定和其他酸碱性质的实验中。
4. 甲基橙甲基橙是一种在酸性溶液中呈现红色,而在中性和碱性溶液中则呈现黄色的指示剂。
它常用于测定酸的滴定和其他酸碱反应的检测。
5. 甲基紫甲基紫是一种变色范围较广的指示剂,它在酸性溶液中呈现红色,而在中性和碱性溶液中则呈现蓝色。
它通常应用于测定碱的滴定过程。
6. 金黄色试纸金黄色试纸是一种特殊的酸碱指示剂,它是一种通过颜色变化来指示酸碱性质的试纸。
它在酸性溶液中会变红,而在碱性溶液中则会变蓝。
它常用于快速检测液体或物质的酸碱性质。
除了以上提到的几种常见酸碱指示剂,还有许多其他的指示剂,如苏丹红、溴酚蓝、溴酚绿等,它们在不同的酸碱范围内呈现不同的颜色变化,可以根据实验需要选择合适的指示剂。
总结起来,常见的酸碱指示剂有酚酞、酸性甲基橙、甲基红、甲基橙、甲基紫和金黄色试纸等。
选择适合的指示剂可以帮助我们准确地判断溶液的酸碱性质,在化学实验和工业生产中具有重要的应用价值。

常见酸碱指示剂酸碱指示剂是一种可以通过颜色的变化来显示溶液酸碱度的化学物质。
它们常常被广泛应用于化学实验室、工业生产和日常生活中。
本文将介绍几种常见的酸碱指示剂,包括酚酞、酸性紫、甲基红、溴蓝等,它们的特点、用途以及颜色变化规律。
1. 酚酞酚酞是一种常用的酸碱指示剂,常见于酸性溶液中。
它的颜色在酸性环境下为无色或淡黄色,而在碱性环境下则呈现出明亮的红色。
酚酞的pH范围通常在8.2至10.0之间,因此可以用于检测中等碱性的溶液。
2. 酸性紫酸性紫是另一种常见的酸碱指示剂,广泛应用于中强酸性环境。
在酸性溶液中,酸性紫呈现出红色或洋红色;而在碱性环境中则变为黄色或橙黄色。
它的pH范围通常在1.0至2.8之间,因此适用于测定中强酸性溶液的酸碱性。
3. 甲基红甲基红是一种常见的变色范围较宽的酸碱指示剂。
在酸性环境中,甲基红呈现出橙红色;而在碱性环境中则变为黄色。
甲基红的pH范围通常在4.4至6.2之间,因此广泛用于中等酸碱度的溶液检测。
4. 溴蓝溴蓝是一种比较强的碱性指示剂,常用于检测碱性溶液的酸碱度。
在碱性环境中,溴蓝呈现出鲜艳的蓝色或蓝绿色;而在酸性环境中则变为黄色或橙黄色。
溴蓝的pH范围通常在6.0至7.6之间。
需要注意的是,不同的酸碱指示剂对应的颜色变化规律和pH范围是不同的。
因此,在实际应用中,我们需要根据不同指示剂的特点选择合适的指示剂来检测溶液的酸碱性。
此外,酸碱指示剂通常会受到温度、浓度和溶液颜色的影响,因此在实验和工业生产中使用时需要注意这些因素的影响。
总结:通过上述介绍,我们了解了几种常见的酸碱指示剂及其特点。
酸碱指示剂的选择必须根据溶液的pH范围来确定,以确保准确的酸碱度测量。
在实际应用中,酸碱指示剂对颜色的变化十分敏感,可以通过观察颜色的变化来判断溶液的酸碱性。
酸碱指示剂在化学实验室、工业生产和日常生活中都起到了重要的作用,帮助我们更好地了解和掌握酸碱性质。


酸碱指示剂的变色原理---专题简介原创:SOSO问问精益求精团队。
小虾编辑整理及扩充人们在实践中发现,有些有机燃料在不同的酸碱性溶液中能显示不同的颜色。
于是,人们就利用它们来确定溶液的pH。
这种借助其颜色变色来指示溶液pH的物质叫做酸碱指示剂。
石蕊酸碱指示剂一般是有机弱酸或有极弱碱。
它们的变色原理是由于其它分子和电离出来的离子的结构不同,因此分子和离子的颜色也不同。
在不同pH的溶液里,由于其分子浓度和离子浓度的比值不同,因此显示出来的颜色也不同。
例如,石蕊是一种有机弱酸,它是由地衣值得的一种蓝色色素。
如果用HIn代表石蕊分子,HIn在水中发生下列电离:HIn(红色[酸色])←=→H++In-(蓝色[碱色])(注:←=→代表可逆符号,下同)石蕊什么情况下变色?在酸性溶液里,分子是其存在的主要形式,使溶液呈红色;(由于[H+]增大,平衡向左移)在碱性溶液里,石蕊水解发生的电离平衡向右移动,电离产生的酸根离子是其存在的主要形式,故使溶液呈蓝色;(由于[OH-]增大,平衡右移)在中性溶液里,分子和酸根离子共存,因而溶液呈紫色。
([HZ]=[Z-])遇酸变红PH<5.0遇碱变蓝PH>8.0石蕊是什么物质?石蕊蓝紫色粉末。
是从植物中提取得到的蓝色色素,能部分地溶解于水而显蓝色。
石蕊是一种常用的指示剂,变色范围是pH5.0—8.0之间。
石蕊起指示剂作用是由于石蕊中含石蕊精(C7H7O4N)的原因。
其原理是石蕊也是一种弱酸在中性溶液中:[HZ]=[Z-]在酸性溶液中:由于[H+]则大,平衡向左移,溶液呈红色。
在碱性溶液中:由于[OH-]增大,平衡右移,则溶液呈蓝色。
[石蕊试液的配制] (1)先用热酒精溶解去除杂质,把酒精倾去。
(2)加水溶解石蕊,搅拌、静置、过滤。
(3)滤液稀释至1%即得石蕊试液。
石蕊(shirei)(Cladonia)地衣门、石蕊科中的石蕊属。
种类多。
地衣体壳状至鳞片状,并从地衣体上长出空心的果柄,不分枝或具多分枝。
生活中的酸和碱一、知识点酸碱指示剂和溶液酸碱度的表示方法—pH1.常用的酸碱指示剂有紫色石蕊试液和无色酚酞试液,它们与酸、碱溶液作用时显示的颜色如下表:(1)pH<7时,溶液显酸性,pH越小,酸性越强。
(2)pH>7时,溶液显碱性,pH越大,碱性越强。
(3)pH=7时,溶液显中性。
【要点诠释】1.测定溶液pH的方法:用玻璃棒蘸取待测溶液滴在pH试纸上,将试纸显示的颜色与标准比色卡对照便可知道待测溶液的pH值。
2.溶液的稀释与溶液pH的关系:(1)酸性溶液pH小于7。
向溶液中加入水,溶液的溶质质量分数减小,酸性减弱,溶液的pH增大,但不会增大到7(酸性溶液加水还是酸,不会变成中性,所以pH不会增大到7)。
(2)碱性溶液pH大于7。
向溶液中加入水,溶液的溶质质量分数减小,碱性减弱,溶液的pH减小,但不会减小到7(碱性溶液加水还是碱,不会变成中性,所以pH不会减小到7)。
二、精选练习题知识点、酸碱指示剂和溶液酸碱度的表示方法—pH【典例】1.在化学课上老师为同学们做了一个“液体变色”魔术,杯子底涂抹了某种无色液体M,先向杯子中加入少量无色液体N,杯中液体马上变为红色,继续加入无色液体N,杯中液体又变为无色。
下列说法正确的是()A.M是无色酚酞,N是氢氧化钠B.M是紫色石蕊,N是稀盐酸C.M是氢氧化钠,N是无色酚酞和稀盐酸D.M是稀盐酸和无色酚酞,N是氢氧化钠2.如图是a、b、c三种液体对应的近似pH。
下列判断正确的是()A.a溶液不可能是稀盐酸B.b一定是水C.c一定是碱D.c可使紫色石蕊溶液变蓝【变式训练】1.下列操作能使pH=11.6的饱和碳酸钠溶液的pH增大的是()A.向溶液中加稀盐酸B.向溶液中加水C.恒温蒸发溶剂D.向溶液中加pH=13的氢氧化钠溶液2.如图所示,向四种溶液中加入指示剂,其中pH最小的试剂是()A.A B.B C.C D.D3.取含有显色物质的植物切碎捣烂,用酒精浸制,所得的浸出液可以作为酸碱指示剂。
初三化学酸碱指示剂知识点
知识点是网络课程中信息传递的基本单元,研究知识点的表示与关联对提高网络课程的.学习导航具有重要的作用。
下面为大家带来初三化学酸碱指示剂知识点,快来看看吧。
1.酸碱指示剂(简称:指示剂)能跟酸或碱的溶液起作用而显示不同的颜色。
常见的有:石蕊溶液、酚酞溶液。
2.变色规律:
石蕊溶液遇酸溶液变成红色,遇碱溶液变成蓝色。
酚酞溶液遇酸溶液不变色,遇碱溶液变成红色。
3.二氧化碳通入紫色的石蕊试液中,
(1).溶液由紫色变成红色。
(2).二氧化碳溶于水生成了碳酸,是碳酸改变了溶液的颜色。
4.用酸碱指示剂检验溶液的酸碱性的方法:
(1)取少量该溶液,滴入几滴石蕊试液,若溶液呈现红色,则说明该溶液为酸性溶液。
(2)取少量该溶液,滴入几滴石蕊试液,若溶液呈现蓝色;或者滴入几滴无色的酚酞试液,若溶液呈现红色,则说明该溶液为碱性溶液。
【初三化学酸碱指示剂知识点】。
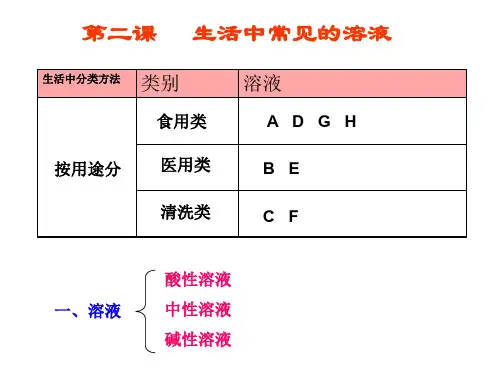
生活中常见的溶液
常见的酸碱指示剂(一)
上海市娄山中学刘季宏一、教学目标
1.知道对溶液的科学分类可以按照其酸碱性分为酸性、碱性和中性溶液。
2.认识实验室常用的两种指示剂:石蕊和酚酞遇不同酸碱性溶液的变色情况。
3.懂得要移取少量的溶液进行酸碱性测定而不能污染待测溶液。
4.学会用石蕊和酚酞判断和区分溶液的酸碱性,认识常见的酸性溶液和碱性溶液。
5.了解指示剂发现过程中所体现的科学精神,激发从生活中发现不同的指示剂。
二、重点与难点
【重点】1.学会用石蕊和酚酞两种指示剂判断溶液的酸碱性。
【难点】1.正确记录石蕊和酚酞遇不同酸碱性溶液的颜色变化。
2.实验操作中防止对待测溶液的污染和指示剂滴管的交叉污染。
三、教学准备
【器材】
活动一:生活中的一些溶液图片。
活动二:紫色石蕊试液、无色酚酞试液、试管架、小试管6、2试管酸性溶液(稀盐酸)、2试管中性溶液(蒸馏水)、2试管碱性溶液(稀氢氧化钠)。
活动三:紫色石蕊试液、无色酚酞试液、试管架、小试管3、溶液A(稀盐酸或稀硫酸)、溶液B(稀氢氧化钠或石灰水)、溶液C(蒸馏水)、学生自带待测溶液2-3种。
【资源】
活动三:补充实验报告
活动四:PPT课件。
四、内容组织
【教学流程】
【活动设计】
活动一:对生活中一些溶液的分类
活动目标:
1.学会将已有的关于溶液的知识和经验进行归类。
活动二:石蕊和酚酞试液的变色
活动目标:
1.通过实验操作,认识石蕊和酚酞两种常用试液遇不同酸碱性的溶液的颜色变化。
活动三:判断溶液的酸碱性
活动目标:
1.学会用石蕊和酚酞判断和区分溶液的酸碱性。
2.通过自主探究,认识生活中常见的酸性溶液和碱性溶液。
活动四:酸碱指示剂的发现与应用
活动目标:
了解指示剂的发现过程,激发从生活中发现不同的指示剂。
五、训练与评价
【举例】“补充实验报告”(见附件1、2)
【说明】
1.建议使用2课时完成本节教学,两种试液与pH试纸的使用分开,比较有利于学生认识
溶液的酸碱性与酸碱性的强弱(酸碱度)。
也避免实验中溶液种类太多造成混乱。
2.“补充实验报告”是为学生自主探究提供比较科学的实验报告示范。
3.让学生自带溶液是体会“身边有形形色色的溶液”,按照溶液的酸碱性可将这些生活中常见的溶液分类。
也满足学生应用所学方法进行自主探究的兴趣。
附件(补充实验报告)
判断常见溶液的酸碱性
小组同学自带的溶液有:。
我们用于测定溶液酸碱性的指示剂是:。
我们测定这些溶液是酸性溶液,理由是:。
我们测定这些溶液是碱性溶液,理由是:。
我们测定:是中性溶液,理由是:。
通过实验,我学会了:
通过实验,我得出的结论是:。