酸碱指示剂和常见的酸
- 格式:ppt
- 大小:2.48 MB
- 文档页数:29


常见的酸和碱一、酸碱指示剂 1、指示剂的概念能跟酸或碱的溶液起作用而显示不同的颜色的物质,叫酸碱指示剂,通常也简称指示剂。
常见的有:石蕊溶液、酚酞溶液。
2、变色规律:说明:①指示剂变色简记方法:酚酞遇酸仍无色,酚酞遇碱红艳艳;石蕊遇酸紫变红,石蕊遇碱紫变蓝②注意:酸性溶液或碱性溶液可使指示剂变色,而不是说指示剂使酸性溶液或碱性溶液变色。
3、指示剂的应用酸碱指示剂主要用来检验溶液的酸碱性,如实验桌上有一瓶失去标签的液体要检验是酸性溶液还是碱性溶液,可用试管取少量溶液滴入1-2滴紫色石蕊试液,如果显红色证明是酸性溶液,如果显示蓝色证明是碱性溶液。
4、如何用酸碱指示剂检验溶液的酸碱性?检验溶液是酸性的方法:取少量该溶液,滴入几滴石蕊试液,若溶液呈现红色,则说明该溶液为酸性溶液。
检验溶液为碱性的方法:取少量该溶液,滴入几滴石蕊试液,若溶液呈现蓝色;或者滴入几滴无色的酚酞试液,若溶液呈现红色,则说明该溶液为碱性溶液。
练习:⒈失去标签的三瓶无色液体,分别是稀H2SO4、蒸馏水、NaOH 溶液,能把它们一次性区分开的试剂是()A. 酚酞B. 铁片C. 石蕊试液D. 二氧化碳气体⒉失去标签的三瓶无色液体,分别是稀HCl 、蒸馏水、NaOH 溶液,能否用酚酞试液将它们鉴别出来?(提示:HCl + NaOH=NaCl + H 2O (中性溶液)) 二、常见的酸1、浓硫酸、浓盐酸的物理性质的比较气味有刺激性气味无气味密度 1.19g/mL 1.84g/mL用途重要化工产品。
用于金属表面除锈、制造药物(如盐酸麻黄素、氯化锌)等;人体胃液中有盐酸,可帮助消化。
重要化工原料。
用于生产化肥、农药、火药、染料以及冶炼金属、精炼石油和金属除锈等。
浓硫酸有吸水性,在实验室中常用它做干燥剂。
2、浓硫酸的特性实验放置一会儿后的现象脱水性用玻璃棒蘸浓硫酸在纸上写字纸上出现黑色字迹浓硫酸能夺取含碳、氢、氧等元素组成的化合物里的“水分”( 氢、氧元素 ), 生成黑色的炭和水。

第十单元酸和碱课题1 常见的酸和碱本课题在知识结构上分为三部分:首先,从酸碱指示剂的实验,简单地反映酸和碱能与指示剂反应并显示不同的颜色,从而说明酸和碱作为不同类物质具有不同的性质,使学生对酸和碱有一些初步的认识,会用指示剂区分酸和碱,并通过探究,学生能够用花瓣、果实自制酸碱指示剂,并通过实验验证它们在酸碱溶液中的颜色变化,使学生感到化学知识和生活实际是紧密相连的。
第二部分具体介绍几种常见的酸和碱,通过探究,分别总结酸碱的腐蚀性等性质和用途,并通过复习总结的方式,简单归纳几种酸和碱各自的相似化学性质。
第三部分在学生对酸和碱的性质有了一些认识后,通过酸和碱溶液的导电实验,来说明酸和碱为什么会具有一些共同的性质,并能从解离的角度简单了解酸碱的定义。
第1课时酸碱指示剂和常见的酸【教学目标】1.知识与技能(1)了解常见酸碱指示剂及其变色情况。
(2)了解几种常见的酸及酸的通性。
(3)认识浓硫酸的腐蚀性。
2.过程与方法(1)进一步认识和体验科学探究的过程。
(2)运用实验的方法获取信息,运用比较概括的方法对获取的信息进行加工。
3情感态度与价值观增强对化学现象的探究欲,培养善于合作、勤于思考的科学精神。
【教学重点】1.运用酸碱指示剂检验溶液的酸碱性。
2.浓硫酸的腐蚀性。
3.酸的化学性质。
【教学难点】1.酸碱指示剂的变色情况。
2.酸的化学性质。
【教具准备】白醋、苹果汁、石灰水、盐酸、氢氧化钠溶液、酚酞溶液、石蕊溶液、试管(若干)、牵牛花、万寿菊、蝴蝶兰花、玫瑰、月季、紫甘蓝、硫酸、玻璃棒等。
【导入新课】在日常生活中,你听说过、接触过酸和碱吗?【交流回答】接触过的酸有:碳酸、醋酸、盐酸、硫酸;碱有:氨水、石灰水、烧碱。
【提出问题】用什么较简单的方法区分酸和碱呢?【展示交流】请同学们做教材P50实验10-1,交流实验结果。
【阅读记忆】请同学们阅读并理解教材P51内容,归纳什么叫指示剂?指示剂遇酸和碱溶液变色有什么规律?【阅读回答】石蕊试液遇酸溶液变红,遇碱溶液变蓝;酚酞溶液遇酸溶液不变色,遇碱溶液变红。






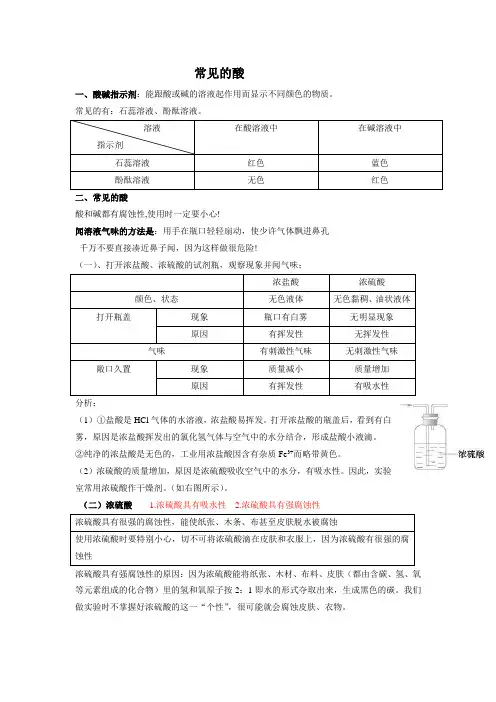
常见的酸一、酸碱指示剂:能跟酸或碱的溶液起作用而显示不同颜色的物质。
常见的有:石蕊溶液、酚酞溶液。
溶液 指示剂在酸溶液中在碱溶液中石蕊溶液 红色 蓝色 酚酞溶液无色红色二、常见的酸酸和碱都有腐蚀性,使用时一定要小心!闻溶液气味的方法是:用手在瓶口轻轻扇动,使少许气体飘进鼻孔 千万不要直接凑近鼻子闻,因为这样做很危险!(一)、打开浓盐酸、浓硫酸的试剂瓶,观察现象并闻气味;浓盐酸 浓硫酸 颜色、状态无色液体 无色黏稠、油状液体打开瓶盖现象 瓶口有白雾 无明显现象 原因有挥发性 无挥发性 气味有刺激性气味 无刺激性气味 敞口久置现象 质量减小 质量增加 原因有挥发性有吸水性分析:(1)①盐酸是HCl 气体的水溶液,浓盐酸易挥发。
打开浓盐酸的瓶盖后,看到有白雾,原因是浓盐酸挥发出的氯化氢气体与空气中的水分结合,形成盐酸小液滴。
②纯净的浓盐酸是无色的,工业用浓盐酸因含有杂质Fe 3+而略带黄色。
(2)浓硫酸的质量增加,原因是浓硫酸吸收空气中的水分,有吸水性。
因此,实验室常用浓硫酸作干燥剂。
(如右图所示)。
(二)浓硫酸 1.浓硫酸具有吸水性 2.浓硫酸具有强腐蚀性 浓硫酸具有很强的腐蚀性,能使纸张、木条、布甚至皮肤脱水被腐蚀使用浓硫酸时要特别小心,切不可将浓硫酸滴在皮肤和衣服上,因为浓硫酸有很强的腐蚀性浓硫酸具有强腐蚀性的原因:因为浓硫酸能将纸张、木材、布料、皮肤(都由含碳、氢、氧等元素组成的化合物)里的氢和氧原子按2:1即水的形式夺取出来,生成黑色的碳。
我们做实验时不掌握好浓硫酸的这一“个性”,很可能就会腐蚀皮肤、衣物。
稀释浓硫酸的正确步骤:在稀释浓硫酸时,一定要把浓硫酸沿器壁慢慢注入水里,并不断搅拌。
切不可把水倒入浓硫酸里。
不慎将硫酸沾到皮肤或衣服上的处理方法:应立即用大量水冲洗,再涂上3%~5%的碳酸氢钠溶液。
涂上碳酸氢钠溶液的目的是把稀硫酸中和掉-----生成无腐蚀性的物质。
(三)、酸的化学性质1.酸能与酸碱指示剂反应:紫色石蕊试液在酸溶液中变红,无色酚酞不变色。

酸和碱溶液的鉴别方法在化学实验室中,酸和碱溶液的鉴别是一项基础而重要的实验操作。
正确的酸碱溶液鉴别方法可以帮助我们准确判断溶液的性质,从而确保实验的准确性和安全性。
本文将介绍一些常见的酸和碱溶液鉴别方法。
1. 酸碱指示剂法酸碱指示剂法是一种简单有效的鉴别酸碱的方法。
酸碱指示剂通常是一种有机化合物,会在不同pH值的溶液中显示出不同的颜色。
常用的酸碱指示剂包括酚酞、溴酚蓝、甲基橙等。
我们可以将少量待测溶液滴在白色滤纸上,再滴上几滴酸碱指示剂,观察溶液的颜色变化。
如果溶液变红或者红色加深,则为酸性;如果溶液变蓝或者蓝色加深,则为碱性。
2. pH试纸法pH试纸法是一种常用的酸碱溶液鉴别方法。
pH试纸是一种特殊的纸条,上面涂有酸碱指示剂。
我们可以将pH试纸浸入待测溶液中,然后将其从溶液中取出,观察试纸上的颜色变化。
根据颜色变化与标准颜色比对,可以确定溶液的酸碱性。
颜色与酸度或碱度之间的关系可以通过参考试纸包装或相关的文献资料获得。
3. 酞菁试剂法酞菁试剂法是一种用于鉴别酸碱的经典方法。
这种方法基于酞菁化合物对酸碱溶液的显色反应。
我们可以将待测溶液滴在白色滤纸上,再滴上几滴酞菁试剂,观察溶液的颜色变化。
如果溶液变红,则为酸性;如果溶液变绿,则为碱性。
酞菁试剂法的优点是对于某些中性溶液也可以产生显色反应,因此可以用于判断溶液的中性。
4. 水合物生成法水合物生成法是一种常用的鉴别酸碱的方法。
某些酸、碱具有和水反应生成水合物的特性。
我们可以将待测溶液滴在反应容器中,再滴加一定量的水或者指定的水合物试剂。
观察反应后是否生成结晶或颜色变化,以确定溶液的酸碱性。
例如,将碳酸氢钠溶液滴加到硝酸银溶液中,会观察到白色沉淀的生成,这是碳酸氢钠和硝酸银反应生成的水合物白色沉淀。
5. pH计测定法pH计测定法是一种精确鉴别酸碱的方法。
pH计是一种能够测量溶液酸碱性的仪器。
我们可以将待测溶液倒入pH计中,通过测量溶液的pH值来判断酸碱性。
酸和碱是中考重难点、必考点,主要考察酸碱的化学性质及应用、溶液的酸碱性、浓硫酸的稀释、酸碱性质的探究实验、pH 及其应用等,试题体现理论联系实际,综合性、探究性题目比重增加,对知识迁移、灵活应用的能力要求不断加强。
1、酸碱指示剂实验:将紫色石蕊溶液和无色酚酞溶液分别滴加在不同的溶液中,如下表所示酸碱指示剂:石蕊和酚酞溶液叫酸碱指示剂,也简称指示剂,石蕊和酚酞是两种常见的指示剂,它们在酸碱中的变色情况如下表说明:酸碱指示剂是从植物的花瓣或果实中提取的一些植物的花瓣或果实提取液,只要在不同的酸碱溶液中显示不同的颜色,都可作酸碱指示剂使用。
2、盐酸和硫酸的物理性质及用途知识要点注意:①纯净的盐酸伪无色液体,工业盐酸因含杂质(如Fe3+)而显黄色②盐酸易挥发,瓶口出现白雾,这是由于挥发出来的氯化氢气体与空气中的水蒸气接触,又形成盐酸小液滴③浓硫酸有吸水性,吸收空气中的水蒸气,使溶质的质量分数减小,没有生成新物质,是物理变化④由于盐酸具有挥发性,硫酸具有吸水性,所以实验室必须密封保存3、浓硫酸的腐蚀性【材料】2004年3月的某一天,在某中学发生了一起骇人听闻的事件。
一名年轻妇女为报复某学生家长,竟然向该学生脸上泼洒了浓硫酸,造成该学生面容被毁,酿成一桩悲剧的发生,那么浓硫酸为什么能会坏人的面容,它具有什么特性呢?【总结】浓硫酸具有强烈的腐蚀性,能将皮肤(由碳、氢、氧元素组成的化合物)里的氢、氧元素按水的组成比脱去,生成黑色的炭。
【扩展】①浓硫酸不但脱去皮肤的氢、氧元素,而且也可以脱去纸张、木材、布料中的氢、氧两种元素,这种作用又叫脱水性②浓硫酸的脱水性是化学变化过程,区别于浓硫酸的吸水性。
脱水性是原物质中没有水,只是将原物质中的氢、氧两种元素按水的组成比脱去。
4、浓硫酸的稀释【注意】稀释浓硫酸时一定要把浓硫酸沿着器壁慢慢地注入水中,并不断搅动,使产生的热量迅速扩散。
切不可把水倒进浓硫酸里,如果将水倒进浓硫酸里,由于水的密度小,浮在浓硫酸的上面,硫酸溶解时放出大量的热不易散失,使水暴沸,带着酸四处飞溅。
九年级上化学—常见酸及酸的化学性质知识点一:酸碱指示剂1.定义:能跟酸或碱的溶液起反应而显示不同颜色的物质2.常见酸碱指示剂:紫色的石蕊溶液和无色的酚酞溶液【实验】探究酸碱指示剂遇酸、碱的颜色变化【实验步骤】将8支试管分成两组,每组的4支试管中分别加入少量白醋,苹果汁,石灰水和氢氧化钠溶液。
向其中一组试管中加入紫色石蕊溶液,向另一组试管中加入无色酚酞溶液,观察现象。
【实验现象】如下表所示:加入紫色石蕊溶液后的颜色变化加入无色酚酞溶液后的颜色变化白醋变红色不变色苹果汁变红色不变色石灰水变蓝色变红色氢氧化钠变蓝色变红色【实验结论】酸能使紫色石蕊溶液变成红色,不能使无色酚酞溶液变色;碱能使紫色石蕊溶液变成蓝色,使无色酚酞溶液变成红色。
酸和碱能与指示剂反应,而使指示剂显示不同的颜色。
3.石蕊溶液和酚酞溶液在酸碱性不同的溶液中的变色情况如下表所示:酸性溶液碱性溶液中性溶液紫色石蕊溶液变红色变蓝色不变色(紫色)无色酚酞溶液不变色(无色)变红色不变色(无色)注意:①酸碱指示剂遇到酸、碱变色是化学变化,变色的物质是指示剂,不是酸或碱。
例如:盐酸能使紫色石蕊溶液变红可以说紫色石蕊溶液遇盐酸变红,但不能说紫色石蕊溶液使盐酸变红。
②不溶于水的酸或碱不能使指示剂变色。
例如:氢氧化铜、氢氧化铁等是难溶于水的碱,它们不能使无色酚酞溶液变红。
③酸碱指示剂是从植物的花瓣或果实中提取的汁液,只要在酸碱性不同的溶液中显示不同的颜色,就可作酸碱指示剂。
④某溶液滴入无色酚酞溶液不变色,该溶液不一定是酸性溶液,也可能是中性溶液,如:氯化钠溶液。
⑤不能用指示剂来证明某溶液是酸或碱的溶液,只能说明溶液显酸性或碱性。
【平步氢云】【★☆☆】1.取四朵用石蕊溶液染成紫色的纸花,分别喷洒下列液体,能观察到纸花变红的是()A.氢氧化钠溶液B.稀盐酸C.蒸馏水D.食盐水【★☆☆】2.使酚酞试液变红色的溶液,能使紫色石蕊试液()A.变红色B.变蓝色C.变无色D.不变色【★☆☆】3.下列物质呈酸性的是()A.柠檬水B.肥皂水C.石灰水D.浓氨水【★☆☆】4.“雪碧”是一种无色的碳酸饮料,将少量的“雪碧”滴入紫色石蕊试液中,然后再加热,溶液颜色的变化是()A.先变蓝后变紫B.变红后颜色不再改变C.先变无色后变红D.先变红后变紫色【★☆☆】5.(双选)用酒精和水浸泡蝴蝶兰花可得到紫色溶液,该溶液遇酸溶液显红色,遇碱溶液显黄色。