高三复习全部专题教案及课件离子反应
- 格式:doc
- 大小:143.50 KB
- 文档页数:8





高三复习全部专题教案及课件第二讲:离子反应子«新课标»高三化学〔人教版〕第一轮复习单元讲座第二章化学物质及其变化第二讲离子反应教学目标:1.明白酸、碱、盐在溶液中能发生电离,通过实验事实认识离子反应及其发生的条件。
2.了解常见离子的检验方法。
复习重点、难点:离子反应及其发生的条件。
课时安排:两课时______________________。
2;电离指电解质_____________,电离过程不需要通电。
3.酸、碱、盐的电离酸:电离时,_____________的化合物。
碱:电离时,_____________的化合物。
盐:电离时,能生成___________的化合物。
;4.写出以下物质在水溶液中的电离方程式。
(1)HCl:______________;(2)NaN03:_____________;(3)Ba(OH)2:____________;(4)CH3COOH:____________;(5)Cu(OH)2:____________;(6)H2S03:_____________。
5.(1)电解质;在______或______能够导电的化合物。
(2)非电解质:在______或______都不能导电的(3)强电解质:在___________的电解质(4)弱电解质:在___________的电解质6.离子反应指__________、___________之间发生的反应差不多上离子反应。
7.(1)离子反应可用_______表示,离子方程式和化学方程式一样,也是描述化学反应的一种_______。
(2)离子方程式和化学方程式都能描述_______,但离子方程式的描述更加_____,所表示的已__________,__________,并揭示了这类化学反应的__________。
8.书写以下反应的离子方程式:(1)NaOH溶液和H2S04溶液反应:___________;(2)NaCl溶液和AgNO3溶液:____________。

专题五离子反应[考纲要求] 1.了解电解质的概念,了解强电解质和弱电解质的概念。
2.理解离子反应的概念、离子反应发生的条件,了解常见离子的检验方法。
3.能正确书写化学方程式和离子方程式,能判断某些离子在溶液中是否能够大量共存。
考点一电解质和非电解质1.电解质在__________________能够导电的化合物叫作电解质。
2.非电解质在________________________都不能导电的化合物叫作非电解质。
问题思考1.(1)固体食盐不导电,它是电解质吗?(2)盐酸和金属铜都能够导电,是电解质吗?是非电解质吗?为什么?2.CO2、NH3、SO3的水溶液能够导电,为什么它们不是电解质呢?3. 常见的电解质常见非电解质4.强电解质和弱电解质强电解质与弱电解质的比较强电解质弱电解质概念溶于水后____电离的电解质溶于水后______电离的电解质化合物类型____化合物、____化合物____化合物电离程度____电离____电离溶液中存在的溶质的微粒只有电离出的__________,不存在________既有电离出的__________,又有电解质分子实例问题思考3.强电解质的饱和溶液导电能力一定很强吗?一定比弱电解质溶液导电能力强吗?影响溶液导电性强弱的因素有哪些?4.AgCl、BaSO4、CaCO3等均难溶于水,它们是弱电解质吗?CH3CH2OH、CH3COOH 等均易溶于水,它们是强电解质吗?试总结电解质的强弱与其溶解性的关系。
4.电离及电离方程式(1)电离:电解质在熔融状态或在水溶液中产生________的过程。
(2)电离方程式①强电解质用“________”连接,如H2SO4:______ __,Ca(OH)2 。
弱电解质(包括弱酸的酸式酸根离子)用“________”连接,如CH3COOH:______________。
②多元弱酸分步电离,如H2CO3:__________________________________________________________________________________________________________________。



高三化学第二节离子反应教案教案(精选3篇)教案一:离子反应基础概念教学教学目标:1. 理解离子反应的基本概念;2. 掌握离子的定义和离子配位数的概念;3. 能够根据给出的化学方程式判断离子反应的类型。
教学准备:1. 复习离子的基本概念和离子配位数的概念;2. 准备相关的离子反应化学方程式。
教学过程:Step 1:引入离子反应的概念1. 通过实验现象让学生认识到离子反应的存在,如氯化银溶液与硝酸钠溶液反应生成沉淀;2. 引导学生思考为什么会发生这样的反应,引出离子反应的概念。
Step 2:复习离子的定义和离子配位数1. 复习离子的定义和命名;2. 复习离子配位数的概念,通过画出离子的路线图让学生理解离子配位数的含义。
Step 3:判断离子反应的类型1. 介绍离子反应的四种类型:析出反应、置换反应、氧化还原反应、酸碱中和反应;2. 通过给出离子反应的化学方程式让学生判断其类型。
教学延伸:通过实验现象或者化学方程式的练习,让学生进一步巩固离子反应的基本概念和判断类型的能力。
教案二:离子反应实验操作演示教学目标:1. 了解离子反应实验的基本操作步骤;2. 掌握离子反应实验的观察指标和结果判断。
教学准备:1. 准备离子反应实验所需的药品和试剂;2. 准备实验设备和实验器材。
教学过程:Step 1:实验操作演示1. 展示离子反应实验所需的药品和试剂;2. 讲解实验的操作步骤,包括反应物的称取和混合、搅拌、观察结果等。
Step 2:观察指标和结果判断1. 指导学生观察反应的现象和产物的性质;2. 引导学生根据观察到的现象和产物的性质判断反应是否发生,以及发生了什么类型的离子反应。
教学延伸:指导学生自主进行离子反应实验,通过观察现象和产物的性质来判断反应类型。
教案三:离子反应的反应平衡和溶解度积教学目标:1. 理解离子反应的反应平衡和溶解度积的概念;2. 掌握计算溶解度积的方法;3. 能够根据溶解度积判断溶液中的离子是否会产生沉淀。

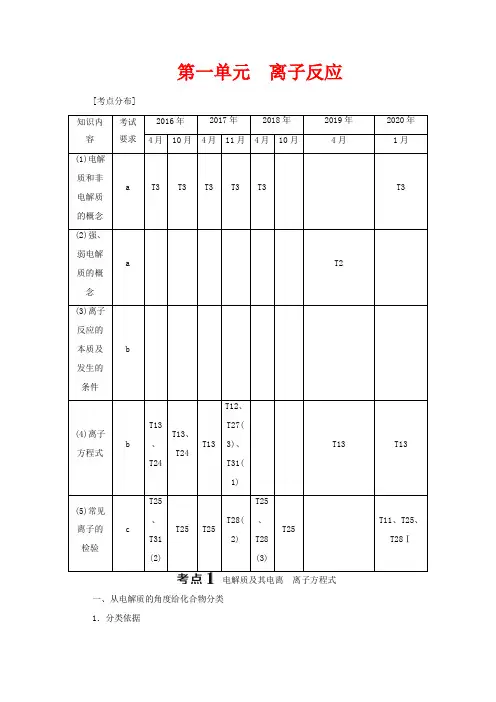
第一单元离子反应[考点分布]知识内容考试要求2016年2017年2018年2019年2020年4月10月4月11月4月10月4月1月(1)电解质和非电解质的概念a T3 T3 T3 T3 T3 T3(2)强、弱电解质的概念a T2(3)离子反应的本质及发生的条件b(4)离子方程式bT13、T24T13、T24T13T12、T27(3)、T31(1)T13 T13(5)常见离子的检验cT25、T31(2)T25 T25T28(2)T25、T28(3)T25T11、T25、T28Ⅰ电解质及其电离离子方程式一、从电解质的角度给化合物分类1.分类依据2.电解质的强弱与物质类别的关系3.电解质和非电解质的比较1.电解质的电离电离是指电解质在水溶液中或熔融状态下产生自由移动离子的过程。
2.电离方程式的书写(1)强电解质的电离方程式中,用“===”连接,弱电解质(包括弱酸的酸式酸根)的电离方程式中,用“”连接。
如Na2SO4:Na2SO4===2Na++SO2-4,HClO:HClO H++ClO-。
(2)多元弱酸的电离分步书写,多元弱碱的电离一步写完。
如H2CO3:H2CO3H++HCO-3,HCO-3H++CO2-3__;Fe(OH)3:Fe(OH)3Fe3++3OH-。
(3)酸式盐的电离:多元强酸酸式盐与多元弱酸酸式盐的阴离子电离情况不同。
如NaHSO4溶液中:NaHSO4===Na++H++SO2-4__;NaHCO3溶液中:NaHCO3===Na++HCO-3__、HCO-3H++CO2-3。
三、离子反应1.概念:有离子参加或有离子生成的反应统称为离子反应。
2.离子反应的条件及本质在稀H2SO4中分别加入下列物质,请写出有关的离子方程式:A.加入BaCl2溶液:Ba2++SO2-4===BaSO4↓,B.加入CH3COONa溶液:CH3COO-+H+===CH3COOH,C.加入Na2CO3溶液:CO2-3+2H+===CO2↑+H2O,D.加入Zn粒:Zn+2H+===H2↑+Zn2+,E.加入NaOH溶液:H++OH-===H2O。
A、NaCl溶液能导电,所以NaCl溶液是电解质。
B、固态NaCl不导电,但NaCl是电解质。
C、HCl水溶液能导电,所以HCl是电解质。
D、Na2O是电解质,是因为Na2O在水溶液里能导电。
E、Cu能导电,所以是电解质。
F、BaSO4的水溶液不能导电,所以BaSO4是非电解质。
【投影】物质的分类。
电解质:酸、碱、盐、大多数金属氧化物、水等非电解质:非金属氧化物、大多数有机物、NH3等。
【过渡】为什么电解质在水溶液里或熔化状态下能够导电呢?【讲解】物质导电的条件是有自由移动的带电粒子存在,如石墨、铜能导电,是因为其中有自由移动的电子存在。
盐酸、NaOH溶液、NaCl溶液、醋酸溶液和氨水能导电,是因为其中有自由移动的离子存在。
这些自由移动的离子是如何产生的呢?为什么氯化钠固体不导电,而氯化钠溶液可以?让我们一起进入微观世界,了解氯化钠溶解的过程发生了什么变化。
NaCl 的溶解和电离【讲解】当氯化钠固体还没有进入水溶液的时候,水分子在不停的做无规则的运动。
加入氯化钠固体之后,水分子包围固体溶质并分布在固体表面。
水分子的作用减弱了氯化钠晶体中钠离子和氯离子的静电作用力,使氯化钠电离出钠离子和氯离子,这个时候吸收了一定的热量,请大家注意温度计温度的变化,钠离子和氯离子继而在水分子的作用下发生水合,生成了能够自由移动的水合钠离子和水合氯离子。
我们把这种产生自由移动离子的过程称为电离。
【板书】2、电离:电解质在水溶液里或熔融状态时,离解成自由移动的离子的过程。
【讲解】把氯化钠投入水中,我们观察到的是氯化钠溶解的现象,这个现象本质上是氯化钠在水分子的作用下电离出了钠离子和氯离子并结合生成水合离子。
这些自由移动的离子在电场的作用下定向移动,就是它们能够导电的本质原因。
【过渡】现在我们不仅知道溶液里面自由移动的离子是怎么产生的,也知道了溶液导电的原因。
电离的条件是什么?。
【板书】电解质导电的条件:水溶液或熔融状态——即电解质发生电离。
第二章 第二节 离子反应常见题型:一.电解质(概念,物质)判断二、离子方程式的书写:三、离子方程式正误的判断四、离子共存:五、离子检验与推断考点分析;1.电解质 一.电解质2非电解质.1.电解质:在溶液或熔融状态下能导电的化合物.(1).强电解质:溶液中完全电离的电解质。
电离方程式用“=”。
(2)弱电解质:在溶液中部分电离的电解质。
电离方程式用可逆符号,多元弱酸的电离要分步书写。
常见弱电解质有弱酸、弱碱、水。
2非电解质:在溶液和熔融状态下都不能导电的化合物.(常考蔗糖。
乙醇)二.离子方程式的书写1. 书写方法“一写”首先以客观事实为依据写出反应的化方程式;“二改”:把易溶于水、易电离物质改写成离子形式(最关键的一步):“三删”:删去方程式两边未参加反应的离子;“四查”:检查离子方程式两边各元素的原子个数和电荷总数是否相等。
2.溶解性口诀:钾盐钠盐铵盐硝酸盐,它们都能溶于水中间;盐酸盐不溶亚汞银,硫酸盐不溶钡钙铅; 硫化物还有钡镁溶, 碳硅磷盐大多是沉淀。
(碳酸盐、亚硫酸盐、硅酸盐、磷酸盐除钾钠铵盐溶于水外,其余难溶-为沉淀)3. 离子反应是在溶液或熔融状态时进行反应的,凡非溶液中进行的反应一般不能写离子反应方程式,亦即没有自由移动离子参加的反应,不能写出离子反应方程式。
如NH4Cl 固体和Ca(OH)2固体混合加热,虽然也有离子和离子反应,但不能写出离子反应方程式,只能写化方程式。
4. 对于微溶物的处理有三种情况:①在生成物里有微溶物析出时,微溶物用化式表示。
②当反应物里有微溶物处于溶液状态(稀溶液)时,应写成离子的形式。
③当反应物里有微溶物处于浊液或固态时,应写化式。
如在石灰乳中加入Na2CO3溶液: Ca(OH)2+CO32-═CaCO3↓+2OH-5、与试剂用量有关的离子子反应: (1)碱溶液与酸性氧化物的反应:Ca (OH )2溶液、Ba (OH )2溶液、KOH 溶液、NaOH 溶液等碱溶液与CO 2、SO 2等酸性氧化物反应时若酸性氧化物用量不同则离子方程式不同。
子《新课标》高三化学(人教版)第一轮复习单元讲座第二章化学物质及其变化第二讲离子反应教学目标:1.知道酸、碱、盐在溶液中能发生电离,通过实验事实认识离子反应及其发生的条件。
2.了解常见离子的检验方法。
复习重点、难点:离子反应及其发生的条件。
课时安排:两课时知识梳理______________________。
2;电离指电解质_____________,电离过程不需要通电。
3.酸、碱、盐的电离酸:电离时,_____________的化合物。
碱:电离时,_____________的化合物。
盐:电离时,能生成___________的化合物。
;4.写出下列物质在水溶液中的电离方程式。
(1)HCl:______________;(2)NaN03:_____________;(3)Ba(OH)2:____________;(4)CH3COOH:____________;(5)Cu(OH)2:____________;(6)H2S03:_____________。
5.(1)电解质;在______或______能够导电的化合物。
(2)非电解质:在______或______都不能导电的(3)强电解质:在___________的电解质(4)弱电解质:在___________的电解质6.离子反应指__________、___________之间发生的反应都是离子反应。
7.(1)离子反应可用_______表示,离子方程式和化学方程式一样,也是描述化学反应的一种_______。
(2)离子方程式和化学方程式都能描述_______,但离子方程式的描述更加_____,所表示的已__________,__________,并揭示了这类化学反应的__________。
8.书写下列反应的离子方程式:(1)NaOH溶液和H2S04溶液反应:___________;(2)NaCl溶液和AgNO3溶液:____________。
(3)Ba(OH)2溶液和H2S04溶液:___________。
9.利用某离子的特征反应进行检验。
如Cl—跟Ag+反应生成不溶于水____的______;SO42-跟Ba2+反应生成不溶于______的______;C032-跟H+反应生成能使____。
疑难点拨“强与弱”1、“是与非”(1)电解质概念中的或,两种情况任取一即可;非电解质概念中的无论和都,两种情况必须同时满足。
(2)无论是电解质还是非电解质,阐述的对象都是化合物。
因此单质即不是电解质也不是非电解质。
溶液是混合物,因此也即不是电解质也不是非电解质。
(3)氨气,二氧化硫溶于水均能导电,但并非它们本身能电离出自由离子,而是它们与水反应的生成物NH3•H2O、H2SO3能电离出离子而导电,所以氨气,二氧化硫都是非电解质。
(4)电离不需要通电,电离是电解质溶液导电的前提。
(5)能导电的物质不一定是电解质,如石墨等;电解质本身不一定能导电,如食盐晶体。
(6)电解质溶液中,阳离子所带正电荷总数与阴离子所带负电荷总数相等,故溶液显电中性,称电荷守恒。
2、“强与弱”强电解质弱电解质定义在水溶液里全部电离成离子的电解质在水溶液里只有一部分分子电离成离子的电解质电离程度完全部分电离条件水或熔化水化合物种类离子化合物,某些共价化合物共价化合物溶液里的粒子离子分子、离子实例强酸强碱大部分的盐弱酸弱碱和难溶性碱水电荷的多少。
(3)难溶性盐(如CaCO3、BaSO4等)在水中的溶解度极小,导电能力很小,但由于它们是离子化合物,在水溶液中溶解的那部分能完全电离,故它们属于强电解质。
(4)溶液导电性的强弱与电解质的强弱没有必然的联系。
导电能力强的溶液不一定是强电解质溶液,强电解质溶液不一定导电能力强。
二、电离方程式书写注意的几个问题1、电离方程式的书写:强电解质用“=”,弱电解质用“”2、多元弱酸的分步电离,分步书写,且第一步电离为主,各步方程式不可叠加。
H2S HS—+H+H3PO4H++ H2PO4—3、多元弱碱,分步进行,但一步书写到位:Mg(OH)2Mg2++2OH—4、多元强酸酸式盐一步书写到位:NaHSO4= SO42—+H++ Na+5、多元弱酸酸式盐:NaHCO3= HCO3—+Na+6、两性氢氧化物的电离(以氢氧化铝为例):三、离子方程式书写时应注意两方面问题:1、哪些物质可以改写成离子形式,哪些物质不能写成离子形式。
(1)易溶于水且易电离的物质溶于水中后写成离子形式。
如强酸,强碱,可溶性盐。
虽然易溶于水且易电离,但反应是在干态条件下或浓H2SO4溶液中进行,则也应写成分子形式。
如:2NaCl固+H2SO4(浓)Na2SO4+2HCl↑(2) 酸式盐中“HSO4-”可写成“H+”与“SO42-”,但HCO3-、HS-、HSO3-、HPO42-等弱酸的酸式酸根不能分开写。
(3)微溶物在产物中应写分子形式,在反应物中视具体情况定,如石灰水写离子,石灰乳写化学式。
2、离子反应方程式中系数处理:方程式两边各物质前的系数含有公约数可以削掉,例如:Ba(OH)2+2HCl=BaCl2+2H2O写成离子形式为:2H++2OH-=2H2O,所以“2”可以去掉,离子方程式为H++OH-=H2O。
只在部分物质的系数有公约数则不能去掉。
例如:Ba(OH)2+H2SO4=BaSO4↓+2H2O其离子方程式为:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O不能写成:Ba+2++OH-+H++SO42-=BaSO4↓+H2O四、判断离子方程式书写是否正确的五条原则:1、依据物质反应的客观事实.释例1:铁与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑(错误),正确的是:Fe+2H+=Fe2++H2↑.2、必须遵守质量守恒定律.释例2:Cl2+I-=Cl-+I2(错误),正确的是:Cl2+2I-=2Cl-+I2.3、必须遵守电荷平衡原理.释例3:氯气通入FeCl2溶液中:Fe2++Cl2=Fe3++2Cl-(错误),正确的是:2Fe2++Cl2=2Fe3++2Cl-.4、氧化还原反应还必须遵守得失电子守恒原理.应注意判断氧化剂和还原剂转移电子数是否配平.5、必须遵循定组成原理(即物质中阴、阳离子组成固定).释例4:Ba(OH)2溶液和稀H2SO4混合:Ba+OH-+H++SO42-=BaSO4↓+H2O(错误),正确的是:Ba2++2OH-+SO42-+2H+=BaSO4↓+2H2O.五、如何判断溶液中离子能否大量共存所谓几种离子在同一溶液中能大量共存,就是指离子之间不发生任何反应;若离子之间能发生反应,则不能大量共存.1.同一溶液中若离子间符合下列任意一个条件就会发生离子反应,离子之间便不能在溶液中大量共存.(1)生成难溶物或微溶物:如Ba2+与CO32-、Ag+与Br-、Ca2+与SO42-和OH-、OH-与Cu2+等不能大量共存.(2)生成气体或挥发性物质:如NH4+与OH-,H+与CO32-、HCO3-、S2-、HSO3-、SO32-等不能大量共存.(3)生成难电离的物质:如H+与CO32-、S2-、SO32-、F-、ClO-等生成弱酸;OH-与NH4+、Cu2+等生成弱碱;H+与OH-生成水,这些离子不能大量共存.(4)发生氧化还原反应:氧化性离子(如Fe3+、NO3-、ClO-、MnO4-等)与还原性离子(如S2-、I-、Fe2+、SO32-等)不能大量共存.注意Fe2+与Fe3+可以共存;MnO4-与Cl-不能大量共存.2.附加隐含条件的应用规律:(1)溶液无色透明时,则溶液中肯定没有有色离子.常见的有色离子是Cu2+、Fe3+、Fe2+、MnO4-等.(2)强碱性溶液中肯定不存在与OH-起反应的离子.H+起反应的离子.典型剖析),属于弱电解质的是(),属于非电解质的是()。
A. 碘化钾B. 乙醇C. 氨气D. 蔗糖E. 氢硫酸F. 硫酸氢钠G. 氨水H. 液氧I. 氢氧化钠溶液解析:抓住电解质、非电解质概念区别。
化合物——不导电(即不电离),是非电解质,故应选B、C、D为非电解质。
强电解质、弱电解质本质区别:电解质——全部电离(即强酸、强碱、盐)为强电解质,故应选A、F,而E、G为弱电解质。
此题易出错为在强电解质中选氢氧化钠溶液,应注意,此为混合物,不应是电解质范围。
注:对于酸和碱在电解质上的选择有特殊规定,一般称为某酸都视为电解质(包括溶液,因有些酸只存在于溶液中,如硫酸),对于某碱(除NH3·H2O只存在于氨水中外)一般只有固态时为电解质,其溶液均视为混合物。
答案:A、F;E、G;B、C、D。
【例2】下列离子方程式正确的是()A.碳酸氢钙溶液与盐酸混合 HCO3-+H+=H2O+CO2↑B.氢氧化铜中加入盐酸 H++OH-=H2OC.氯化铁溶液中加入铁钉 Fe3++Fe=2Fe2+D.铁与盐酸反应2Fe+6H+=2Fe3++3H2↑解析:B选项中Cu(OH)2难溶于水,要用化学式表示,不能写成离子形式。
正确的应写成:Cu(OH)2+2H+=Cu2++2H2O。
C选项中氧化剂与还原剂之间转移的电子数不相等(即左、右两边电荷不守恒),正确的应写成:2Fe3++Fe=3Fe2+。
D选项不符合实验事实,生成物写错,Fe与HCl反应生成FeCl2,而不是FeCl3。
正确的应写成:Fe+2H+=Fe2++H2↑。
答案为:A 【例3】在强酸性溶液中能大量共存,并且溶液为无色透明的离子组是()A.NH4+、Al3+、SO42-、NO3-B.K+、Na+、S2-、Cl-C.K+、NH4+、MnO4-、SO42- D.Na+、K+、NO3-、HCO3-解析:在强酸性条件下,要考虑这些离子与H+能否共存。
溶液为“无色透明”要考虑各离子的颜色。
S2-、HCO3-均与H+不能共存S2-+2H+=H2S↑,HCO3-+H+=H2O+CO2↑,而MnO4-在水溶液中呈紫色。
答案为:A【例4】用一种试剂除去下列各物质中的杂质(括号中的物质),写出所用试剂及离子方程式,并简述操作方法。
⑴ BaCl2(HCl)试剂_______________________________________;离子方程式_______________________________________________________;操作方法_________________________________________________________。
⑵ O2(CO2)试剂_______________________________________;离子方程式_______________________________________________________;操作方法_________________________________________________________,⑶Cu(Zn)试剂_______________________________________;离子方程式_______________________________________________________;操作方法_________________________________________________________。