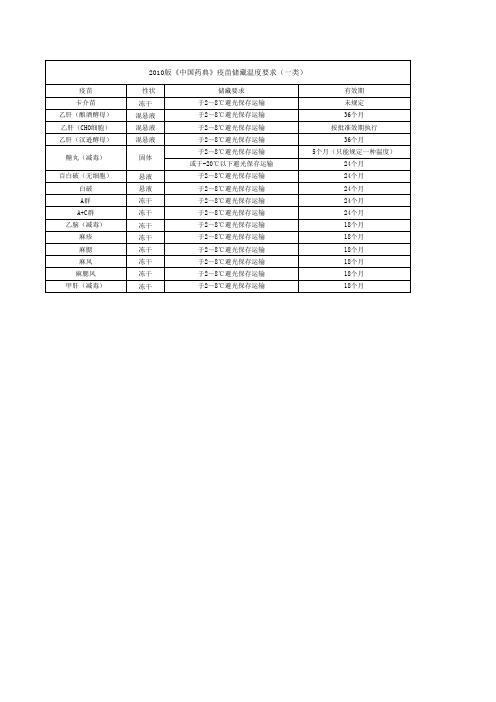
2010版药典关于温度的规定
- 格式:doc
- 大小:10.50 KB
- 文档页数:1


中国药典对常温规定
中国药典是中国药品质量标准的法定文件,它规定了药品的质量标准,包括药品的存储条件。
常温是指药品在室温(15℃-30℃)下存放的温度,是药品存储的
最佳条件。
中国药典规定,药品应在常温下存放,温度不得超过30℃,也不得低于15℃。
药品的存放温度应稳定,不宜频繁变化,以免影响药品的质量和有效性。
药品应存放在干燥、通风、清洁、无异味的环境中,避免阳光直射,以免药品受潮、变质。
此外,药品应存放在防潮、防虫、防尘的地方,避免潮湿、污染、腐蚀等环境的影响,以免药品受损。
药品应存放在防护罩、密封容器或密封袋中,以防止药品污染。
此外,药品应存放在室内,不得暴露在室外,以免受到外界的影响。
药品应存放在温度稳定的地方,不宜频繁变动,以免影响药品的质量和有效性。
总之,中国药典对药品的常温存储有明确的规定,药品应存放在室温(15℃-30℃)下,并且应存放在干燥、通风、清洁、无异味的环境中,避免阳光直射,
以免药品受潮、变质。
药品应存放在防潮、防虫、防尘的地方,避免潮湿、污染、腐蚀等环境的影响,以免药品受损。
药品应存放在防护罩、密封容器或密封袋中,以防止药品污染,并且应存放在室内,不得暴露在室外,以免受到外界的影响。
药品应存放在温度稳定的地方,不宜频繁变动,以免影响药品的质量和有效性。
中国药典对药品的常温存储有明确的规定,为保证药品的质量和有效性,我们应严格遵守这些规定,以保证药品的安全性和有效性。

中国药典二部凡例(2010年版)项目与要求一、性状项下记载药品的外观、臭、味,溶解度以及物理常数等。
(1)外观性状是对药品的色泽和外表感观的规定。
(2)溶解度是药品的一种物理性质。
各品种项下选用的部分溶剂及其在该溶剂中的溶解性能,可供精制或制备溶液时参考。
药品的近似溶解度以下列名词术语表示:极易溶解系指溶质1g(ml)能在溶剂不到1ml中溶解;易溶系指溶质1g(ml)能在溶剂1~不到10ml中溶解;溶解系指溶质1g(ml)能在溶剂10~不到30ml中溶解;略溶系指溶质1g(ml)能在溶剂30~不到100ml中溶解;微溶系指溶质1g(ml)能在溶剂100~不到1000ml中溶解;极微溶解系指溶质1g(ml)能在溶剂1000~不到10000ml中溶解;几乎不溶或不溶系指溶质1g(ml)在溶剂10000ml中不能完全溶解。
(数据了解即可)试验法:除另有规定外,称取研成细粉的供试品或量取液体供试品,于25℃±2℃一定容量的溶剂中,每隔5分钟强力振摇30秒钟;观察30分钟内的溶解情况,如无目视可见的溶质颗粒或液滴时,即视为完全溶解。
二、检查项下包括反映药品的安全性与有效性的试验方法和限度、均一性与纯度等制备工艺要求等内容;对于规定中的各种杂质检查项目,系指该药品在按既定工艺进行生产和正常贮藏过程中可能含有或产生并需要控制的杂质(如残留溶剂、有关物质等);改变生产工艺时需另考虑增修订有关项目。
供直接分装成注射用无菌粉末的原料药,应按照注射剂项下相应的要求进行检查,并符合规定。
三、制剂的规格,系指每一支、片或其他每一个单位制剂中含有主药的重量(或效价)或含量(%)或装量。
注射液项下,如为“1ml:10mg”,系指1ml中含有主药10mg;对于列有处方或标有浓度的制剂,也可同时规定装量规格。
四、贮藏项下的规定,系为避免污染和降解而对药品贮存与保管的基本要求,以下列名词术语表示:遮光系指用不透光的容器包装,例如棕色容器或黑纸包裹的无色透明、半透明容器;密闭系指将容器密闭,以防止尘土及异物进入;密封系指将容器密封以防止风化、吸潮、挥发或异物进入;熔封或严封系指将容器熔封或用适宜的材料严封,以防止空气与水分的侵入并防止污染;阴凉处系指不超过20℃;凉暗处系指避光并不超过20℃;冷处系指2~10℃。

2010版gmp温湿度要求
2010GMP温湿度要求严格地规定锅炉及各种设备的安装和运行条件,以保证空调系统的正常运行。
关于温度要求,GMP工厂对温度的要求是在室内温度
17~35℃,24个小时内最大温度漂移不得超过5℃。
在空调系统中,室外进风口环境温度16~45℃、湿度不大于95%;室内出风口环境温度和湿度同室内温度和湿度要求一致;室内湿度的最大值不超过75%。
除此之外,GMP温湿度要求还规定设备和室内室外的设备设备之间的温度差异不得超过5.5℃,设备室外的最高温度湿度不能超过55℃,和95%。
设备内部最高温度不能超过50℃,湿度不能超过80%。
GMP温湿度要求提出严格的要求,为空调系统的安全运行提供保障。
合理的温湿度设定极大地改善了工厂环境,减少了设备及零件的故障,减少维修费用,也提高了产品质量。
因此,严格执行GMP温度湿度要求,是空调系统运行安全和高质量产品生产的基础。

国内外药典贮藏条件下温度的规定一、中国药典2010年版:阴凉处:不超过20℃凉暗处:避光并不超过20℃冷处:2~10℃常温:10~30℃未规定贮藏温度的一般系指常温。
二、美国药典USP34:冷冻(Freezer):-25~-10℃冷处(Cold):不超过8℃冷藏(A “refrigerator”is a cold place): 2~8℃受控制的冷处(Controlled cold temperature):2~8℃,在贮存、运输及分配时允许在0~15℃。
短时的可超过25℃,但应保证不超过24小时,除非有稳定性数据支持或生产商许可标识。
凉处(Cool):8~15℃室温(Room temperature):工作区温度可控室温(Controlled room temperature):20~25℃,平均温度应不超过25℃。
药房、医院、仓库允许在15~30℃。
平均温度只要在范围内,短时的可超过40℃,但应保证不超过24小时。
超过40℃应有生产商许可标识。
暖处(Warm):30~40℃过热(Excessive heat):高于40℃干燥处(Dry place):在可控室温下,或在其他温度的等同气压下,平均相对湿度不超过40%。
平均相对湿度可以直接测量,也可根据天气报告。
测定可在一个季度、一年、或者药品的贮存期内,在不少于12次平行测定的基础上获得。
平均相对湿度不超过40%,相对湿度偶尔过45%是允许的。
三、日本JP15:标准温度(Standard temperature):20℃常温(Ordinary temperature):15~25℃室温(Room temperature):1~30℃凉处(A cold place):1~15℃微温(lukewarm):30~40℃四、欧洲药典EP7.0:冷冻(In a deep-freeze):-15℃以下冷藏(In a refrigerator):2~8℃冷处或凉处(Cold or cool):8~15℃室温(Room temperature):15~25℃欢迎您的下载,资料仅供参考!致力为企业和个人提供合同协议,策划案计划书,学习资料等等打造全网一站式需求。
4附录XIX C 原料药与药物制剂稳定性试验指导原则稳定性试验的目的是考察原料药或药物制剂在温度、湿度、光线的影响下随时间变化的规律,为药品的生产、包装、贮存、运输条件提供科学依据,同时通过试验建立药品的有效期。
稳定性试验的基本要求是:(1)稳定性试验包括影响因素试验、加速试验与长期试验。
影响因素试验用1批原料药或1批制剂进行。
加速试验与长期试验要求用3批供试品进行。
(2)原料药供试品应是一定规模生产的,供试品量相当于制剂稳定性试验所要求的批量,原料合成工艺路线、方法、步骤应与大生产一致。
药物制剂供试品应是放大试验的产品,其处方与工艺应与大生产一致。
药物制剂如片剂、胶囊剂,每批放大试验的规模,片剂至少应为10000片,胶囊剂至少应为10000粒。
大体积包装的制剂如静脉输液等,每批放大规模的数量至少应为各项试验所需总量的10倍。
特殊品种、特殊剂型所需数量,根据情况另定。
(3)供试品的质量标准应与临床前研究及临床试验和规模生产所使用的供试品质量标准一致。
(4)加速试验与长期试验所用供试品的包装应与上市产品一致。
(5)研究药物稳定性,要采用专属性强、准确、精密、灵敏的药物分析方法与有关物质(含降解产物及其他变化所生成的产物)的检查方法,并对方法进行验证,以保证药物稳定性试验结果的可靠性。
在稳定性试验中,应重视降解产物的检查。
(6)由于放大试验比规模生产的数量要小,故申报者应承诺在获得批准后,从放大试验转入规模生产时,对最初通过生产验证的3批规模生产的产品仍需进行加速试验与长期稳定性试验。
本指导原则分两部分,第一部分为原料药,第二部分为药物制剂。
4.1一、原料药原料药要进行以下试验。
4.1.1(一)影响因素试验此项试验是在比加速试验更激烈的条件下进行。
其目的是探讨药物的固有稳定性、了解影响其稳定性的因素及可能的降解途径与降解产物,为制剂生产工艺、包装、贮存条件和建立降解产物分析方法提供科学依据。
供试品可以用1批原料药进行,将供试品置适宜的开口容器中(如称量瓶或培养皿),摊成≤5mm厚的薄层,疏松原料药摊成≤1 0mm厚的薄层,进行以下试验。
4附录XIX C 原料药与药物制剂稳定性试验指导原则稳定性试验的目的是考察原料药或药物制剂在温度、湿度、光线的影响下随时间变化的规律,为药品的生产、包装、贮存、运输条件提供科学依据,同时通过试验建立药品的有效期。
稳定性试验的基本要求是:(1)稳定性试验包括影响因素试验、加速试验与长期试验。
影响因素试验用1批原料药或1批制剂进行。
加速试验与长期试验要求用3批供试品进行。
(2)原料药供试品应是一定规模生产的,供试品量相当于制剂稳定性试验所要求的批量,原料合成工艺路线、方法、步骤应与大生产一致。
药物制剂供试品应是放大试验的产品,其处方与工艺应与大生产一致。
药物制剂如片剂、胶囊剂,每批放大试验的规模,片剂至少应为10000片,胶囊剂至少应为10000粒。
大体积包装的制剂如静脉输液等,每批放大规模的数量至少应为各项试验所需总量的10倍。
特殊品种、特殊剂型所需数量,根据情况另定。
(3)供试品的质量标准应与临床前研究及临床试验和规模生产所使用的供试品质量标准一致。
(4)加速试验与长期试验所用供试品的包装应与上市产品一致。
(5)研究药物稳定性,要采用专属性强、准确、精密、灵敏的药物分析方法与有关物质(含降解产物及其他变化所生成的产物)的检查方法,并对方法进行验证,以保证药物稳定性试验结果的可靠性。
在稳定性试验中,应重视降解产物的检查。
(6)由于放大试验比规模生产的数量要小,故申报者应承诺在获得批准后,从放大试验转入规模生产时,对最初通过生产验证的3批规模生产的产品仍需进行加速试验与长期稳定性试验。
本指导原则分两部分,第一部分为原料药,第二部分为药物制剂。
4.1一、原料药原料药要进行以下试验。
4.1.1(一)影响因素试验此项试验是在比加速试验更激烈的条件下进行。
其目的是探讨药物的固有稳定性、了解影响其稳定性的因素及可能的降解途径与降解产物,为制剂生产工艺、包装、贮存条件和建立降解产物分析方法提供科学依据。
供试品可以用1批原料药进行,将供试品置适宜的开口容器中(如称量瓶或培养皿),摊成≤5mm厚的薄层,疏松原料药摊成≤1 0mm厚的薄层,进行以下试验。
一、项目与要求1、制法项下主要记载药品的重要工艺要求和质量管理要求。
(1)所有药品的生产工艺应经验证,并经国务院药品监督管理部门批准,生产过程均应符合《药品生产质量管理规范》的要求。
(2)来源于动物组织提取的药品,其所用动物种属要明确,所用脏器均应来自经检疫的健康动物,涉及牛源的应取自无牛海绵状脑病地区的健康牛群;来源于人尿提取的药品,均应取自健康人群。
上述药品均应有明确的病毒灭活工艺要求以及质量管理要求。
(3)直接用于生产的菌种、毒种、来自人和动物的细胞、DNA重组工程菌及工程细胞,来源途径应经国务院药品监督管理部门批准并应符合国家有关的管理规范。
2、性状项下记载药品的外观、臭、味、溶解度以及物理常数等。
(1)外观性状是对药品的色泽和外表感观的规定。
(2)溶解度是药品的一种物理性质。
各品种项下选用的部分溶剂及其在该溶剂中的溶解性能,可供精制或制备溶液时参考;对在特定溶剂中的溶解性能需作质量控制时,在该品种检查项下另作具体规定。
药品的近似溶解度以下列名词术语表示;极易溶解系指溶质1g(ml)能在溶剂不到1ml中溶解;易溶系指溶质1g(ml)能在溶剂1~不到10ml中溶解;溶解系指溶质1g(ml)能在溶剂10~不到30ml中溶解;略溶系指溶质1g(ml)能在溶剂30~不到100ml中溶解;微溶系指溶质1g(ml)能在溶剂100~不到1000ml中溶解;极微溶解系指溶质1g(ml)能在溶剂1000~不到10 000ml中溶解;几乎不溶或不溶系指溶质1g(ml)在溶剂10 000ml中不能完全溶解。
试验法:除另有规定外,称取研成细粉的供试品或量取液体供试品,置于25℃±2℃一定容量的溶剂中,每隔5分钟强力振摇30秒钟;观察30分钟内的溶解情况,如无目视可见的溶质颗粒或液滴时,即视为完全溶解。
(3)物理常数包括相对密度、馏程、熔点、凝点、比旋度、折光率、黏度、吸收系数、碘值、皂化值和酸值等;其测定结果不仅对药品具有鉴别意义,也可反映药品的纯度,是评价药品质量的主要指标之一。
中国药典规定实验室湿度范围
根据2005、2010年版《中国药典》
创作编号:983317954552531AW538580002222创作者:常立在* 遮光,系指用不透光的容器包装,例如棕色容器或黑纸包裹的无色透明、半透明容器;密闭,系指将容器密闭以防止尘土及异物进入;密封,系指将容器密封以防止风化、吸潮、挥发或异物进入;熔封或严封,系指将容器熔封或用适宜的材料严封,以防止空气与水分的侵入并防止污染;阴凉处,系指不超过20℃;凉暗处,系指避光并不超过20℃;冷处,系指2~10℃;常温,系指10~30℃,凡贮藏项未规定贮存温度的系指常冷处,系指2~10℃;常温,系指10~30℃,凡贮藏项未规定贮存温度的系指常温;除另有规定外,生物制品应在2~8℃避光贮藏。
干燥处:系指贮存和保管药品的处所不潮湿,没有水分或水分很少,即药品贮藏处的相对湿度应在45~75%之间。
GSP规定的相对湿度45%-75%之间是强制规定(上下限含45%、75%),这两个值是临界值。