化学反应快慢和限度习题讲评
- 格式:ppt
- 大小:24.00 KB
- 文档页数:2

化学反应的快慢和限度(讲义)一、知识点睛1. 化学反应速率(1)定义:描述____________的物理量。
(2)表示方法:用单位时间内反应物浓度或生成物浓度的_________(绝对值)来表示。
(3)表达式:c v t =(v 表示反应速率,△c 表示浓度的 变化,△t 表示反应时间的变化)(4)单位:mol ·L -1·min -1或mol ·L -1·s -1;(5)规律:化学反应中用各物质表示的反应速率之比等于化学方程式中各物质的____________之比。
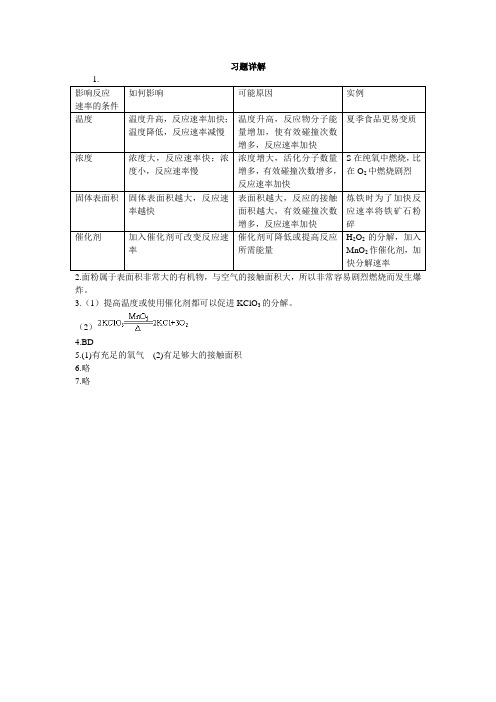
如反应a A+b B=c C+d D 的反应速率可统一为:A B C D v v v v v=a b c d()()()()=== 2. 影响化学反应速率的因素(1)内因物质本身的性质。
(2)常见外因①温度在其他条件相同时,升高温度,化学反应速率_____;降低温度,化学反应速率______。
②反应物浓度在其他条件相同时,增大反应物浓度,化学反应速率______;减小反应物浓度,化学反应速率______。
③压强在其他条件相同时,对于有气体参加反应,增大压强(减小容器体积),化学反应速率_____;减小压强(增大容器体积),化学反应速率______。
③催化剂在其他条件相同时,通常情况下,使用催化剂,化学反应速率会______。
④其他如光照、反应物的接触面积等。
3. 可逆反应在________下同时向_______两个反应进行的反应。
(1)在可逆反应的化学方程式中,用“_____”代替“”。
(2)可逆反应中反应物不可能全部转化成产物,反应只能进行到一定程度。
(3)可逆反应的能量转化也是可逆的,若正反应是放热反应,则逆反应是_______反应。
4. 化学平衡(1)化学平衡定义在一定条件下_______反应进行到一定程度时,反应物和生成物的浓度_____________________,正反应速率和逆反应速率________,这种状态称为化学平衡状态,简称_____________。


鲁科版高一化学必修第二册《化学反应的快慢和限度》评课稿一、引言本文是对鲁科版高一化学必修第二册《化学反应的快慢和限度》进行评课的稿件。
本课程主要介绍了化学反应速率、化学平衡以及化学平衡的移动性。
通过学习本章,学生在理论和实验的结合中,能够了解化学反应的快慢和限度,并能够分析化学平衡的条件和控制因素。
二、课程内容和教学目标2.1 课程内容本章的主要内容包括:1.化学反应速率的概念和测定方法;2.影响化学反应速率的因素;3.化学反应速率与反应物浓度之间的关系;4.化学平衡的条件和判断;5.化学平衡的移动性。
2.2 教学目标通过本章的学习,学生应该能够:1.理解化学反应速率的概念和测定方法;2.掌握影响化学反应速率的因素;3.掌握化学反应速率与反应物浓度之间的关系;4.了解化学平衡的条件和判断;5.了解化学平衡的移动性。
三、教学重点和难点3.1 教学重点本章的教学重点包括:1.化学反应速率的概念和测定方法;2.影响化学反应速率的因素;3.化学反应速率与反应物浓度之间的关系;4.化学平衡的条件和判断;5.化学平衡的移动性。
3.2 教学难点本章的教学难点包括:1.影响化学反应速率的因素的深入理解;2.化学反应速率与反应物浓度之间的数学关系的掌握;3.化学平衡的条件和判断的运用;4.化学平衡的移动性的理解与应用。
四、教学方法和教学过程4.1 教学方法本章的教学方法主要包括讲授法、实验法和练习法。
在讲授法中,通过例题和实例讲解,引导学生理解和掌握相关概念和原理;在实验法中,通过实验现象和实验操作,加深学生对化学反应速率和化学平衡的理解;在练习法中,通过对习题的解答和讨论,巩固学生的知识点,提高问题解决能力。
4.2 教学过程本章的教学过程分为以下几个步骤:1.引入:通过引发学生对化学反应速率的思考,激发学生的学习兴趣和主动性。
2.讲解化学反应速率的概念和测定方法:介绍化学反应速率的定义和测定方法,帮助学生理解速率的含义和测量速率的方法。

《化学反应的快慢和限度》讲义一、化学反应的快慢在我们的日常生活和化学研究中,经常会关注化学反应进行的快慢。
那么,究竟什么决定了化学反应的快慢呢?首先,反应物的性质是一个关键因素。
不同的物质具有不同的化学活性,就像有些人性格活泼,容易与他人交流,而有些人则相对内向。
例如,金属钠与水的反应非常剧烈,而铁与水在常温下几乎不反应。
其次,反应物的浓度也会对反应速率产生影响。
浓度越大,反应物分子之间碰撞的机会就越多,反应也就更容易发生,而且速度更快。
想象一下在一个拥挤的广场上,人越多,相互碰到的可能性就越大。
温度同样是一个重要的影响因素。
一般来说,温度升高,分子的运动速度加快,碰撞更加频繁且更有力量,从而加快反应速率。
就像在炎热的夏天,人们的活动更加活跃。
催化剂的存在也能显著改变反应的快慢。
催化剂能够降低反应的活化能,就像是为化学反应开辟了一条捷径,让反应更容易进行。
但要注意,催化剂在反应前后其质量和化学性质是不变的。
此外,压强对有气体参与的反应速率有影响。
增大压强,相当于把气体分子压缩在更小的空间里,它们相互碰撞的机会增加,反应速率也就加快了。
表面积也是不能忽视的。
对于固体反应物,颗粒越小,表面积越大,与其他反应物接触的机会就越多,反应就会更快。
比如把一块大的煤块燃烧和把煤制成煤粉燃烧,煤粉燃烧会快得多。
我们通过实验来测定化学反应的快慢,通常会观察反应物或生成物在单位时间内浓度的变化。
例如,产生气体的反应可以通过测量单位时间内气体的体积,有颜色变化的反应可以通过比色法测量颜色的深浅来确定反应的快慢。
二、化学反应的限度了解了化学反应的快慢,接下来我们探讨一下化学反应的限度。
化学反应的限度就是指一个化学反应在给定条件下能够进行到的最大程度。
并不是所有的化学反应都能进行到底,有些反应在一定条件下会达到一种平衡状态。
就好比一场拔河比赛,双方力量势均力敌时,绳子就会处于一种动态的平衡,既不向这边移动,也不向那边移动。

化学反应的快慢和限度 例题解析【例1】已知合成氨反应为:N 2+3H 2 2NH 3,在一定温度下,向1 L 密闭容器中,加入2 mol N 2和5 mol H 2,一定条件下使之反应,经过2 min 后测得NH 3为0.4 mol ,求以N 2、H 2、NH 3表示的反应速率以及三者之比。
【解析】化学反应速率是用来衡量化学反应进行快慢的,通常用单位时间内某一种反应物或生成物的物质的量浓度得变化值来表示。
其单位为mol/(L ·min)或mol/(L ·s)等。
①公式:tCV ∆∆=△C 是物质的量浓度的变化而非物质的量的变化,更非质量的变化.这种变化对于反应物而言是浓度的减少,对于生成物而言是浓度的增加。
这里浓度的变化实际是取绝对值,是正数。
②化学反应速率的单位是由浓度单位和时间单位组成的,为mol/(L ·min )或mol/(L ·s ),两单位间可以换算:60mol/(L ·min)=1mol/(L ·s)③化学反应速率是指平均反应速率,而不是瞬时反应速率.即为一段时间内的平均值,而非某个时刻的反应速率。
而且在不同的时间段,化学反应速率的数值不同.④同一反应,可以选用不同物质的浓度变化表示化学反应速率,所以必须标明是何种物质表示的化学反应速率。
用不同物质表示的反应速率虽然数值不同,但表示的都是同一反应在同一时间段内的速率,它们的意义相同,并且数值之比等于这些物质在化学方程式中的化学计量数之比。
⑤并非所有的物质都可以用这种方法表示化学反应速率,固体或纯液体因无浓度变化,所以无法用这种方式表示化学反应速率。
化学平衡计算的基本模式——平衡“三步曲”:例: m A + n B p C + q D 起始: a b 0 0 转化: mx nx px qx 平衡: a-mx b-nx px qx其中:①转化量与方程式中各物质的系数成比例;②这里a 、b 可指物质的量、浓度、体积等。
《化学反应速率和限度》的评课稿篇一:《化学反应速率和限度》的评课稿《化学反应速率和限度》的评课稿根据新课标的要求,学生主动构建知识和技能是教改的基本目标,研究性学习已成为化学教改的教学方法之一,是培养创新型人才的主要方式。
探究教学作为现代教学的一种模式,其实质是将科学领域的探究引入到学生的学习过程中,使学生通过类似于科学家的探究过程来获取知识、培养科学探究能力的一种教学方法。
关凤谊老师的《化学反应的速率和限度》作为一堂实验探究课,特别强调学生的实验设计能力,观察能力,动手能力和科学探究能力的培养。
此外关老师上课语言简洁,气氛活跃,处处洋溢着新课程理念的气息,为高中化学课程实验提高了一堂难得的示范课。
一、以建构主义学习理论指导教学过程建构主义学习理论的基本观点认为,知识不是通过教师传授得到,而是学习者在一定的情景下,借助其他人(包括教师和学习伙伴)的帮助,利用必要的学习资料,通过建构意义的方式而获得。
因此建构主义学习理论强调以学生为中心,认为“情境”、“协作”、“会话”和“意义建构”是学习环境中的四大要素。
本堂课关老师教学过程共有以下6个环节:创设问题情景,提出化学假设,设计实验方案,实施实验方案。
精心设计的教学情境中让学生自主探索、合作学习、体验知识的发生过程,很好的达到了建构新知的目的。
二、课堂教学“过程化”新教材的教学理念之一是让学生去体验新知识的发生过程,本课很好的做到了这一点。
首先,以播放《黑客帝国》中的一段赛车作为引入,创设问题:“世界上任何事物都是运动的,有运动就有快慢之分,那么我们的化学反应是否也有快慢之分呢?”接着引导学生讨论“氢气、汽油蒸汽的安静燃烧与爆炸”和“铁的锈蚀、转炉炼钢通入的纯氧使少量铁剧烈氧化,呈现“钢花怒放”的景象”的化学反应,让学生感受到化学反应也有快慢之分。
引发学生思考,体会到新知识的发生是可能的,自然的。
其次,怎样合理比较和判断一个反应的快慢呢?教师让学生提出自己的想法,。
高考化学化学反应的速率与限度的推断题综合复习及答案解析一、化学反应的速率与限度练习题(含详细答案解析)1.化学反应速率与限度与生产、生活密切相关(1)A学生为了探究锌与盐酸反应过程中的速率变化,他在200mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):时间(min)12345氢气体积(mL)(标准状况)100240688810860①反应速率最大的时间段是____________(填0~1、1~2、2~3、3~4、4~5)min,原因是____________。
②在2~3min时间段以盐酸的浓度变化来表示的反应速率为____________。
(设溶液体积不变)(2)B学生也做同样的实验,但由于反应太快,测不准氢气体积,故想办法降低反应速率,请你帮他选择在盐酸中加入下列____________以减慢反应速率。
(填写代号)A.冰块B.HNO3溶液C.CuSO4溶液(3)C同学为了探究Fe3+和Cu2+对H2O2分解的催化效果,设计了如图所示的实验。
可通过观察___________________________现象,定性比较得出结论。
有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是__________________________,【答案】2~3 因该反应放热,随着反应,溶液温度升高,故反应速率加快 0.2mol·L-1·min-1 A 反应产生气泡的快慢控制阴离子相同,排除阴离子的干扰【解析】【分析】(1)单位时间内生成氢气的体积越大反应速率越快;锌与盐酸反应放热;②2~3min生成氢气的体积是448mL(标准状况),物质的量是0.448L0.02mol 22.4L/mol,消耗盐酸的物质的量0.4mol;(2)根据影响反应速率的因素分析;(3)双氧水分解有气泡产生;根据控制变量法,探究Fe3+和Cu2+对H2O2分解,控制阴离子相同;【详解】(1)根据表格数据,2 min~3min收集的氢气最多,反应速率最大的时间段是2~3min;锌与盐酸反应放热,随着反应,溶液温度升高,故反应速率加快;②2~3min生成氢气的体积是448mL(标准状况),物质的量是0.448L0.02mol 22.4L/mol=,消耗盐酸的物质的量0.04mol,0.04mol0.2L1minv÷==0.2mol·L-1·min-1;(2)A.加入冰块,温度降低,反应速率减慢,故选A;B.加入HNO3溶液,硝酸与锌反应不能生成氢气,故不选B;C.加入CuSO4溶液,锌置换出铜,构成原电池,反应速率加快,故不选C;(3)双氧水分解有气泡产生,可通过观察反应产生气泡的快慢,定性比较催化效果;根据控制变量法,探究Fe3+和Cu2+对H2O2分解,控制阴离子相同,排除阴离子的干扰,所以FeCl3改为Fe2(SO4)3更为合理。
化学反应的快慢和限度1、相同质量的锌与酸反应制备H2,欲使反应速率最大,下列组合符合要求的是( )①纯锌片②粗锌片③0.01mol·L-1稀盐酸④0.01mol·L-1稀硫酸⑤98%硫酸⑥加热⑦用冰水冷却A.①③⑦B.②④⑥C.②③⑥D.①⑤⑥2、在体积固定的密闭容器中,发生反应。
下列叙述不能说明该反应已达到化学平衡状态的是( )A.混合气体密度不变B.体系压强不变C.混合气体的平均相对分子质量不变D.反应体系中甲醇的物质的量浓度不再变化3、下列反应不属于可逆反应的是(?? )A.B.C.D.4、某实验探究小组研究320K时的分解反应:=如图是该小组根据所给表格中的实验数据绘制的。
下列有关说法正确的是( )t/min 0 1 2 3 40.160 0.114 0.080 0.056 0.0400 0.023 0.040 0.052 0.060A.曲线I是的浓度变化曲线B.曲线II是的浓度变化曲线C.的浓度越大,反应速率越快D.的浓度越大,反应速率越快5、—定条件下的某可逆反应,其正反应速率和逆反应速率随时间的变化如图所示。
下列判断正确的是( )A.时刻,B.时刻,C.时刻,D.时刻,6、在一定条件下的密闭容器中,某一反应中M、N的物质的量随反应时间变化的曲线如图所示,下列表述正确的是( )A.反应的化学方程式为2MNB. min时,正、逆反应速率相等,反应达到平衡C. min时,正反应速率大于逆反应速率D. min时,N的浓度是M的浓度的2倍7、对于可逆反应,若其他条件都不变,只是在反应前是否加入催化剂,可得到如下两种图像,下列判断正确的是(? ?)A.,B.,C.两图中阴影部分面积相等D.图II中阴影部分面积更大8、现有反应在一体积可调的密闭容器中进行,采取下列措施对其反应速率几乎无影响的是()A.保持容器容积不变,增加的量B.将容器体积缩小一半C.保持容器容积不变,充入Ar使体系压强增大D.充入Ar,保持容器内压强不变9、在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实:。
鲁科版(2019)必修第二册《2.3 化学反应的快慢和限度》2021年同步练习卷(1)1.在一定温度下的定容容器中不能表明反应⇌已达平衡状态的是A. 气体的密度不再改变B. 混合气体的平均相对分子质量不再改变C. 混合气体的颜色不再改变D. 的体积分数保持不变2.影响化学反应速率的主要因素是A. 浓度B. 催化剂C. 反应物本身的性质D. 温度3.下列可逆反应达到平衡后,加压和升高温度均可使平衡向逆反应方向移动的是A. ⇌B. ⇌C. ⇌D. ⇌4.已建立化学平衡的某可逆反应,当条件改变使化学平衡向正反应方向移动,下列叙述正确的是①生成物的质量分数一定增加;②一定使用了催化剂;③反应物的转化率一定增大;④平衡时反应物的浓度一定降低;⑤正反应速率一定大于逆反应速率。
A. ①⑤B. ②④C. ⑤D. ③④⑤5.在只有气体参加的反应中,改变下列条件,能使反应物中单位体积内活化分子数和活化分子百分数同时增大的是A. 增大反应物的浓度B. 增大压强C. 升高温度D. 移去生成物6.一定温度下,在某体积固定的密闭容器中加入2molA和1molB,发生可逆反应⇌,下列说法正确的是A. 当容器内压强不变时说明反应已达到平衡B. 当反应达到平衡时:::2:3C. 当反应达到平衡时放出热量akJD. 其他条件不变,升高温度反应速率加快7.对于可逆反应:⇌,下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是A. 增大压强B. 升高温度C. 使用催化剂D. 多充入8.100mL浓度为的硫酸跟过量的锌片反应,某同学想加快反应速率,又不影响成氢气的总量,下列操作不符合要求的是A. 将锌片换成等量的锌粉B. 加入数滴氯化铜溶液C. 升高温度D. 加入适量的的硫酸9.少量铁粉与的稀盐酸反应,反应速率太慢.为了加快此反应速率而不改变的产量,可以使用如下方法中的①加②加NaOH固体③滴入几滴浓盐酸④加固体⑤加NaCl溶液⑥滴入几滴硫酸铜溶液⑦升高温度不考虑盐酸挥发⑧改用盐酸.A. ①⑥⑦B. ③⑤⑧C. ③⑦⑧D. ⑤⑦⑧10.在盛有足量A的体积可变的密闭容器中,加入B,发生反应:⇌,在一定温度、压强下达到平衡。