FDA修订罗格列酮说明书和用药指南_
- 格式:pdf
- 大小:36.82 KB
- 文档页数:1

太罗说明书【批准文号】国药准字H20041399【中文名称】罗格列酮钠片【产品英文名称】Rosiglitazone Sodium Tablets【分子式】【生产企业】太极集团涪陵制药厂【功效主治】太罗用于治疗2型糖尿病。
单一服用太罗,并辅以饮食控制和运动,可控制2型糖尿病患者的血糖。
对于饮食控制和运动加服本品或单一抗糖尿病药物,而血糖控制不佳的2型糖尿病患者,太罗可与二甲双胍或磺酰脲类药物联合应用。
对服用最大推荐剂量二甲双胍或磺酰脲类药物,且血糖控制不佳的患者,太罗不可替代原抗糖尿病药物,则需在其基础上联合应用。
【化学成分】罗格列酮钠【药理作用】药理作用罗格列酮钠为罗格列酮的钠盐,以下为罗格列酮的作用。
罗格列酮属噻唑烷二酮类抗糖尿病药。
通过胰岛素的敏感性而有效地控制血糖。
本品为过氧化物酶体增殖激活受体γ(PPAR-γ)的高选择性强效激动剂。
人类的PPAR受体存在于胰岛素的主要靶组织如肝脏、脂肪和肌肉组织中。
本品激活PPAR-γ受体,可对参与葡萄糖生成,转运和利用的胰岛素的反应基因的转录进行调控。
此外,PPAR-γ反应基因也参与脂肪酸代谢的调节。
在罗格列酮临床研究中,空腹血糖(FPG)和Hb A1c的检测结果表明,罗格列酮改善血糖控制情况,同时伴有血胰岛素和C肽水平降低,也可使餐后血糖和胰岛素水平下降。
罗格列酮对血糖控制的改善作用较持久,可维持达52周。
2型糖尿病的主要病理生理学特征为胰岛素抵抗,罗格列酮的抗糖尿病作用已在2型糖尿病的动物模型[由于靶组织的胰岛素抵抗而出现高血糖症和/或糖耐量下降]中得到显示。
可有效降低ob/ob肥胖小鼠,db/db糖尿病小鼠和Zucker肥胖大鼠模型的糖尿病发展,动物研究提示,本品的抗糖尿病作用是通过提高肝脏、肌肉和脂肪组织对胰岛素的敏感性而实现,并且在脂肪组织中使胰岛素调控的葡萄糖转运因子GLU1-4的基因表达增加,罗格列酮单独使用不会使2型糖尿病和/或糖耐量减低的模型动物出现低血糖。

罗格列酮的常见不良反应和心脏病风险李茜;尤海生;董亚琳【摘要】目的综述罗格列酮的常见不良反应和心脏缺血事件,提示医务人员在治疗糖尿病的同时也应关注潜在的心脏缺血性风险.方法查找PUBMED、CNKI和维普等数据库内罗格列酮的文献资料,汇总分析其常见的不良反应和可能导致的心脏缺血事件.结果罗格列酮常见的不良反应有低血糖、血脂紊乱、肝毒性、水肿和增加心脏缺血事件的风险,肝毒性相对较低,仍需警惕可能产生的严重肝损害.目前对罗格列酮增加心脏缺血事件风险仍然存在一定的争议.结论罗格列酮与心脏的缺血事件有关联,心功能3级或4级的病人应禁用.【期刊名称】《西北药学杂志》【年(卷),期】2009(024)004【总页数】3页(P323-325)【关键词】罗格列酮;不良反应;心脏病【作者】李茜;尤海生;董亚琳【作者单位】西安交通大学医学院第一附属医院药剂科,陕西,西安,710061;西安交通大学医学院第一附属医院药剂科,陕西,西安,710061;西安交通大学医学院第一附属医院药剂科,陕西,西安,710061【正文语种】中文【中图分类】R977罗格列酮(rosiglitazone,RSG)是一种口服用强效胰岛素增敏剂,属于噻唑烷二酮类(TZDs)抗2型糖尿病(NIDDM)药,1999年被美国FDA批准用于临床,商品名文迪雅。
RSG是一种高度选择性和高效的过氧化物酶增殖物激活受体γ(PPAR-γ)激动剂,直接与PPAR-γ受体结合并使之激活发挥胰岛素增敏剂的作用。
RSG减轻胰岛素抵抗(IR),是通过改善外周组织对胰岛素的敏感性而提高血糖的利用,而非刺激胰岛素的合成,临床上作为糖尿病治疗的基础一线用药[1]。
最近《新英格兰医学杂志》网站刊出的研究报告称,罗格列酮具有潜在的安全性问题。
本文对罗格列酮的常见不良反应和心脏病风险进行综述。
罗格列酮的生物利用度高达99%,血浆蛋白结合率达99.8%,分布容积为17.6 L,口服1 h血药浓度达峰值,半衰期约3.5 h;主要在肝脏代谢清除,通过细胞色素P-450(CYP)酶系中的CYP2C8和CYP2C9作用脱甲基化和羟基化,分解为基本无活性的产物,64%经尿排出,23%经消化道排出;与食物同服不影响吸收。



2024年罗格列酮市场规模分析概述罗格列酮(Roglitine)是一种常见的用于治疗2型糖尿病的药物。
它属于双胍类药物,通过降低肝脏对葡萄糖的产生和增加细胞对葡萄糖的摄取来控制血糖水平。
本文将对罗格列酮市场规模进行分析。
市场状况展望未来几年,罗格列酮市场呈现出可观的增长趋势。
这主要归因于以下几个因素:1. 2型糖尿病患者增加2型糖尿病是一种日益普遍的代谢性疾病,其患病率在全球范围内不断上升。
据统计,全球约有5.03亿人患有2型糖尿病,而这一数字预计未来几年将继续增长。
随着患者数量的增加,对罗格列酮等治疗药物的需求也将不断增加。
2. 优势特点罗格列酮在治疗2型糖尿病方面有着一些优势特点。
它具有良好的耐受性和疗效,可有效控制患者的血糖水平。
此外,罗格列酮也被证明对其他相关疾病,如肥胖症和多囊卵巢综合征具有潜在益处。
这些优势特点进一步增加了罗格列酮的市场需求。
3. 新兴市场发展亚洲地区是全球罗格列酮市场的重要增长驱动因素。
亚洲国家(如中国、印度)的经济快速发展导致人口中的中产阶级增加,这部分人群更容易受到2型糖尿病的困扰。
因此,这些新兴市场对罗格列酮的需求也将显著增加。
4. 政府支持和健康教育政府支持和健康教育活动也对罗格列酮市场的增长起到了积极影响。
政府部门鼓励人们进行健康饮食和锻炼,减少2型糖尿病患病风险。
与此同时,医疗机构和非政府组织通过展开健康教育活动,提高人们对2型糖尿病的认识,并推广罗格列酮等药物的使用。
市场竞争罗格列酮市场存在一定的竞争格局。
目前,市场上有多个制药公司生产和销售罗格列酮产品。
主要的竞争对手包括但不限于: - 诺和诺德(Novo Nordisk) - 辉瑞(Pfizer) - 默沙东(Merck Sharp & Dohme)这些公司通过不断进行研发创新,提高产品质量和效果,争夺市场份额。
此外,市场上还存在一些地区性厂商,他们在特定地区具有一定的市场竞争力。
市场前景根据市场状况和竞争格局,罗格列酮市场将有望在未来几年保持稳定增长。

2024年新型糖尿病药物使用手册英文版2024 New Type 2 Diabetes Medication User ManualWelcome to the user manual for the latest type 2 diabetes medications in 2024. This guide will provide you with detailed instructions on how to properly use these innovative drugs to effectively manage your condition.Medication OverviewIn 2024, new type 2 diabetes medications have been developed to improve blood sugar control and reduce the risk of complications. These medications work by targeting specific pathways in the body to regulate glucose levels and improve insulin sensitivity.Dosage InstructionsIt is important to follow the recommended dosage instructions provided by your healthcare provider. Take the medication as prescribed, at the same time each day, to ensure optimal effectiveness. Do not adjust the dosage without consulting your doctor.AdministrationThe new medications are available in various forms, including tablets, injections, and patches. Follow the administration instructions provided with the medication to ensure proper delivery and absorption. If you have any questions about how to administer the medication, consult your pharmacist or healthcare provider.MonitoringRegular monitoring of your blood sugar levels is essential when taking these medications. Keep track of your readings and report any significant changes to your healthcare provider. Monitoring will help you and your doctor adjust your treatment plan as needed.Side EffectsLike all medications, the new type 2 diabetes drugs may have side effects. Common side effects include nausea, headache, and dizziness. If you experience any severe or persistent side effects, contact your healthcare provider immediately.Lifestyle RecommendationsIn addition to taking your medication, it is important to maintain a healthy lifestyle to manage type 2 diabetes effectively. This includes eating a balanced diet, exercising regularly, and monitoring your blood sugar levels. Consult your doctor for personalized recommendations.ConclusionThe new type 2 diabetes medications in 2024 offer promising advancements in the treatment of this chronic condition. By following the instructions in this user manual and working closely with yourhealthcare team, you can achieve better blood sugar control and improve your overall health.Remember, always consult your healthcare provider for personalized advice and guidance on managing your type 2 diabetes.。

FDA Drug Safety CommunicationFDA requires removal of some prescribing and dispensing restrictions for rosiglitazone-containing diabetes medicinesThis update is in follow-up to the FDA Drug Safety Communications issued on November 4, 2011, and May 18, 2011.Safety Announcement[11-25-2013] The U.S. Food and Drug Administration (FDA) has determined that recent data for rosiglitazone-containing drugs, such as Avandia, Avandamet, Avandaryl, and generics, do not show an increased risk of heart attack compared to the standard type 2 diabetes medicines metformin and sulfonylurea. As a result, we are requiring removal of the prescribing and dispensing restrictions for rosiglitazone medicines that were put in place in 2010. This decision is based on our review of data from a large, long-term clinical trial and is supported by a comprehensive, outside, expert re-evaluation of the data conducted by the Duke Clinical Research Institute (DCRI).Type 2 diabetes is a disease that can lead to serious complications and premature death. Rosiglitazone is a treatment option that can improve blood sugar control in some patients with the disease. Patients with type 2 diabetes should continue to work closely with their health care professionals to determine treatment options that are most appropriate.FDA continues to evaluate the safety and effectiveness of drugs after they go on the market. In the case of rosiglitazone medicines, previous data from a large, combined analysis of mostly short-term, randomized clinical trials of rosiglitazone had suggested an elevated risk of heart attack, so we required a Risk Evaluation and Mitigation Strategy (REMS), called the Rosiglitazone REMS program. The Rosiglitazone REMS program restricted the use of rosiglitazone medicines to help ensure that their benefits outweighed the risks.Although some scientific uncertainty about the cardiovascular safety of rosiglitazone medicines still remains, in light of the new re-evaluation of the R osiglitazone E valuated for C ardiovascular O utcomes and R egulation of Glycemia in D iabetes (RECORD) trial, our concern is substantially reduced and the rosiglitazone REMS program requirements will be modified (see Data Summary). We are also requiring revisions to the rosiglitazoneprescribing information and the patient Medication Guide to include this new information.Under FDA’s proposed modifications to the rosiglitazone REMS program:•Distribution of the medicines will no longer be restricted. Rosiglitazone may be used along with diet and exercise to improve control of blood sugar in patients with type2 diabetes mellitus.•Health care professionals, pharmacies, and patients will no longer be required to enroll in the rosiglitazone REMS program to be able to prescribe, dispense, orreceive rosiglitazone medicines.•As part of the REMS, health care professionals who prescribe rosiglitazone medicines will be required to have training about the current state of knowledge concerning the cardiovascular risk of rosiglitazone medicines. Manufacturers will also send Dear Healthcare Provider and Dear Professional Society letters to educate prescribers about the new information.Data SummaryPrevious meta-analyses (large, combined analyses) of trials and observational studies suggested an increased risk of heart attack and other adverse cardiovascular events with rosiglitazone treatment. As a result, FDA required a REMS that restricted the drug’s use. Due to limitations of those data, in 2010 FDA required a comprehensive readjudication (expert re-evaluation) of the results from the RECORD trial. DCRI conducted this readjudication. RECORD was a clinical trial requested by the European Medicines Agency and conducted after rosiglitazone was approved for marketing. RECORD compared the cardiovascular safety of rosiglitazone used in combination with metformin or sulfonylurea to the combination of metformin and sulfonylurea. Metformin and sulfonylurea are other medicines approved to treat diabetes. The original evaluation of RECORD suggested an increase in heart attacks and decreases in the rates of death and stroke in patients treated with rosiglitazone.These results were not statistically significant, which means it is uncertain whether the changes in risk for patients treated with rosiglitazone were due to the drug or due to chance alone. During the course of FDA’s original 2010 review of the RECORD trial, important questions had arisen about potential bias in the identification of cardiovascular events. FDA required this independent review to provide clarity about the integrity of the findings. FDA reviewed DCRI’s readjudicated results, and the findings were later discussed at a June 5-6, 2013, joint meeting of the Endocrinologic and Metabolic Drugs Advisory Committee and the Drug Safety and Risk Management Advisory Committee (for complete background information and safety reviews, see AC Meeting.The readjudicated results could not dismiss an increased risk of heart attack with rosiglitazone versus placebo, because the trial did not use a placebo. However, the readjudicated results did assess rosiglitazone versus the standard-of-care diabetes drugs metformin and sulfonylurea and confirmed the original RECORD finding that did not show an increased risk of heart attack associated with rosiglitazone. In the trial, patients treated with rosiglitazone experienced fewer deaths from a cardiovascular cause, from a stroke, and from a heart attack; fewer nonfatal strokes; and fewer deaths from any cause compared to patients treated with metformin and sulfonylurea. Patients treated with metformin and sulfonylurea had fewer nonfatal heart attacks compared to patients treated with rosiglitazone. However, none of these results were statistically significant, which means it is not clear whether the risk of death, heart attack, and stroke were truly different between rosiglitazone and metformin plus sulfonylurea. Based on the results of the readjudicated RECORD trial, FDA is requiring modifications to the rosiglitazone REMS program to remove the requirements for restricte d distribution.。
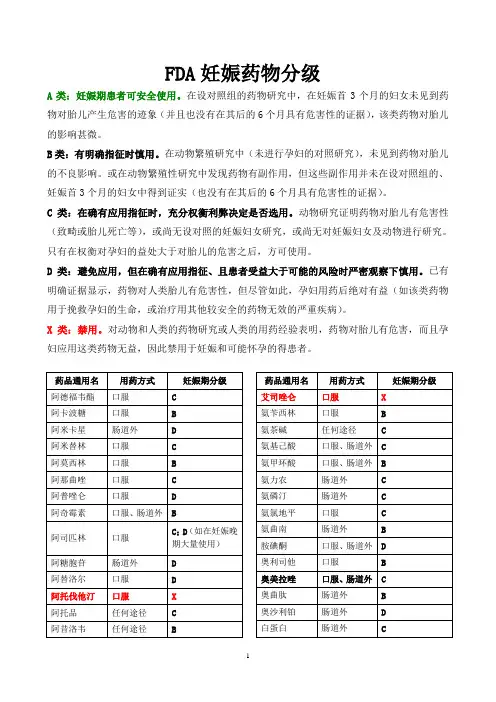
FDA妊娠药物分级
A类:妊娠期患者可安全使用。
在设对照组的药物研究中,在妊娠首3个月的妇女未见到药物对胎儿产生危害的迹象(并且也没有在其后的6个月具有危害性的证据),该类药物对胎儿的影响甚微。
B类:有明确指征时慎用。
在动物繁殖研究中(未进行孕妇的对照研究),未见到药物对胎儿的不良影响。
或在动物繁殖性研究中发现药物有副作用,但这些副作用并未在设对照组的、妊娠首3个月的妇女中得到证实(也没有在其后的6个月具有危害性的证据)。
C类:在确有应用指征时,充分权衡利弊决定是否选用。
动物研究证明药物对胎儿有危害性(致畸或胎儿死亡等),或尚无设对照的妊娠妇女研究,或尚无对妊娠妇女及动物进行研究。
只有在权衡对孕妇的益处大于对胎儿的危害之后,方可使用。
D类:避免应用,但在确有应用指征、且患者受益大于可能的风险时严密观察下慎用。
已有明确证据显示,药物对人类胎儿有危害性,但尽管如此,孕妇用药后绝对有益(如该类药物用于挽救孕妇的生命,或治疗用其他较安全的药物无效的严重疾病)。
X类:禁用。
对动物和人类的药物研究或人类的用药经验表明,药物对胎儿有危害,而且孕妇应用这类药物无益,因此禁用于妊娠和可能怀孕的得患者。

【药物名称】中文通用名称:马来酸罗格列酮英文通用名称:Rosiglitazone Maleate其他名称:罗格列酮、罗格列酮钠、罗西格列酮、圣奥、太罗、文迪雅、Avandia、Rosiglitazone、Rosiglitazone Sodium。
【临床应用】用于2型糖尿病患者。
本药可单独使用,并辅以饮食控制和运动疗法,可控制患者的血糖。
如使用本药或单一其他抗糖尿病药物,并辅以饮食控制和运动疗法,但血糖控制不佳者,本药可与二甲双胍或磺酰脲类药联用。
对服用推荐最大剂量的二甲双胍或磺酰脲类药,但血糖控制不佳者,如本药不能替代原抗糖尿病药,则需在原基础上再联用本药。
【药理】1.药效学本药属噻唑烷二酮类抗糖尿病药,通过提高胰岛素的敏感性而有效地控制血糖。
本药为过氧化物酶体增殖激活受体γ(PPAR-γ)的高选择性、强效激动剂。
人类的PPAR受体存在于胰岛素的主要靶组织,如肝脏、脂肪和肌肉组织中。
本药可激活PPAR-γ核受体,可对参与葡萄糖生成、转运和利用的胰岛素反应基因的转录进行调控。
此外,PPAR-γ反应基因也参与脂肪酸代谢的调节。
在临床研究中,空腹血糖和糖化血红蛋白(HbAlc)的检测结果表明,本药可改善血糖控制情况,同时伴有血胰岛素和C肽水平降低,也可使餐后血糖和胰岛素水平下降。
本药对血糖控制的改善作用较持久,可维持达52周。
本药的抗糖尿病作用已在2型糖尿病的动物模型[由于靶组织的胰岛素抵抗而出现高血糖症和(或)糖耐量下降]中得到显示,可有效地降低动物的血糖,减轻其高胰岛素血症,并可延缓其糖尿病发展。
动物研究提示,本药的抗糖尿病作用是通过提高肝脏、肌肉和脂肪组织对胰岛素的敏感性,且在脂肪组织中使胰岛素调控的葡萄糖转运因子GLUT-4的基因表达增加。
本药不会使2型糖尿病和(或)糖耐量减低的模型动物出现低血糖。
2.药动学在治疗剂量范围内,本药的血浆峰浓度与曲线下面积(AUC)随剂量增加而成比例增加。
口服本药后,绝对生物利用度为99%,达峰时间为1小时,平均分布容积约17.6L,约99.8%本药与血浆蛋白(主要为白蛋白)结合。

二甲双胍马来酸罗格列酮【药物名称】中文通用名称:二甲双胍马来酸罗格列酮英文通用名称:Metformin Hydrochloride and Rosiglitazone Maleate其他名称:复方马来酸罗格列酮、罗格列酮盐酸二甲双胍、文达敏、Avandamet。
【组成成分】本药主要成分为盐酸二甲双胍、马来酸罗格列酮。
【临床应用】在饮食控制和运动的基础上,用于目前正使用罗格列酮和二甲双胍联合治疗的患者或单用二甲双胍治疗后血糖控制不佳的患者的血糖改善。
【药理】1.药效学本药为治疗2型糖尿病的口服降糖药,马来酸罗格列酮属于噻唑烷二酮类化合物,为胰岛素增敏药,主要提高外周靶器官对葡萄糖的利用。
可通过增强组织对胰岛素的敏感性和降低循环胰岛素水平,改善血糖控制。
罗格列酮为高选择性的过氧化物酶体增殖激活受体γ(PPARγ)激动药,胰岛素的主要靶组织(如肝脏、脂肪和肌肉组织)中均存在PPAR受体,激活PPAR-γ核受体,可对参与葡萄糖生成、转运和利用的胰岛素效应基因的转录进行调控,同时也参与了脂肪酸代谢的调节。
胰岛素抵抗是2型糖尿病的常见致病因素,2型糖尿病动物模型[由于靶组织的胰岛素抵抗出现高血糖症和(或)糖耐量降低]研究显示,其具有抗糖尿病作用,还可降低ob/ob肥胖小鼠、db/db糖尿病小鼠和Zucker肥胖大鼠的血糖浓度。
其抗糖尿病作用是通过提高肝脏、肌肉和脂肪组织对胰岛素的敏感性而实现,且在脂肪组织中使胰岛素调控的葡萄糖转运因子GLUT-4的基因表达增加,不诱导2型糖尿病和(或)糖耐量减低的模型动物出现低血糖。
盐酸二甲双胍属于双胍类化合物,为降血糖药,作用主要为降低内源性肝糖生成。
可改善2型糖尿病患者的糖耐量,降低其基础和餐后血浆血糖,作用机制不同于其他类口服降糖药,可减少肝糖生成,抑制葡萄糖的肠道吸收,增加外周组织对葡萄糖的摄取和利用。
与磺酰脲类药物不同,2型糖尿病患者和正常人服用二甲双胍后一般不出现低血糖,且不产生高胰岛素血症。
胰岛素及口服降糖药的基本知识任务三胰岛素及口服降糖药的基本知识学习目标知识目标(1)掌握胰岛素的作用、作用机制、应用及不良反应;(2)熟悉磺酰脲类及双胍类的作用、作用机制、应用和不良反应;(3)了解几种胰岛素制剂、α-葡萄糖苷酶抑制药和其他新型降糖药的作用特点。
能力目标(1)能为糖尿病患者合理选用降糖药,及时处理药物不良反应;(2)能说出口服降糖药的作用特点、主要不良反应表现及处理方法。
案例引导近年来,糖尿病患者数量明显增加,应熟悉治疗糖尿病的药物,掌握胰岛素的作用、应用及其不良反应带来的后果及处理方法。
应熟悉磺酰脲类及双胍类的作用、应用和不良反应及处理方法。
案例分析:患者,男,18岁。
患者于7年前出现口渴、多饮,每天饮水4500 mL,尿频,量多,基本与日饮水量相当,多食易饥,每餐进食约400g。
当地医院检查空腹血糖12.9mmol/L,尿酮体(+++),给予胰岛素治疗。
一周前因情绪变化上述症状加重,实验室检查:空腹血糖18.9mmol/L,甘油三酯2.69mmol/L。
后换用人胰岛素治疗,症状缓解。
本案例为胰岛素抵抗患者,需换用其他制剂或增加胰岛素剂量缓解病情。
糖尿病(diabetes mellitus,DM)是一组以慢性高血糖为主要特征的代谢内分泌病。
其发病率持续上升,已成为全世界发病率和死亡率最高的5种疾病之一。
临床上糖尿病可分为以下几种类型。
①1型糖尿病(insulin-dependent diabetes mellitus,IDDM,胰岛素依赖型):胰岛β细胞破坏,引起胰岛素绝对缺乏。
多见于青少年,大多发病较快,病情较重,症状明显且严重,有酮症酸中毒倾向。
②2型糖尿病(non-insulin-dependent diabetes mellitus,NIDDM,非胰岛素依赖型):病因复杂,与遗传、环境等因素有关。
患者有胰岛素抵抗和胰岛素分泌缺陷,血中胰岛素水平可正常或升高。
多见于成年肥胖者,发病缓慢,病情相对较轻。
素的患者。
如果需要联合治疗,则应密切关注;○如果噻唑烷二酮类药物与胰岛素联合用药,则应观察患者心衰的体征和症状,如体重增加
和水肿。
若出现任何心脏病加重的症状,则应停用吡格列酮。
(E M A 网站)
F D A 修订罗格列酮说明书和用药指南
2011年3月2日,美国食品药品管理局
(F D A )向公众发布信息,通报关于在医师用说明书和患者用药指南中增加了关于糖尿病药物罗格列酮(r o s i g l i t a z o n e ,A v a n d i a )的心血管风险(包括心脏病发作)的信息。
罗格列酮可作为单一成分制剂以商品名文迪雅进行销售,也可作为复方制剂以商品名文达敏(罗格列酮+二甲双胍)和A v a n d a r y l (罗格列酮+格列美脲)销售。
F D A 曾于2010年9月发布信息宣布,将严格限制含有罗格列酮药物的使用,仅用于其他药物不能控制血糖的2型糖尿病患者。
这些新的限制性措施是基于表明使用罗格列酮治疗的患者心脏病发作风险升高的数据而采取的。
修订说明书和患者用药指南是限制性措施的一部分。
除了增加对心血管风险的描述外,修订的说明书还明确了罗格列酮和含有罗格列酮的药物仅用于:已经使用这些药物治疗的患者,使用其他抗糖尿病药不能控制血糖的患者,以及在与医生商量后,不愿意使用含有吡格列酮药物的患者。
目前,有关罗格列酮的风险评估与最小化计划(R E M S )还没有获得批准。
在随后的几个月内,
F D A 将提供更多的关于R E M S 计划的信息。
F D A
预计会在2011年春天批准R E M S ,并且在其后的6个月内,生产商将付诸实施。
F D A 给医生的建议:
○在本公告发布时,含有罗格列酮的药物的R E M S 还没有实施。
医生仍可继续按照已修改的药品说明书开具处方含有罗格列酮的药物;○医生应该与患者讨论使用含有罗格列酮的药物与其他治疗方法相比较的风险和受益,并且为每个患者选择最佳的治疗方案;
○当患者在药房取药时,鼓励他们阅读提供给他们的罗格列酮用药指南。
F D A 给患者的建议:
○虽然在医生指导下患者仍可以继续使用含有罗格列酮的药物,但是了解该药物的风险和受益是非常重要的;
○如果对含有罗格列酮的药物有所担心,应咨询医生;
○服用含有罗格列酮的药物前,应阅读用药指南,它解释了与罗格列酮的使用有关的风险。
(美国F D A 网站)
美国警告孕妇服用托吡酯可能导致新生儿口裂
2011年3月4日,美国食品药品管理局(F D A )发布信息称,新的数据表明,妇女怀孕期间使用托吡酯(t o p i r a m a t e )其出生的婴儿发生唇裂
和/或腭裂的风险升高。
托吡酯是F D A 批准的一种抗惊厥药,单独治疗或与其他药物联合治疗癫痫。
F D A 还批准该药用于偏头痛治疗,但不用于缓解偏头痛症状。
托吡酯常被超适应症用于其他疾病,其中一些可能并不严重。
来自北美抗癫痫药(N A A E D )妊娠登记处的数据表明,在妊娠期前3个月暴露于托吡酯的婴
儿发生口裂的风险增加,口裂的发生率为1.4%,暴露于其他抗癫痫药(A E D s )的婴儿口裂的发生率为0.38%-0.55%,无癫痫症或没有使用过其他抗癫痫药的孕妇,出生婴儿的口裂发生率为0.07%。
N A A E D 妊娠登记处的数据表明,与未经治疗的背景人群相比,怀孕期间暴露于托吡酯发生口裂的相对风险是21.3(95%C I 7.9-57.1)。
英国癫痫症和妊娠登记处报告婴儿暴露于托吡酯单药,口裂的发生率出现类似的增加,与背景人群的风险相比升高16倍。
托吡酯以前是被划分为妊娠目录C 的药物,
·
124·柳州医学 2011年第24卷第2期。