第十四章过渡元素ⅣB-ⅦBⅧ-资料
- 格式:ppt
- 大小:117.51 KB
- 文档页数:36



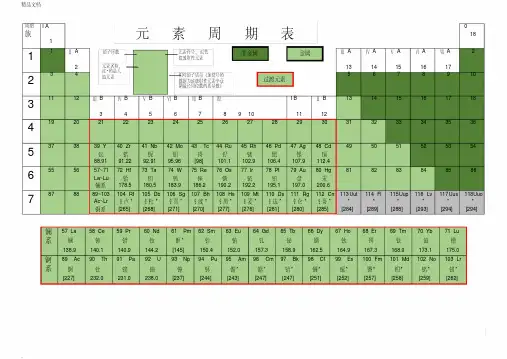
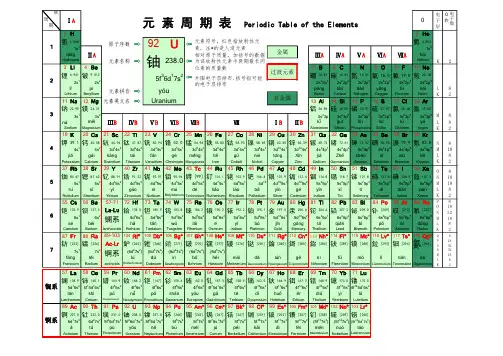

过渡元素的结构特点与基本性质元素周期表中第四、五、六七周期元素中,第ⅢB~ⅤⅢ族,共25种元素,统称为过渡元素。
过渡元素的单质都是金属,所以也称为过渡金属元素。
见表16.1.5s0,是一种例外的电子排布)。
镧系、锕系的元素的电子排布,增加的电子填入(n-2)f亚层,例如:57La 4f 05d1 6s 2,在结构上,它们最外层二个电子层都是未充满的,因此在元素周期表的划分上不属于过渡金属元素,而属于内过渡元素。
也称之为镧系、锕系元素。
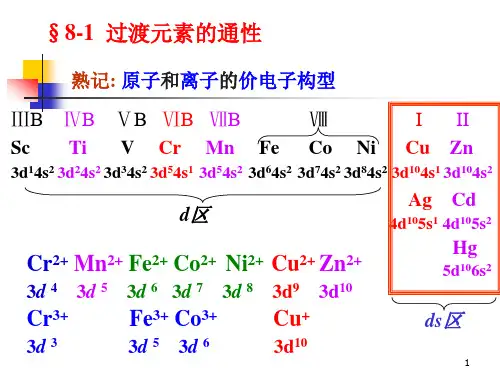
镧系57La ~ 71Lu (15种元素) 4f 0~145d0-1 6s2锕系89Ac~103Lr铹(15种元素)5f 0~146d0~1 7s216.1.1 价电子构型过渡金属价电子构型的通式为:(n-1)d1~9 ns1~2。
原子核外电子排布遵循能量最低原理、保里不相容原理和洪特规则。
L. Pauling 原子轨道近似能级图如下:1s; 2s 2p ; 3s 3p; 4s 3d 4p; 5s 4d 5p; 6s 4f 5d 6p ; 7s 5f 6d也有一些电子排布例外的情况,例如:Z = 24,41 ~ 46:Nb 铌4d45s1不是4d35s241W 钨 5d46s2不是4d55s142Ru 钌4d75s1不是4d65s244Rh 铑4d85s1不是4d75s245Pd 钯4d105s0 不是4d85s24616.1.2 氧化态的规律过渡金属元素常表现为多种氧化态,其根本原因在于内层电子的排布,过渡金属外层电子排布为:(n-1)d1~9 ns1~2 ,(n-1)d轨道与ns轨道能量相近,部分(n-1)d电子参与成键。
例:Mn:+2 ~ +7均出现,主要+2,+3,+4,+6,+7.Fe:+2 ~ +6均出现,主要+2,+3,+6.过渡金属元素的最高氧化态与所在的族相等,最高氧化态= 所处的族数例:Sc +3 Ⅲ3d14s2Cr +6 Ⅵ3d54s1Mn +7 Ⅶ3d54s1但Ⅷ族:多数最高氧化态小于其族数,是因为随着有效核电荷的增加(Z *↑),不是所有(n-1)d 电子都参与成键。
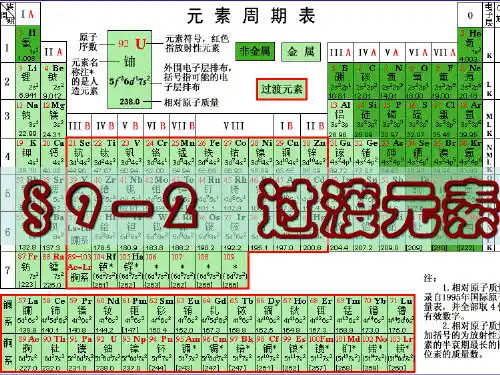


考纲要求:①了解元素、核素和同位素的含义。
②了解原子的构成。
了解原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系。
③了解原子核外电子排布规律。
④掌握元素周期律的实质。
了解元素周期表(长式)的结构(周期、族)及其应用。
⑤以第3周期为例,掌握同一周期内元素性质的递变规律与原子结构的关系。
⑥以ⅠA 和ⅦA 族为例,掌握同一主族内元素性质递变规律与原子结构的关系。
⑦了解金属、非金属元素在周期表中的位置及其性质递变规律。
⑧了解化学键的定义。
了解离子键、共价键的形成。
知识点总结:中子N(核素)原子核质子Z → 元素符号原子结构 : 决定原子呈电中性 电子数(Z 个):化学性质及最高正价和族序数核外电子 运动特征:体积小,运动速率高(近光速)排布规律 → 电子层数 周期序数及原子半径 表示方法 → 原子(离子)的电子式、原子结构示意图1.原子结构[核电荷数、核内质子数及核外电子数的关系]核电荷数=核内质子数=原子核外电子数注意: (1) 阴离子:核外电子数=质子数+所带的电荷数阳离子:核外电子数=质子数-所带的电荷数(2)“核电荷数”与“电荷数”是不同的,Cl -的核电荷数为17,电荷数为1.[质量数] 用符号A 表示.将某元素原子核内的所有质子和中子的相对质量取近似整数决定X)(A Z值相加所得的整数值,叫做该原子的质量数.说明(1)质量数(A)、质子数(Z)、中子数(N)的关系:A=Z + N.(2)符号A Z X的意义:表示元素符号为X,质量数为A,核电荷数(质子数)为Z的一个原子.例如,2311Na中,Na原子的质量数为23、质子数为11、中子数为12.[原子核外电子运动的特征](1)当电子在原子核外很小的空间内作高速运动时,没有确定的轨道,不能同时准确地测定电子在某一时刻所处的位置和运动的速度,也不能描绘出它的运动轨迹.在描述核外电子的运动时,只能指出它在原子核外空间某处出现机会的多少.(2)描述电子在原子核外空间某处出现几率多少的图像,叫做电子云.电子云图中的小黑点不表示电子数,只表示电子在核外空间出现的几率.电子云密度的大小,表明了电子在核外空间单位体积内出现几率的多少.(3)在通常状况下,氢原子的电子云呈球形对称。
周期族I A元素周期表0181 2 311 HⅡ A氢1.00823 Li4 Be锂铍6.9419.01211 Na12 Mg钠镁原子序数元素名称,注*的是人造元素Ⅲ BⅣ B8 O元素符号,红色非金属指放射性元素氧相对原子质量(加括号的16.00数据为该放射性元素半衰期最长同位数的质量数)Ⅴ BⅥ BⅦ BⅧ金属Ⅲ AⅣ AⅤ A131415过渡元素5 B6 C7 N硼碳氮10.8112.0114.01I BⅡ B13 Al14 Si15 P铝硅磷Ⅵ AⅦ A 2 He氦1617 4.0038 O9 F10 Ne氧氟氖16.0019.0020.1816 S17 Cl18 Ar硫氯氩4 5 6 722.9924.3134567891019 K20Ca21 Se22 Ti23 V24 Cr25 Mn26 Fe27Co钾钙钪钛钒铬锰铁钴39.1040.0844.9647.8750.9452.0054.9455.8558.9337 Rb38Sr39 Y40 Zr41 Nb42 Mo43 Tc44 Ru45Rh铷锶钇锆铌钼锝钌铑85.4787.6288.9191.2292.9195.96[98]101.1102.955 Cs56Ba57~7172 Hf73 Ta74 W75 Re76 Os77Ir铯钡La~Lu铪钽钨铼锇铱132.9137.3镧系178.5180.5183.9186.2190.2192.287 Fr88Ra89~103104 Rf105 Db106 Sg107 Bh108 Hs109 Mt钫镭Ac~Lr钅卢 *钅杜 *钅喜 *钅波 *钅黑 *钅麦 *[223][226]锕系[265][268][271][270][277][276]111226.9828.0930.9728 Ni29 Cu30 Zn31 Ga32 Ge33 As镍铜锌镓锗砷58.6963.5565.3869.7272.6374.9246 Pd47 Ag48 Cd49 In50 Sn51 Sb钯银镉铟锡锑106.4107.9112.4114.8118.7121.878 Pt79 Au80 Hg81 Ti82 Pb83 Bi铂金汞铊铅铋195.1197.0200.6204.4207.2209.0110 Ds111 Rg112 Cn113Uut114 Fl115Uup钅达 *钅仑 *钅哥 ****[281][280][285][284][289][288]32.0635.4539.9534 Se35 Br36 Kr硒溴氪78.9679.9083.8052 Te53 I54 Xe碲碘氙127.6126.9131.384 Po85 At86 Rn钋砹氡[209][210][222]116 Lv117Uus118Uuo***[293][294][294]镧系锕系57La58Ce59Pr60 Nd61Pm62Sm63Eu64Gd65Tb66Dy67Ho68 Er69 Tm70 Yb71 Lu镧铈镨钕钷 *钐铕钆铋镝钬铒铥镱镥138.9140.1140.9144.2[145]150.4152.0157.3158.9162.5164.9167.3168.9173.1175.0 89Ac90Th91Pa92 U93Np94Pu95Am96Cm97Bk98Cf99Es100 Fm101 Md102 No103 Lr锕钍镤铀镎钚镅 *锯 *锫 *锎 *锿 *镄 *钔 *锘 *铹 *[227]232.0231.0238.0[237][244][243][247][247][251][252][257][258][259][262]一、部分酸、碱和盐的溶解性表(室温)元素周期表有关知识NaOH烧碱、火碱、苛性钠KOH苛性钾阳离子阴离子H+NH4+K+Na+Ba2+Ca2+2+MɡAl 3+2+MnZn2+Fe2+Fe3+Cu2++Aɡ物的俗名化学式NaClNa2CO3--Cl-2-2-OH NO SO CO343溶、挥溶、挥溶溶、挥溶、挥溶溶溶溶溶溶溶溶溶溶溶溶溶溶溶溶溶不不微溶溶微不不溶溶溶微不溶溶溶-不溶溶溶不不溶溶溶不不溶溶溶不不溶溶溶-不溶溶溶--溶不微不俗名化学式食盐MgCl2·6H2O纯碱、苏打NaHCO3说明:“溶”表示那种物质可溶于水,“不”表示不溶于水,“微”表示微溶于水,“挥”表示挥发性,“ - ”表示那种物质不存在或遇水就分解了。