第十四章过渡元素分析
- 格式:doc
- 大小:117.00 KB
- 文档页数:11


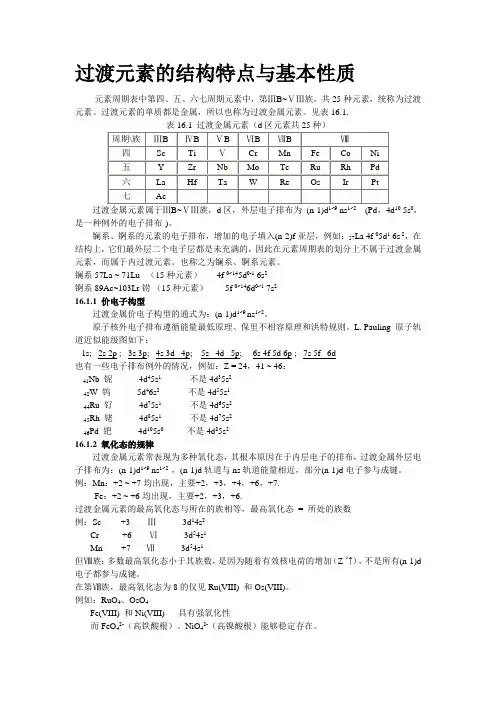
过渡元素的结构特点与基本性质元素周期表中第四、五、六七周期元素中,第ⅢB~ⅤⅢ族,共25种元素,统称为过渡元素。
过渡元素的单质都是金属,所以也称为过渡金属元素。
见表16.1.5s0,是一种例外的电子排布)。
镧系、锕系的元素的电子排布,增加的电子填入(n-2)f亚层,例如:57La 4f 05d1 6s 2,在结构上,它们最外层二个电子层都是未充满的,因此在元素周期表的划分上不属于过渡金属元素,而属于内过渡元素。
也称之为镧系、锕系元素。
镧系57La ~ 71Lu (15种元素) 4f 0~145d0-1 6s2锕系89Ac~103Lr铹(15种元素)5f 0~146d0~1 7s216.1.1 价电子构型过渡金属价电子构型的通式为:(n-1)d1~9 ns1~2。
原子核外电子排布遵循能量最低原理、保里不相容原理和洪特规则。
L. Pauling 原子轨道近似能级图如下:1s; 2s 2p ; 3s 3p; 4s 3d 4p; 5s 4d 5p; 6s 4f 5d 6p ; 7s 5f 6d也有一些电子排布例外的情况,例如:Z = 24,41 ~ 46:Nb 铌4d45s1不是4d35s241W 钨 5d46s2不是4d55s142Ru 钌4d75s1不是4d65s244Rh 铑4d85s1不是4d75s245Pd 钯4d105s0 不是4d85s24616.1.2 氧化态的规律过渡金属元素常表现为多种氧化态,其根本原因在于内层电子的排布,过渡金属外层电子排布为:(n-1)d1~9 ns1~2 ,(n-1)d轨道与ns轨道能量相近,部分(n-1)d电子参与成键。
例:Mn:+2 ~ +7均出现,主要+2,+3,+4,+6,+7.Fe:+2 ~ +6均出现,主要+2,+3,+6.过渡金属元素的最高氧化态与所在的族相等,最高氧化态= 所处的族数例:Sc +3 Ⅲ3d14s2Cr +6 Ⅵ3d54s1Mn +7 Ⅶ3d54s1但Ⅷ族:多数最高氧化态小于其族数,是因为随着有效核电荷的增加(Z *↑),不是所有(n-1)d 电子都参与成键。


过渡元素化学知识点总结过渡元素具有以下特点:1. 电子结构:过渡元素的电子结构特点主要是d轨道的填充,使得它们的化学性质发生变化。
具体来说,过渡元素通常有一个未填满的d轨道,这使得它们的化学性质具有多样性和复杂性。
2. 氧化态:过渡元素通常能够显示多种氧化态,这与其未填满的d轨道有关。
例如,铁元素可以显示+2和+3的氧化态,铜元素可以显示+1和+2的氧化态,这种性质使过渡元素在形成化合物时具有很大的灵活性。
3. 彩色化合物:由于过渡元素的未填满的d轨道和多重氧化态,它们通常能形成彩色的化合物。
这些彩色化合物在生活中有很多应用,比如颜料、染料、陶瓷等,彩色化合物也是化学研究和实验室实验中的常见物质。
4. 催化性质:过渡元素在催化反应中起着重要的作用。
由于其不规则的电子填充和氧化态变化,使得其化合物在催化反应中具有活性和选择性。
比如钯、铑、铂等催化剂在工业上有重要的应用,如有机合成、汽车尾气处理等领域。
5. 锂离子电池:锂离子电池作为一种重要的储能装置,过渡元素在其中起着关键作用。
比如正极材料主要由过渡金属氧化物和磷酸盐组成,其中含有镍、钴、锰等过渡元素,它们的电化学性能决定了电池的容量和循环寿命。
6. 过渡金属配合物:过渡元素通常能够形成配合物,即与配体形成稳定的化合物。
这些配合物具有多种性质,如颜色、磁性、光谱性质等,具有多样的应用。
比如金刚石、钟亭草碱等药物中都含有过渡金属配合物。
过渡元素化学知识点总结:1. 电子结构:过渡元素的电子结构特点是d轨道的填充,未填满的d轨道决定了过渡元素的化学性质的复杂性和多样性。
2. 氧化态:过渡元素通常能够显示多种氧化态,这与其未填满的d轨道有关,使得过渡元素具有很大的化学活性和灵活性。
3. 彩色化合物:过渡元素的多重氧化态和未填满的d轨道使得其形成的化合物通常具有彩色,这些彩色化合物在生活中有很多应用。
4. 催化性质:过渡元素在催化反应中有重要的应用,其化合物在催化反应中具有活性和选择性。

元素周期表中过渡元素的性质与应用元素周期表是化学家们总结和分类元素的重要工具,其中过渡元素是指周期表中第3-12组元素,包括3d、4d、5d轨道上的元素。
过渡元素具有独特的性质和广泛的应用,对于理解物质的组成和性质变化有着重要的意义。
本文将讨论过渡元素的性质以及它们在不同领域的应用。
一、过渡元素的性质1. 多价性和化合价变化:过渡元素具有多个氧化态,即多价性。
这是由于过渡元素具有既能失去电子形成正离子,也能获得电子形成负离子的能力。
因此,它们能够形成不同的化合价,参与到多种反应中。
2. 颜色和吸收光谱:许多过渡元素及其化合物具有鲜明的颜色,这是由于它们能够吸收一定波长的光,在可见光区域发生电子跃迁。
例如,铜的化合物呈现蓝绿色、钴的化合物呈现鲜艳的红色等。
这一性质使得过渡元素在颜料、染料等方面有重要应用。
3. 催化活性:许多过渡元素及其化合物具有良好的催化活性。
它们可以在反应中降低活化能,加速反应速率。
常见的过渡金属催化剂包括钯、铂、镍等,它们在有机合成、能源转化等领域发挥着重要作用。
4. 形成强稳络合物:过渡元素常常形成稳定的配合物。
它们能够与配体发生配位键,形成配位化合物。
这些络合物具有丰富的结构和性质,广泛应用于催化、荧光材料、生物医学等领域。
5. 磁性行为:过渡元素和其化合物具有丰富的磁性行为。
其中,具有未被填满的d轨道的过渡金属离子更容易表现出明显的磁性。
这一性质使得它们在磁性材料、数据存储等领域有广泛应用。
二、过渡元素的应用1. 工业催化剂:许多过渡金属催化剂被广泛应用于化工生产中。
例如,钯催化剂可用于加氢反应、芳香化反应等;铑催化剂可用于氧化反应等。
这些催化剂能够提高反应速率、选择性和产率,降低生产成本。
2. 电子材料:过渡元素及其化合物在电子材料领域发挥着重要作用。
铜、铝、铁等过渡金属被广泛应用于电线、电缆等导电材料中。
同时,过渡金属氧化物也是光电子器件、可见光催化剂等的重要组成部分。



元素周期表中的过渡元素元素周期表是化学中最为重要的工具之一,它按照元素的原子序数排列,将各种元素分类并展示其基本性质。
其中,过渡元素是元素周期表中的一个重要分类。
本文将对过渡元素进行详细的介绍和解析。
一、什么是过渡元素过渡元素,又称过渡金属元素,是指元素周期表中位于d区的元素。
具体来说,它们位于周期表的第4至7周期,并且填充d轨道的电子数量从1至10,即d1至d10。
过渡元素具有一些特殊的性质,使得它们在化学反应和催化过程中起到重要的作用。
二、过渡元素的特性和性质1. 原子结构和电子配置过渡元素的原子结构是它们特殊性质的基础。
由于过渡元素具有填充d轨道的电子,其电子配置比较复杂。
以铁(Fe)为例,其电子配置为 [Ar] 3d^6 4s^2。
可以看出,过渡元素的电子配置中包含了未填满的d轨道和填满的s轨道。
2. 多种化合价和化合物形成过渡元素常常能够形成多种化合价和化合物。
这是因为过渡元素的d轨道中的电子容易发生配位反应,形成不同化合物的结构。
以铜(Cu)为例,它可以形成Cu+和Cu2+两种离子,分别与不同的配体形成多种不同的配合物。
3. 颜色和催化性能过渡元素及其化合物常常具有鲜艳的颜色,这是由于它们的d轨道电子发生跃迁所致。
这种特性使得过渡元素被广泛应用在染料、颜料和催化剂等领域。
例如,钛(Ti)被广泛用于催化剂制备中,而铬(Cr)则用于制造不锈钢。
4. 磁性和电导性由于过渡元素具有未填充的d轨道电子,它们常常表现出良好的磁性和电导性。
例如,铁(Fe)和钴(Co)是常见的磁性材料,可以用于制造磁铁和磁带。
铜(Cu)和银(Ag)则是良好的电导体,广泛用于导线和电路中。
三、过渡元素的应用1. 催化剂过渡元素及其化合物在催化剂制备中具有重要的应用。
催化剂可以加速化学反应速率,降低反应温度和能源消耗。
铂(Pt)和钯(Pd)常被用作催化剂,例如在汽车尾气净化中,它们能将有害气体转化为无害物质。
2. 电池和电子器件过渡元素在电池和电子器件中也发挥着重要的作用。

过渡元素的结构化学i -回复什么是过渡元素的结构化学?如何计算过渡元素的电子排布?过渡元素的结构化学对于化学反应有什么影响?本文将分步解答这些问题,并深入探讨过渡元素的结构化学。
1. 什么是过渡元素的结构化学?过渡元素是指位于周期表中3d, 4d和5d区的元素,它们由于具备一些特殊的结构和电子排布而被称为过渡元素。
过渡元素的结构化学研究的是这些元素的化学性质和反应机制,以及它们的结构和构型如何影响这些性质和反应。
2. 如何计算过渡元素的电子排布?过渡元素的电子排布可以通过填充d轨道和s轨道上的电子来确定。
为了简化计算,我们可以使用元素的原子序数来确定这个排布。
例如,咱们来看一下铁元素(Fe,原子序数26)的电子排布:首先,填充1s轨道上的2个电子。
然后填充2s轨道上的2个电子。
接下来,填充2p轨道上的6个电子。
然后,填充3s轨道上的2个电子。
接着,填充3p轨道上的6个电子。
然后,填充4s轨道上的2个电子。
最后,填充3d轨道上的6个电子。
3. 过渡元素的结构化学对于化学反应有什么影响?过渡元素的结构和电子排布对于其化学性质和反应机制有着重要的影响。
以下是一些常见的影响因素:- 价态变化:过渡元素通常可以在反应中改变氧化态。
这是由于过渡金属中心的d电子可以相互转移和重排,从而产生不同的氧化态。
- 反应速率:过渡金属通常具有较高的反应活性,这是由于其d电子层的特殊结构和构型。
这些电子可以参与反应中的电子传递和配位作用,从而加速化学反应的速率。
- 配位化学:过渡金属通常可以形成配合物,这是由于其d电子层可以与其他分子或离子发生配位作用。
这种配位作用可以影响化学反应的机理和产物。
- 光谱性质:过渡金属通常具有丰富的光谱性质,这是由于其d电子的能级结构和跃迁性质。
这些光谱性质可以用于研究过渡金属的结构和反应机制。
综上所述,过渡元素的结构化学涉及到过渡金属的电子排布和化学性质之间的关系。
通过了解过渡元素的电子结构和构型,我们可以更好地理解和预测其化学性质和反应行为。
化学中的过渡元素
过渡元素是化学元素周期表中3到12族元素的总称,它们在化学性质上表现
出许多独特的特征。
过渡元素在化学反应中常常扮演催化剂的角色,对催化反应具有重要影响。
在自然界中,过渡元素广泛存在于矿物、岩石和生物体系中。
过渡元素的特性
1.电子结构复杂:过渡元素的原子内电子结构相对较为复杂,其中的
电子填充到d轨道中,形成不同的电子排布。
2.多价态:过渡元素常常呈现不同的氧化态,由于d轨道的电子容易
失去或获得,使其能在不同的氧化态之间转变。
3.催化活性:过渡元素常常表现出良好的催化活性,对于许多化学反
应中的反应速率有显著影响。
过渡元素的应用
1.合金制备:过渡元素常用于合金的制备中,如钛合金、钨合金等,
合金常常具有优良的机械性能和耐高温性能。
2.催化剂:过渡元素广泛应用于化学工业中的催化剂制备,如铂、钯、
铁等元素在氢化反应、氧化反应中发挥着重要作用。
3.生物体系:过渡元素在生物体系中也扮演着重要角色,如铁元素在
血液中的氧气运输、锌元素在酶活性中的作用等。
过渡元素的周期表分布
过渡元素在周期表中主要分布在3到12族之间,包括铁系、铬系、锰系、镍
系等,它们的物理化学性质各有不同,但都具有过渡元素的共同特征。
总之,过渡元素在化学中扮演着重要角色,其多样的化学性质和广泛的应用使
其成为化学领域中不可或缺的一部分。
希望通过对过渡元素的研究和应用,能够推动化学技术的发展和创新。
过渡元素(一)要求(1)从电子层结构的特点理解d区元素的通性。
(2)了解钛、钒、铬重要化合物的化学性质。
了解钼、钨的重要化合物。
(3)掌握Mn(Ⅱ)、Mn(Ⅳ)、Mn(Ⅵ)、Mn(Ⅶ)重要化合物的化学性质以及各氧化态锰之间相互转化关系。
(4)掌握铁、钴、镍的化合物在反应性上的差异。
熟悉铁、钴、镍的重要配合物。
(5)了解铂及其重要化合物的性质。
(一) 过渡元素通性过渡元素一般是指原子的电子层结构中d轨道或f轨道仅部分填充的元素。
因此过渡元素实际上包括d区元素和f区元素。
本章主要讨论d区元素。
d区元素价电子构型为(n-1)d1~8ns1~2(Pd 4d10和Pt 5d96s1例外), 最外两层电子均未填满。
由此构成了d区元素如下通性:(1)单质相似性最外层电子一般不超过2个,较易失去,所以它们都是金属。
又因为d区元素有较大的有效核电荷,d电子有一定的成键能力,所以它们一般有较小的原子半径、较大的密度、较高的熔点和良好的导电导热性。
例如Os的密度(22.488 g∙cm−3),W的熔点(3380 o C,Cr的硬度都是金属中最大的。
d区元素化学活泼性也较接近。
(2)有可变氧化态因(n-1)d轨道和ns轨道的能量相近,d电子可以全部或部分参与成键,所以除ⅢB族只有+3氧化态外,其他各族都有可变的氧化态。
氧化态变化趋势是同一周期从左到右逐渐升高,然后降低;同一族从上到下高氧化态趋于稳定。
例如MnO4−有强氧化性,而ReO4−无氧化性。
例1对同一族元素来说,随周期数增加,为什么主族元素低氧化态趋于稳定而过渡元素高氧化态趋于稳定?主族元素(主要表现在ⅢA,ⅣA,ⅤA族)随周期数增加,低氧化态趋于稳定的原因一般归因于“惰性电子对效应”。
为什么过渡元素随周期数增加高氧化态趋于稳定呢? 仔细研究一下过渡元素的电离能可发现:I1和I2往往是第二、第三过渡系列比第一过渡系列的大,但从I3开始,往往第二、第三过渡系列比第一过渡系列的小。
13-6 铜族元素13-6-1 铜族元素概述一、铜族元素通性1.价层电子构型为(n-1)d10n s1,氧化数有+1、+2、+3,铜、银、金最常见的氧化数分别为+2、+1、+3 。
2.铜族金属离子具有较强的极化力,本身变形性又大,所以它们的二元化合物一般有相当程度的共价性。
3.与其它过渡元素类似,易形成配合物。
二、铜族元素单质1.它们的密度大,都是重金属,其中金的密度最大,为19.3g·cm-3。
2.硬度小、有极好的延展性和可塑性,金更为突出,3.导热、导电能力极强,尤以银为最,铜是最通用的导体。
4.铜、银、金能与许多金属形成合金。
5.铜、银、金的化学活泼性较差。
铜:在干燥空气中铜很稳定,有二氧化碳及湿气存在,则表面上生成绿色的碱式碳酸铜2Cu + O2 + H2O + CO2─→ Cu2(OH)2CO3金:在高温下唯一不与氧气起反应的金属,在自然界中仅与碲形成天然化合物(碲化金)。
银:在室温下不与氧气、水作用,即使在高温下也不与氢、氮或碳作用,与卤素反应较慢,但即使在室温下与含有H2S的空气接触时,表面因蒙上一层Ag2S而发暗,这是银币和银首饰变暗的原因。
4Ag + 2H2S + O2─→ 2Ag2S + 2H2O铜、银不溶于非氧化性稀酸,能与硝酸、热的浓硫酸作用:Cu + 4HNO3(浓)─→ Cu(NO3)2 + NO2↑+ 2H2O3Cu + 8HNO3(稀)─→ 3Cu(NO3)2 + 2NO↑+ 4H2OCu + 2H2SO4(浓) ─→ CuSO4 + SO2↑+ 2H2O2Ag + 2H2SO4(浓) ─→ Ag2SO4 + SO2↑ + 2H2OAg + 2HNO3(65%) ─→ AgNO3 + NO2↑+ H2O金不溶于单一的无机酸中,但金能溶于王水(浓HCl:浓HNO3 = 3:1的混合液)中:Au + HNO3+ 4HCl ─→ H[AuCl4] + NO↑ + 2H2O而银遇王水因表面生成AgCl薄膜而阻止反应继续进行。
13-6-2 铜的重要化合物一、氧化物和氢氧化物1. CuO和Cu(OH)2CuO它不溶于水,但可溶于酸。
CuO的热稳定性很高,加热到1000℃才开始分解为暗红色的Cu2O:4CuO2Cu2O +O2Cu2+ + 2OH-─→ Cu(OH)2↓Cu(OH)2CuO + H2OCu(OH)2显两性(但以弱碱性为主),Cu(OH)2 + 2H+─→ Cu2+ + 2H2OCu(OH)2 + 2OH-─→ [Cu(OH)4]2-[Cu(OH)4]2-配离子可被葡萄糖还原为暗红色的Cu2O:[Cu(OH)4]2- + C6H12O6─→ Cu2O↓ + C6H12O7 + 4OH- + 2H2O(葡萄糖)(葡萄糖酸)医学上用此反应来检查糖尿病。
Cu(OH)2也易溶与氨水,生成深蓝色的[Cu(NH3)4]2+。
2.Cu2O对热很稳定,在1235℃熔化也不分解,难溶于水,但易溶于稀酸,并立即歧化为Cu和Cu2+:Cu2O + 2H+─→ 2Cu++ Cu↓+ H2O与盐酸反应形成难溶于水的CuCl:Cu2O + 2HCl ─→ 2CuCl↓(白色)+ H2O此外,它还能溶于氨水形成无色配离子[Cu(NH3)2]+Cu2O + 4NH3 + H2O → 2[Cu(NH3)2]+ + 2OH-但[Cu(NH3)2]+遇到空气则被氧化为深蓝色的[Cu(NH3)4]2+:4[Cu(NH3)2]+ + O2 + 8NH3 + 2H2O → 4[Cu(NH3)4]2+ + 4OH-Cu2O主要用作玻璃、搪瓷工业的红色颜料。
此外,由于Cu2O具有半导体性质,可用它和铜制造亚铜整流器。
CuOH极不稳定,至今尚未制得CuOH。
1.盐类(1)氯化亚铜(CuCl)在热的浓盐酸溶液中,用铜粉还原CuCl2,生成[CuCl2]-,用水稀释即可得到难溶于水的白色CuCl沉淀:Cu2+ + Cu + 4 Cl-─→ 2[CuCl2]-(无色)2[CuCl2]-2CuCl↓ + 2Cl-总反应为:Cu2+ + Cu + 2Cl-─→ 2CuCl↓CuCl的盐酸溶液能吸收CO,形成氯化羰基亚铜[CuCl(CO)]·H2O,此反应在气体分析中可用于测定混合气体中CO的含量。
在有机合成中CuCl用作催化剂和还原剂。
(2) 氯化铜铜(Ⅱ)的卤化物中,只有氯化铜较重要。
无水氯化铜(CuCl2)为棕黄色固体,可由单质直接化合而成,它是共价化合物,其结构为由CuCl4平面组成的长链(如图13-8 所示):CuCl2不但易溶于水,而且易溶于一些有机溶剂(如乙醇、丙酮)中。
在CuCl2很浓的水溶液中,可形成黄色的[CuCl4]2-:Cu2+ + 4Cl-─→ [CuCl4]2而CuCl2的稀溶液为浅蓝色,原因是水分子取代了[CuCl4]2-中的Cl-,形成[Cu(H2O)4]2+:[CuCl4]2-(黄) + 4H2O ─→[Cu(H2O)4]2+(浅蓝)+ 4Cl-CuCl2的浓溶液通常为黄绿色或绿色,这是由于溶液中同时含有[CuCl4]2-和[Cu(H2O)4]2+之故。
氯化铜用于制造玻璃、陶瓷用颜料、消毒剂、媒染剂和催化剂。
(3) 硫酸铜无水硫酸铜(CuSO4)为白色粉末,但从水溶液中结晶时,得到的是蓝色五水合硫酸铜(CuSO4·5H2O)晶体,俗称胆矾,其结构式为[Cu(H2O)4]SO4·H2O。
无水CuSO4易溶于水,吸水性强,吸水后即显出特征的蓝色,可利用这一性质检验有机液体中的微量水分,也可用作干燥剂,从有机液体中除去水分。
CuSO4溶液由于Cu2+水解而显酸性。
CuSO4为制取其它铜盐的重要原料,在电解或电镀中用作电解液和配制电镀液、纺织工业中用作媒染剂。
CuSO4由于具有杀菌能力,用于蓄水池、游泳池中可防止藻类生长。
硫酸铜和石灰乳混合而成的“波尔多液”可用于消灭植物病虫害。
3. 配合物(1) Cu(I)配合物常见的Cu(I)配离子有:配离子[CuCl2]-[Cu(SCN)2]-[Cu(NH3)2]+[Cu(S2O3)2]3-[Cu(CN)2]-3.16×105 1.51×105 7.24×1010 1.66×1012 1.0×1024多数Cu(I)配合物的溶液具有吸收烯烃、炔烃和CO 的能力,例如:[Cu(NH 2CH 2CH 2OH)2]+ + C 2H 4[Cu(NH 2CH 2CH 2OH)2(C 2H 4)]+; <0[Cu(NH 3)2]+ + CO [[Cu(NH 3)2(CO)]+; <0 上述反应是可逆的,受热时放出C 2H 4和CO,前一反应用于从石油气中分离出C 2H 4;后一反应用于合成氨工业铜洗工段吸收可使催化剂中毒的CO 气体。
(2) Cu(Ⅱ)配合物Cu 2+与单齿配体一般形成配位数为4的正方形配合物。
例如已介绍过的[Cu(H 2O)4]2+,[CuCl 4]2-,[Cu(NH 3)4]2+等。
我们熟悉的深蓝色的[Cu(NH 3)4]2+,它是由过量氨水与Cu(Ⅱ)盐溶液反应而形成: [Cu(H 2O)4]2+(浅蓝) + 4NH 3 ─→ [Cu(NH 3)4]2+(深蓝) + 4H 2O此外,Cu 2+还可和一些有机配合剂(如乙二胺等)形成稳定的螯合物。
2. 铜(Ⅰ)和铜(Ⅱ)的相互转化从Cu +的价层电子结构(3d 10)看,Cu(Ⅰ)化合物应该是稳定的,自然界中也确有含Cu 2O 和Cu 2S 的矿物存在。
但在水溶液中,Cu +易发生歧化反应,生成Cu 2+和Cu 。
由于Cu 2+所带的电荷比Cu +多,半径比Cu +小,Cu 2+ 的水合焓(-2100 kJ ·mol -1)比Cu +(-593 kJ ·mol -1)的代数值小得多,因此在水溶液中Cu +不如Cu 2+稳定。
由铜的电势图可知,在酸性溶液中,Cu +易发生歧化反应:2Cu + ss Cu 2+ +CuK θ=)Cu (c )Cu (c 22++= 2×106 Cu +歧化反应的平衡常数相当大,反应进行得很彻底。
为使Cu(Ⅱ)转化为Cu(Ⅰ),必须有还原剂存在;同时要降低溶液中的Cu +的浓度,使之成为难溶物或难解离的配合物。
前面提到的CuCl 的制备就是其中一例,由下列电势图:Cu 2+(aq) +0.559 CuCl(s) +0.12 Cu(s)可知E θ(Cu 2+/CuCl)大于E θ(CuCl/Cu),故Cu 2+可将Cu 氧化为CuCl 。
若用SO 2代替铜作还原剂,则可发生下列反应:2Cu 2+ + SO 2 + 2Cl - + 2H 2O ─→ 2CuCl↓+ SO 42- + 4H +2Cu 2+ + 4I- ─→ 2CuI↓+ I 22Cu2+ + 4CN- ─→ 2CuCN↓+ (CN)2↑CuCN + (x-1)CN-─→ [Cu(CN)x]1-x (x=2~4)总之,在水溶液中凡能使Cu+生成难溶盐或稳定Cu(I)配离子时,则可使Cu(Ⅱ)转化为Cu(I)化合物。
在水溶液中,Cu+的化合物除了不溶解或配离子外都是不稳定的,但在固体中Cu+的化合物比Cu(Ⅱ)的化合物稳定。
13-6-3 银的重要化合物1.卤化银卤化银中只有AgF易溶于水,其余的卤化银均难溶于水。
硝酸银与可溶性卤化物反应,生成不同颜色的卤化银沉淀。
卤化银的颜色依Cl一Br—I的顺序加深,溶解度依次降低。
卤化银有感光性。
在光照下被分解为单质(先变为紫色,最后变为黑色):2AgX 2Ag + X2基于卤化银的感光性,可用它作照相底片上的感光物质。
例如照相底片上敷有一层含有AgBr胶体粒子的明胶,在光照下,AgBr被分解为“银核”(银原子):AgBr Ag + Br 然后用显影剂(主要含有有机还原剂如对苯二酚)处理,使含有银核的AgBr粒子被还原为金属而变为黑色,最后在定影液(主要含有Na2S2O3)作用下,使未感光的AgBr形成[Ag(S2O3)2]3-而溶解,晾干后就得到“负像”(俗称底片):AgBr + 2S2O32-─→ [Ag(S2O3)2]3- + Br印相时,将负像放在照相纸上再进行曝光,经显影、定影,即得“正像”。
AgI在人工降雨中用作冰核形成剂。
作为快离子导体(固体电解质),AgI已用于固体电解质电池和电化学器件中。
2.硝酸银AgNO3是最重要的可溶性银盐。
将Ag溶于热的65%硝酸,蒸发、结晶,制得无色菱片状硝酸银晶体。
AgNO3受热不稳定,加热到713K,按下式分解:2AgNO32Ag + 2NO2 + O2在日光照射下,AgNO3也会按上式缓慢地分解,因此必须保存在棕色瓶中。