沪教版九年级化学第四章认识化学变化资料
- 格式:ppt
- 大小:588.50 KB
- 文档页数:41
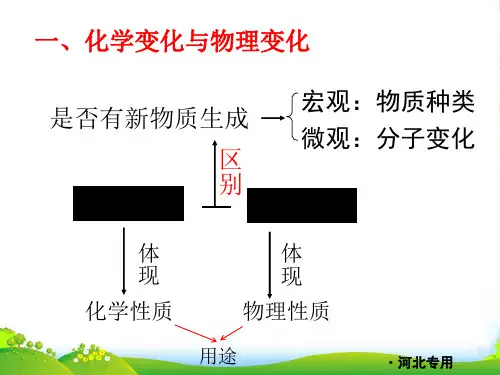


第四章认识化学变化第一节常见的化学反应——燃烧知识点一燃烧的条件1.燃烧的定义燃烧是一种发光、发热的剧烈的化学反应。
注意能产生发光、发热现象的不一定是燃烧,如灯泡通电发光、发热。
3.影响物质燃烧剧烈程度的因素(1)内因:物质本身的性质。
(2)外因:①氧气的浓度;②物质与氧气的接触面积。
点拨物质具有可燃性、可燃物与氧气接触、温度达到着火点。
三者缺一不可。
知识点二完全燃烧与不完全燃烧知识点三爆炸1.爆炸是可燃物在有限的空间内发生急速燃烧,短时间聚积大量的热,使气体的体积迅速膨胀而引起的。
2.氧气浓度较高,或可燃物(气体、粉尘)与氧气的接触面积很大,燃烧范围广,周围的空气迅速猛烈膨胀,也会发生爆炸。
注意爆炸不一定是化学变化。
3、爆炸的条件:有限的空间、气体迅速膨胀。
4、防范爆炸的措施:一方面应控制可燃物与空气的混合,另一方面应禁止烟火。
2、火场自救的方法第二节化学反应中的质量关系知识点一质量守恒定律2.质量守恒定律的内容参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。
说明①质量守恒定律的适用范围是化学变化;②质量守恒定律只适用于“质量”,不包括其他物理量,如体积等。
知识点二质量守恒定律的微观解释3、质量守恒的原因(1)宏观:化学反应前后,元素的种类和质量没有改变。
(2)微观:化学反应前后,原子的种类和数目不变、原子质量不变第三节化学方程式的书写与应用知识点一化学反应的表示方法1、化学方程式(1)定义:用化学式来表示化学反应的式子叫化学方程式。
例题:利用化学反应2Na+H2====2NaH可实现氢气的存储,计算230 g金属钠最多可吸收氢气的质量。
基础实验3 物质燃烧的条件本章知识体系第 1 页。

2023—2024学年九年级化学沪教版(全国)上册第四章认识化学变化课后习题(含答案)2023—2024学年九年级化学沪教版(全国)上册第四章认识化学变化课后习题含答案沪教版(全国)第四章认识化学变化一、选择题。
1、下列关于燃烧的叙述正确的是()A.有放热、发光现象的变化一定是燃烧B.可燃物燃烧时一定有火焰和发光的现象C.在纯氧中能燃烧的物质在空气中也一定能燃烧D.可燃物燃烧时一定有发光、放热现象2、酒精灯的火焰太小时,将灯芯拨的松散一些,可使火焰更旺,其原理是()A.降低可燃物的着火点B.增大与空气的接触面积C.提高可燃物的着火点D.增加空气中氧气含量3、应用化学知识能有效预防和控制火灾.下面对图中灭火实例的灭火原理解释不正确的是()灭火实例灭火原理A 住宅失火时,消防队员用水灭火降低可燃物的着火点B 酒精在桌上着火时用湿抹布盖灭隔绝空气或氧气C 炒菜油锅着火时,用锅盖盖熄隔绝空气或氧气D 扑灭森林火灾时,设置隔离带可燃物与燃烧物隔离A.A B.B C.C D.D4、一定条件下,密闭容器中发生了某一化学反应,涉及的物质为甲、乙、丙、丁,如图为各物质在反应前和反应后某时刻的质量关系。
下列说法不正确的是()A.x的值是31 B.甲、丁的相对分子质量之比可能为7:11 C.丁可能为单质D.反应中消耗甲和乙的质量比为7:45、一定条件下,甲、乙、丙、丁四种物质在密闭容器中反应,测得反应前后各物质的质量分数如图所示,下列说法正确的是()A. 丁一定是该反应的催化剂B. 该反应的基本类型是分解反应C. 该反应中乙、丙的质量变化之比为3:17D. 该反应中甲、丙的质量变化之比为7:176、下列关于燃烧与灭火的解释,不合理的是()A. 粮库失火用水浇灭﹣降低了可燃物的着火点B. 扑灭森林火灾时开辟隔离带﹣清除和隔离了可燃物C. 用扇子扇煤炉,炉火越扇越旺﹣提供充足的气气D. 图书档案起火,用液态二氧化碳扑灭﹣既隔绝氧气又降低温度7、小红在纸叠的小船中加入适量的水,用酒精灯直接加热,纸船安然无恙.纸船没有燃烧的主要原因是()A.水能灭火B.没有达到着火点C.纸不是可燃物D.没有与氧气接触8、如图所示是通过白磷燃烧验证质量守恒定律的实验。

第4章认识化学反应第1节化学反应发生的条件一、化学反应需要一定的条件影响化学反应的条件主要有反应物的浓度、温度、压强、催化剂等。
大多数化学反应都是放热的,如燃烧、金属与酸反应、中和反应等。
部分反应需要吸热,如碳酸钙的高温分解等。
二、燃烧的条件(一)概念:燃烧是一种发光、发热的剧烈的化学反应(属于剧烈的氧化反应)。
(二)燃烧的特点:发光、发热、化学反应(三)燃烧的条件:有可燃物、有氧气、温度达到着火点。
着火点——物质燃烧所需要的最低温度。
(四)灭火的原理:1.撤离(或清除)可燃物——釜底抽薪,森林隔离带,关闭液化气阀门等。
2.隔绝氧气(或空气)——灯帽盖灭酒精灯,油锅着火盖锅盖,湿抹布铺盖实验台燃着的酒精等。
3.降温到可燃物的着火点以下——用水灭火,吹灭蜡烛等。
注意:凡是提及降低或提高着火点的灭火方法是错误的说法。
4.爆炸的条件:可燃物急速燃烧,在有限空间气体迅速膨胀。
(1)爆炸一定是化学变化吗?答:不是,有物理爆炸(气球爆炸、轮胎爆炸);也有化学爆炸(鞭炮爆炸、炸药爆炸、面粉爆炸等)。
(2)可燃性气体(CO、H2、CH4)点燃前应注意什么?答:要检验气体的纯度(即验纯),防止爆炸。
三、完全燃烧与不完全燃烧(一)碳完全与不完全燃烧。
1.完全燃烧: 22CO O C 点燃(充足)+ 。
2.不完全燃烧:CO O C 2(22点燃不足)+。
3.不完全燃烧的缺点:燃烧速度慢、放热少,浪费燃料,产生大量有害物质污染环境 。
(三)一氧化碳的性质1.一氧化碳的物理性质:无色无味气体、密度略小于空气、难溶于水。
2.一氧化碳的化学性质:(1)可燃性:2222CO O CO 点燃+ 产生蓝色火焰。
(2)毒性:易与人体中血红蛋白结合,降低血红蛋白运输氧气的能力,致使人缺氧。
(3)还原性:2323e 2e 3CO F O F CO ++高温。
四、防火与灭火(一)使燃料充分燃烧的条件:1.增大可燃物与氧气的接触面积(如,野外篝火、蜂窝煤、木柴架空燃烧更旺等)。


第四章《认识化学变化》4.1 常见的化学反应—燃烧一.燃烧1.概念:燃烧是一种发光、发热的剧烈的化学反应2.燃烧的条件物质具有可燃性,与氧气接触,温度达到着火点解释:“烧不坏的手帕”:酒精燃烧放热,水汽化吸热,温度未达到手帕的着火点“纸火锅”:水汽化吸热,温度未达到纸的着火点二.完全燃烧与不完全燃烧1.比较①不完全燃烧的危害:燃烧效率低,浪费燃料;产生有害物质,污染环境②完全燃烧措施:提供充足氧气;增大与氧气的接触面积(蜂窝煤、木柴架空燃烧)2.一氧化碳的性质⑴毒性;点燃⑵可燃性;2CO + O2 === 2CO2⑶还原性。
(H2也具有还原性)三.燃烧引起的爆炸1.产生原因:⑴燃烧发生在有限的空间内;如炸弹、鞭炮爆炸⑵可燃性气体或粉尘在空气中达到一定浓度,遇到明火,发生燃烧,引起爆炸。
如:加油站、面粉加工厂、煤矿坑道2.易燃、易爆场所应注意什么?⑴严禁烟火,防止撞击、高温⑵有消防安全标志和消防器材四.灭火与防火1.灭火原理⑴可燃物与火源隔离;如:设置森林隔离带⑵隔绝氧气;如:酒精灯火焰用灯冒盖灭;酒精洒出着火,用湿抹布盖灭⑶温度降到着火点以下。
如:水灭火解释:吹(扇)烛火,熄灭:吹(扇)烛火,使热量散失,温度降到蜡烛着火的以下火柴头朝向,燃烧会很快熄灭:热量向上扩散,温度降到火柴的着火点以下2.火灾自救:⑴室内起火不能急于打开门窗;⑵遭遇火灾时,用湿毛巾捂住口和鼻,有烟雾的地方要蹲下或匍匐前进。
§4.2 化学反应中的质量关系一.质量守恒定律1.内容:化学反应前后,物质的总质量不变;参加化学反应的各物质的质量总和=生成的各物质的质量总和。
注:①“参加”:质量守恒定律研究的是参加反应的那部分,不参加反应的不能计算在内②“质量”:只有质量守恒,体积等其他方面不一定守恒③质量守恒定律适用于一切化学变化,不适用物理变化。
2.原因:化学反应前后,原子的种类、数目、质量不变二.化学变化中的“变”与“不变”1.化学变化中一定不变的有:①物质的总质量,②元素的种类、质量,③原子的种类、数目、质量;2.化学变化中一定改变的有:①物质的种类,②分子的种类;3.化学变化中可能改变的有:①分子的数目,②化合价。



第四章认识化学变化1、燃烧的条件与灭火的原理:燃烧的条件灭火的原理1.物质具有可燃性 1.隔离可燃物2.与氧气接触 2.隔绝氧气3.温度达到可燃物着火点(着火点不能改变) 3.降温至着火点以下2、“烧不坏的手帕”原因:酒精燃烧,虽然产生大量的热量,但是水蒸发要吸收热量,使温度达不到手帕的着火点。
3、完全燃烧与不完全燃烧:完全燃烧不完全燃烧氧气足量氧气不足可燃物中的碳、氢元素分别生成二氧化碳和水可燃物中的部分碳、氢元素生成一氧化碳、碳氢化合物等有毒气体和小的炭黑颗粒等物质。
不完全燃烧的危害:①浪费燃料;②污染环境。
4、CO俗名:煤气.有剧毒,它与血液里的血红蛋白结合,使血红蛋白失去输氧功能。
5、火灾中逃生的方法:用湿毛巾捂住口鼻,伏下身体迅速逃离。
6、参加化学反应的各物质质量总和等于反应生成的各物质质量总和,叫质量守恒定律。
注意:(1)一切化学反应都必须遵守质量定律!它指的是反应前后各物质的质量总和相等.包含产生的气体和沉淀一并相加;它强调的“质量守恒”并不包括体积的守恒。
(2)质量守恒定律只适用于化学变化,不适用于物理变化。
(3)“参加反应”指真正参与了反应的那一部分质量,而不是各物质质量的简单相加,反应物中未参加反应的部分不能算在内。
(4)反应前后,质量总和相等.每一种反应物和生成物的质量并不一定相等.7、质量守恒定律的原因:在一切化学反应中,反应前后①原子的种类没有改变,②原子的数目没有增减,③原子的质量也没有变化,所以反应前后各物质的质量总和相等。
小结:在化学反应中:(化学反应的实质是原子的重新组合)一定不变的是:①各物质的质量总和;②元素的种类;③元素的质量;④原子的种类;⑤原子的数目;⑥原子的质量。
一定改变的是:①物质的种类;②分子的种类。
可能改变的是:①分子的数目。
②元素的化合价。
8、书写化学方程式应遵守的两个原则:一是必须以客观事实为基础;二是要遵守质量守恒定律,“等号”表示两边各原子的数目必须相等。
第4章认识化学变化1.燃烧:是一种发光、放热的剧烈的化学反应。
2.燃烧的条件:(1)物质具有可燃性;(2)可燃物与氧气充分接触(具有助燃性的物质);(3)可燃物达到着火点;三个条件是缺一不可。
3.、实验:烧不坏的手绢棉布表面的酒精迅速燃烧起来,而酒精液体中含有水,燃烧过程中,水吸收放出的热量而蒸发,使棉布始终不能达到着火点,因此棉布就不能真正的燃烧起来。
12 32 24 32当碳与氧气的质量比≤3/8,发生完全燃烧当碳与氧气的质量比介与3/4和3/8之间时,部分完全燃烧,部分不完全燃烧当碳与氧气的质量比≥3/4,发生不完全燃烧碳与氧气的质量比燃烧产物容器中物质小于3:8 CO2 CO2、 O2等于3:8 CO2 CO2介于3:4与3:8之间CO 、CO2 CO 、CO2等于3:4 CO CO大于3:4 CO CO、C4、一氧化碳是一种无色无味的有毒气体。
吸入人体内的一氧化碳跟血液中的血红蛋白结合,使血红蛋白丧失了输氧的功能,人体就因缺氧而窒息死亡。
(毒性是化学性质)的浓度较大时会使人窒息死亡。
CO25、爆炸的条件:在有限的空间内,发生急速的燃烧,短时间聚积大量的热,使气体的体积迅速膨胀。
任何可燃性气体的性质试验之前,务必..进行气体检验纯度实验(简称验纯)否则可能发生爆炸2H2 + O2点燃2H2O 2CO + O2点燃 2CO2CH4+2O2点燃CO2+2H2O火焰:淡蓝色蓝色蓝色6、灭火的原理(1)将可燃物撤离燃烧区,与火源隔离。
如煤气起火,我们应先迅速关闭阀门;森林火灾时,砍一些外围树木,形成隔离带;“釜底抽薪”等;(2)将燃着的可燃物与空气隔离。
如厨房油锅起火,盖上锅盖;酒精灯熄灭时用灯帽;干粉灭火剂或消防用砂等(3)使用大量的冷却剂,使燃烧物的温度降低到着火点以下,如吹灭蜡烛7.灭火器的分类(1)泡沫灭火器:适用范围:扑灭一些木材,橡胶等固体的初起火灾。
(2)干粉灭火器:适用范围:扑灭油类,可燃气体(3)液态二氧化碳灭火器:适用范围:扑灭一些面积不大的珍贵设备,档案资料,精密仪器仪表等。
九年级化学全册第四章认识化学变化基础知识沪教版第一节常见的化学反应—燃烧1.燃烧是一种、的的。
物质燃烧一般需要同时满足三个条件:(1);(2);(3)。
2.可燃物燃烧剧烈程度的影响因素有:(1);(2);(3)。
3.当氧气充足时,可燃物,燃烧得,放出的热量,可燃物中的碳、氢元素分别生成和;当氧气不充足时,可燃物,燃烧得,放出的热量,可燃物中的部分碳、氢元素生成、等有毒气体和小的等物质。
在氧气充足时,碳燃烧产生;在氧气不充足时,碳燃烧产生。
4.一氧化碳是一种色、味、溶于水的气体。
一氧化碳有,是因为吸入人体内的一氧化碳跟结合,使之丧失功能。
5.如果的燃烧发生在的空间内,短时间聚积,使气体的,就会引起爆炸。
6.容易导致爆炸的空气中可燃性气体的体积分数范围,称为该气体的。
在使用可燃性气体前,一定要先。
7.灭火通常有三种方法:(1);(2);(3)。
8.写出下列消防安全标志的含义。
9.被困火灾区,要采取措施自救,如用,防止、身子或跑出火灾区、到窗口呼救等。
10.常用的灭火器材有灭火器、灭火器、灭火器等,其中只能用于一般火灾的是灭火器,可用于油气类火灾的是灭火器,而贵重设备、精密仪器、图书档案起火只能用灭火器灭火。
第二节化学反应中的质量关系1.无数实验证明,。
这个规律叫做质量守恒定律。
化学变化中的质量守恒是因为反应前后原子的、、都。
2.从宏观和微观两个角度理解化学变化和质量守恒定律:在化学变化中,反应前后一定不改变的是各物质的、元素的、原子的、、;一定改变的是物质的、分子的,可能改变的是分子的。
第三节化学方程式的书写与应用1.叫做化学方程式。
2.化学方程式可表示:(1);(2);(3)。
3.书写化学方程式时,应该遵循两个原则:(1);(2)。
4.写出下列反应的化学方程式(1)加热碳酸氢铵,反应;(2)加热铜绿[Cu2(OH)2CO3],反应;(3)镁带在空气中燃烧,反应;(4)红磷在空气中燃烧,反应;(5)木炭在空气中完全燃烧,反应;(6)硫在空气中燃烧,反应;(7)铁丝在氧气中燃烧,反应;(8)加热高锰酸钾,反应;(9)双氧水和二氧化锰混合,反应;(10)加热氯酸钾和二氧化锰的混合物,反应;。