高中化学实验——喷泉实验
- 格式:doc
- 大小:68.00 KB
- 文档页数:5

高中化学氨气喷泉实验具体操作
高中化学氨气喷泉实验的具体操作如下:
1.按图组装仪器。
2.检查装置气密性:关闭止水夹1和2,打开止水夹
3.双手紧握图底烧瓶,若小烧杯中有气泡产生。
则证明装置气密性良好。
3.锥形瓶内放入适量的干燥氧化钙。
在分液漏斗内装入浓氨水,大烧杯内装入三分之二容积的蒸馏水,小烧杯内装约20 mL左右蒸馏水,并分别滴入几滴酚酞,最后固定好装置。
4.向锥形瓶中依次加入适量固体NaOH和浓氨水,迅速将步票1中连好的装置与锥形瓶连接,调节三通活塞,使锥形瓶与图底烧瓶气流相通。
锥形瓶中固体NaOH溶于水放热。
使氨气在水中溶解度减小,而且溶于水的NaOH会电离出氢氧根离子,体系中氢氧根离子浓度增大会破坏氨水的电离平衡,从而使氨气逸出至图底烧瓶中。
5.待反应进行一段时间,园底烧瓶收集足量氨气后,调节三通活塞,使锥形瓶与大气相通。
6.轻轻挤压胶头滴管,使滴有酚酞的水进入烧瓶,瓶中氨气迅速溶于水,烧瓶内压强蓀减,尖嘴管将锥形瓶中溶液倒吸入烧瓶,从而形成美丽的红色喷泉。
以上是高中化学氨气喷泉实验的具体操作步骤,供您参考。
请注意严格按照步骤进行操作以保证实验的安全和成功。

2019高考化学实验:氨气的喷泉实验学习是一个循序渐进的过程,需要同学们不断的学习和努力。
查字典化学网提供了高考化学实验:氨气的喷泉实验,希望能帮助大家更好的复习所学的知识。
实验用品:塑料瓶(矿泉水瓶或可乐瓶)、小试管、橡皮筋、尖嘴玻璃管、短玻璃导管、烧瓶、橡胶管、橡皮塞(双孔两个);浓氨水、氢氧化钠固体、酚酞试液、水。
气体的收集:利用浓氨水的挥发性,在浓氨水中加入氢氧化钠固体(或生石灰),氢氧化钠固体溶于浓氨水中放出热量,加速了浓氨水的挥发,迅速放出氨气。
实验操作及现象:①将小试管用橡皮筋固定在尖嘴玻璃管上,塑料瓶中加入适量水,滴入酚酞,振荡。
②按上图一安装好实验装置,双手紧握烧瓶检验装置的气密性。
③在小试管中加入适量的浓氨水、氢氧化钠固体(或生石灰),迅速伸入烧瓶内,重新安装好装置,观察现象。
可以看到小试管中有气泡放出,烧瓶中空气由D处橡胶管排出,烧瓶中空气排完,D处用夹子夹住,多余的氨气会由尖嘴导管排入塑料瓶中,溶于水后便可观察到瓶中酚酞试液变红色。
④反应完毕,用一只手的食指按住瓶塞上的短玻璃管C处,另一只手挤压塑料瓶,使少量的水进入烧瓶,即可形成美丽的喷泉。
通过堵住C处手指的控制,可调节塑料瓶中进气量,使之产生一定的负压,这样可控制喷泉的大小,延长喷泉持续的时间,突出了实验现象。
实验优点:①把气体的收集和喷泉实验的装置连成一个整体,无需事先收集氨气,操作简单、易于进行,实验成功率高。
②可节约时间和药品,整个实验可在5 min内完成;药品用量少,实验可向微型化方向发展。
③喷泉可随意控制,延长持续时间、突出了实验现象。
注意事项:①所加药品的量需以上就是由查字典化学网为您提供的高考化学实验:氨气的喷泉实验,祝你高考拿高分,鲤鱼跳龙门!加油!。

高中化学喷泉实验试讲教案
实验目的:通过观察化学反应过程,了解溶液间的反应和产生的新物质,并观察其产生的
现象。
实验原理:本实验通过将两种溶液混合,使其发生化学反应,产生气体或液体喷出的现象。
实验材料:漏斗、试管、烧杯、小瓶、硫酸、氢氧化钠、迷你喷壶、水、硫酸铜
实验步骤:
1. 将硫酸铜与水按1:1的比例混合在小瓶中,制备好硫酸铜溶液。
2. 将硫酸铜溶液倒入迷你喷壶中。
3. 在漏斗中倒入适量的氢氧化钠溶液。
4. 将迷你喷壶和漏斗放在试管中,漏斗的口向下。
5. 缓慢将氢氧化钠溶液倒入迷你喷壶中,观察并记录喷液的现象和变化。
实验注意事项:
1. 在实验过程中,避免直接接触强酸和强碱溶液,避免溅出导致伤害。
2. 实验结束后,及时将残余溶液倒掉,清洗实验器材。
实验效果展示:
1. 当氢氧化钠溶液与硫酸铜溶液混合时,产生气体并喷涌喷出,形成美丽的蓝色化学喷泉。
2. 反应过程中产生的气体会产生气泡状的效果,气泡会不断冒出,并且整个实验器材中弥
漫着浓烈的化学反应气味。
实验延伸:
1. 可以尝试不同浓度的硫酸铜和氢氧化钠溶液进行实验,观察不同的化学反应现象。
2. 可以探究实验中产生的气体是什么气体,并通过气体性质的特点来判断其成分。
3. 可以尝试用其他金属离子和碱性离子进行实验,观察其产生的不同喷涌效果和颜色变化。


1. 了解喷泉实验的原理及操作步骤。
2. 通过实验观察氨气溶解于水时的喷泉现象,加深对气体溶解度的认识。
3. 掌握喷泉实验中气体收集、溶解等基本操作。
二、实验原理喷泉实验是利用气体在水中溶解度不同,产生压强差,使液体从下向上喷出的现象。
本实验以氨气为例,氨气溶解于水时,烧瓶内压强减小,导致外界大气压将水压入烧瓶内,形成喷泉现象。
三、实验器材1. 烧瓶(500mL)2. 双孔塞3. 胶头滴管4. 直导管(长)5. 氨气6. 水槽7. 酚酞试液四、实验步骤1. 将烧瓶固定在铁架台上,将双孔塞塞入烧瓶口,一个孔插入直导管,另一个孔插入胶头滴管。
2. 检验装置气密性,确保无泄漏。
3. 将烧瓶底朝上,导管朝下,导管插入水槽中。
4. 将氨气通入烧瓶中,直至烧瓶内充满氨气。
5. 挤压胶头滴管,将水挤入烧瓶中,观察喷泉现象。
6. 若在烧杯中加入酚酞试液,喷出的水呈红色,说明氨气溶解于水后形成碱性溶液。
1. 当氨气通入烧瓶中时,烧瓶内气体颜色逐渐变深,表明氨气充满烧瓶。
2. 挤压胶头滴管,水被压入烧瓶,形成喷泉现象。
3. 若在烧杯中加入酚酞试液,喷出的水呈红色。
六、实验结果与分析1. 实验结果表明,氨气溶解于水时,烧瓶内压强减小,导致外界大气压将水压入烧瓶内,形成喷泉现象。
2. 实验中,氨气溶解于水后形成碱性溶液,使喷出的水呈红色。
七、实验讨论1. 喷泉实验中,气体收集、溶解等操作注意事项有哪些?答案:注意事项包括:确保装置气密性;收集气体时,导管应插入烧瓶底部;溶解气体时,应避免气泡产生。
2. 影响喷泉实验效果的因素有哪些?答案:影响喷泉实验效果的因素包括:气体的溶解度、烧瓶内气体的压强、水的压力等。
八、实验结论本实验成功观察到氨气溶解于水时的喷泉现象,验证了气体溶解度与喷泉实验的关系。
通过实验,加深了对气体溶解度的认识,掌握了喷泉实验的基本操作。

喷泉实验面面观[问题探究]1.形成喷泉的原理形成喷泉最根本的原因是瓶内外存在压强差。
当烧瓶内气体溶于液体或与之反应时,瓶内气体大量减少,压强降低,外界的大气压将液体压入烧瓶内,如此持续,最后液体将充满烧瓶。
2.常见喷泉的形成主要有以下两类(1)极易溶于水的气体(NH3、HCl、SO2等)与水可形成喷泉;(2)酸性气体(HCl、SO2、NO2、CO2、H2S等)与NaOH(aq)也能形成喷泉。
3.喷泉实验成功的关键(1)盛气体的烧瓶必须干燥;(2)气体要充满烧瓶;(3)烧瓶不能漏气(实验前应先检查装置的气密性);(4)所用气体能大量溶于所用液体或气体与液体快速反应。
4.常见的喷泉实验装置喷泉实验的本质是形成压强差而引发液体上喷,为此可设计多种不同的装置和采用不同的操作(如使气体溶于水、热敷、生成气体、发生气体体积减小的反应等)来使喷泉产生。
装置Ⅱ:挤压气球,即可使少量的溶液沿导管进入烧瓶中,导致大量的NH3溶解,烧瓶内形成负压而产生喷泉。
装置Ⅲ:去掉了胶头滴管。
打开止水夹,用手(或热毛巾等)捂热烧瓶,氨气受热膨胀,使氨气通过导管与水接触,即产生喷泉。
(开放性问题,或用浸冰水的毛巾“冷敷”烧瓶,使水进入烧瓶,烧瓶内氨气溶于水)装置Ⅳ:在锥形瓶中加入能产生气体的物质,使锥形瓶内气体的压强明显增大,将液体压入烧瓶而产生喷泉。
装置Ⅴ:在水槽中加入使水温度升高的物质,致使锥形瓶内酒精因升温而挥发,锥形瓶内气体压强增大而产生喷泉。
装置Ⅵ:烧瓶中通入H2S(或SO2),然后通入SO2(或H2S),现象为有淡黄色粉末状物质生成,瓶内壁附有水珠,NaOH溶液喷到烧瓶内。
[当 场 指 导]【典例】 (2013·涪陵区模拟)右图的装置中,干燥烧瓶内盛有某种气体,烧杯和滴管内盛放某种溶液。
挤压滴管的胶头,下列与实验事实不相符的是( )。
A .CO 2(NaHCO 3溶液)/无色喷泉B .NH 3(H 2O 中含酚酞)/红色喷泉C .H 2S(CuSO 4溶液)/黑色喷泉D .HCl(AgNO 3溶液)/白色喷泉【应用】 下列图示是某学习小组设计的制取氨气并利用氨气进行喷泉实验的装置示意图。


高三化学喷泉实验喷泉实验;是高考常考内容;题型的设计屡有创新;难度在变化中递增。
●难点磁场请试做下列题目;然后自我界定学习本篇是否需要。
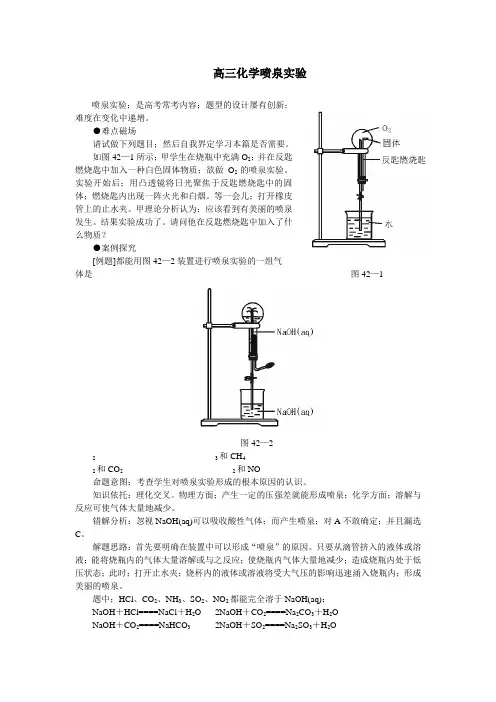
如图42—1所示;甲学生在烧瓶中充满O2;并在反匙燃烧匙中加入一种白色固体物质;欲做O2的喷泉实验。
实验开始后;用凸透镜将日光聚焦于反匙燃烧匙中的固体;燃烧匙内出现一阵火光和白烟。
等一会儿;打开橡皮管上的止水夹。
甲理论分析认为;应该看到有美丽的喷泉发生。
结果实验成功了。
请问他在反匙燃烧匙中加入了什么物质?●案例探究[例题]都能用图42—2装置进行喷泉实验的一组气体是图42—1图42—2和CH42 3和CO2 2和NO2命题意图:考查学生对喷泉实验形成的根本原因的认识。
知识依托:理化交叉。
物理方面;产生一定的压强差就能形成喷泉;化学方面;溶解与反应可使气体大量地减少。
错解分析:忽视NaOH(aq)可以吸收酸性气体;而产生喷泉;对A不敢确定;并且漏选C。
解题思路:首先要明确在装置中可以形成“喷泉”的原因。
只要从滴管挤入的液体或溶液;能将烧瓶内的气体大量溶解或与之反应;使烧瓶内气体大量地减少;造成烧瓶内处于低压状态;此时;打开止水夹;烧杯内的液体或溶液将受大气压的影响迅速涌入烧瓶内;形成美丽的喷泉。
题中;HCl、CO2、NH3、SO2、NO2都能完全溶于NaOH(aq):NaOH+HCl====NaCl+H2O 2NaOH+CO2====Na2CO3+H2ONaOH+CO2====NaHCO3 2NaOH+SO2====Na2SO3+H2ONaOH +SO 2====NaHSO 3 2NaOH +2NO 2====NaNO 3+NaNO 2+H 2O由此进行组合;可知答案。
答案:AC●锦囊妙计(1)NH 3、HCl 、SO 2、NO 2与水组合能形成喷泉。
(2)酸性气体与NaOH(aq)组合能形成喷泉。
(3)有机气体与有机溶剂组合也能形成喷泉。
(4)O 2、N 2、H 2等不溶于水的气体;设计一定实验条件将其反应掉;也能形成喷泉。
高中化学喷泉实验教案设计
实验目的:通过实验观察化学反应产生的气体泡沫,了解气体的性质和化学反应的条件与结果。
实验原理:在酸化反应中,碳酸氢钠和醋酸反应生成气体CO2,该气体在水中形成气泡,从而产生喷泉效果。
实验材料:
1. 碳酸氢钠(小苏打):5g
2. 醋酸:10mL
3. 水:适量
4. 塑料瓶:1个
5. 漏斗:1个
实验步骤:
1. 取一个干净的塑料瓶,将碳酸氢钠倒入瓶中。
2. 在慢慢倒入醋酸至瓶内。
3. 立即将漏斗置于瓶口,并将漏斗底部浸泡在水中。
4. 观察瓶内发生的化学反应,观察气体生成的泡沫。
5. 当瓶内气体充满漏斗,气泡溢出时,即可观察到喷泉效果。
预期结果:
1. 在化学反应进行过程中,瓶内会产生气体CO2,气体在水中形成气泡。
2. 随着气泡的不断产生,气泡会从漏斗中溢出,形成一定高度的气泡喷泉。
安全注意事项:
1. 实验中需戴手套,避免直接接触化学物质。
2. 实验操作时需注意轻放,避免溅出化学物质造成伤害。
3. 实验后,及时清理残留物质,保持实验环境干净整洁。
拓展实验:
1. 可以尝试调整碳酸氢钠和醋酸的比例,观察气泡的产生是否会有所变化。
2. 可以尝试使用其他化学物质替代碳酸氢钠和醋酸,观察不同化学反应产生的气泡效果。
实验结论:
通过喷泉实验,可以观察到化学反应产生的气体在水中形成气泡的过程,了解气体的性质和化学反应的条件与结果。
同时也可以增强学生对化学实验的兴趣和求知欲。
实验专题之四喷泉实验
一. 关于喷泉实验
氨气的喷泉实验是一个很基础也很有趣的演示实验,高考也经常考查与喷泉实验有关的知识,并且考查的内容越来越新颖多样。
喷泉实验利用氨气在水中溶解度很大(体积比1:700),在短时间内烧瓶内气压减小,从而使外界大气压大于瓶内气压,在打开活塞后,大气压将烧杯内的液体压入烧瓶中,在尖嘴导管口形成喷泉。
基于喷泉实验汇总的问题主要有以下几个:
(1)这个喷泉实验的原理跟生活中见到的喷泉原理一样吗?不一样的话,能否将生活喷泉的原理搬到化学实验中?
(2)老师在课堂演示时有时会出现实验失败,到底是什么原因导致的?有什么方法可以提高实验的成功率?
(3)除了形成单一的红色喷泉,能不能形成其他颜色的喷泉呢?如果可以要选用什么药品?能不能设计出彩虹般的喷泉?
(4)作为喷泉实验原料气的溶解度应是多少?难溶或不溶性气体能否形成喷泉?
(5)喷泉实验的装置如何进行改进和创新?能不能设计出双喷泉甚至三喷泉?
(6)实验中有哪些因素会对喷泉的效果有影响,如导管的高度,实验时的温度,吸收液的温度等等?
由此拟定研究方向:①化学喷泉与生活喷泉的联系;②喷泉实验的改进研究;③彩色喷泉的探究。
让学生自由选择研究方向,设计实验对相关内容进行探究。
二.生活喷泉与化学喷泉
课堂上演示的喷泉实验,是减小烧瓶内气压并在外界大气压的作用下,形成喷泉。
而广场上多姿多彩的喷泉原理是增大内部气压,在正常大气压下形成喷泉,原理与火山喷发类似。
于是,本课题将生活中形成喷泉的原理在实验室进行模拟。
实验一:利用MnO2加快H2O2分解氧气,加大烧瓶内压强,在空气中形成喷泉
H2O22H20+O2
图1 图2
步骤:
1、先关闭导管上的止水夹,向烧瓶中放入MnO2,分液漏斗中装H2O2,快速塞紧胶塞,打开分液漏斗,使烧瓶中快速聚集氧气,气压增大;
2、在一段时间后,打开止水夹,烧瓶中的水受到高压而喷出,在导管的出口处形成喷泉。
(装置如图1所示)
实验二:加热氨水使烧杯内压强增大从而形成喷泉
NH3·H2O H2O+NH3↑
步骤:
1、先关闭止水夹,向盛有浓氨水的烧瓶进行加热,使浓氨水分解成氨气和水;
2、待瓶内气体大量聚集后,气压增大到一定程度时打开止水夹,让液体顺导管喷出,形成喷泉。
(装置如图2所示)
三.喷泉实验的改进和创新
课本里的喷泉实验形成的喷泉只持续一小会儿,无法让这美丽的瞬间持久,并且只有一个喷泉,形式单一。
于是,本课题根据该实验原理,设计新的装置,达到感官上的突破。
课题由2个小组完成,一个小组负责研究和设计出持久性喷泉;一个小组设计出双喷泉,让喷泉实验更精彩。
图3 图4
1.形成持久性喷泉
步骤:
1)制备一烧瓶的O2、如图3组装装置;
2)用放大镜聚焦使磷燃烧,消耗氧气;
3)烧瓶内压强减小,H2O2溶液进入烧瓶中形成喷泉,H2O2溶液与MnO2反应再生成O2,
如此不断进行;
4、当溶液到达一定程度时,打开止水夹,使水流下。
2.喷烟和双喷泉实验
步骤:
1)制取一烧瓶氨气和一烧瓶HCl,如图4连接装置;
2)关闭止水夹C,挤压胶头滴管,烧瓶中氨气部分溶解,压强减小,打开a、b,HCl被压入盛NH3的烧瓶中,形成喷烟现象;
3)打开止水夹C,由于两个烧瓶中压强都小于大气压,因此形成双喷泉。
3.彩色喷泉
课本中利用氨气和滴有酚酞的水形成红色的喷泉,在惊叹其美丽的同时,却也因其颜色单一而感到乏味,于是通过查阅资料,有三种方案可以设计出多种颜色的喷泉。
第一种方案:烧瓶中由装一种气体改装两种或多种气体。
这些气体互不反应,但却能与同一种液体反应生成不同颜色的产物而形成彩色喷泉。
第二种方案:烧杯中由盛一种溶液改盛几种互不反应的溶液,而烧瓶中只盛一种气体,且这种气体能与上述几种溶液反应生成不同颜色的产物而形成彩色喷泉。
第三种方案:用烧瓶装几种互不反应的气体,烧杯也装几种互不反应的液体,且这几种气体能与上述几种溶液反应生成不同颜色的产物而形成彩色喷泉。
课题分为四个小组,选择
HCl、NH3、Cl2、CO2做为原料气,再通过选择不同的实验溶液,达到彩色喷泉的效果。
图5
步骤:
1)先用一个干燥的圆底烧瓶收集足够量实验用气体;
2)用带有三根玻璃管(一端成尖嘴状,且尖嘴状一端应插入烧瓶内)的塞子塞紧瓶口,倒置烧瓶,三根玻璃管的末端分别插入盛有实验需用的三种不同试剂溶液的酸奶瓶里;
3)三位学生同时挤压酸奶瓶,由于烧瓶内的气体极易溶于上述三种溶液中,使烧瓶内压强减小,酸奶瓶内溶液由玻璃管进入烧瓶,从而形成多种颜色的彩色喷泉。
4)更换烧瓶内其他与酸奶瓶中溶液,达到更多的颜色喷泉。
实验的气体、溶液、颜色、变色原因如下表(其中颜色和变色原因由学生通过实验和查阅相关资料填写),装置如图5
编号烧瓶
中
气体
烧杯中的液体喷泉的颜色变色的原因
1HCl
石蕊试液红色
HCl的水溶液呈酸性,遇石蕊试液变
红
硝酸银溶液白色产生了白色的AgNO3沉淀
氢氧化铜悬浮液绿色
2HCl+Cu(OH)2=CuCl2+2H2O,在CuCl2
的水溶液中存在[CuCl4]2-和
[Cu(H2O)4]2+两种绿色离子
2Cl2KSCN的FeCl2溶液红色Cl2氧化Fe2+变为Fe3+,使KSCN变红KI的淀粉溶液蓝色Cl2置换出KI中的I2,I2与淀粉变蓝
KBr的CCl4溶液橙色
Cl2置换出KBr中的Br2,Br2的CCl4
溶液呈橙色
3NH3酚酞试液红色NH3的水溶液呈碱性,遇酚酞变红石蕊试液蓝色NH3的水溶液呈碱性,遇石蕊变蓝FeCl3溶液红褐色产生了红褐色的Fe(OH)3沉淀
4CO2酚酞NaOH溶液透明CO2与NaOH产生Na2CO3,使酚酞褪色紫色石蕊试液红色
CO2的水溶液呈酸性,遇石蕊试液变
红
友情提示:本资料代表个人观点,如有帮助请下载,谢谢您的浏览!。