实验7 二组分固-液相图的绘制
- 格式:ppt
- 大小:203.00 KB
- 文档页数:13
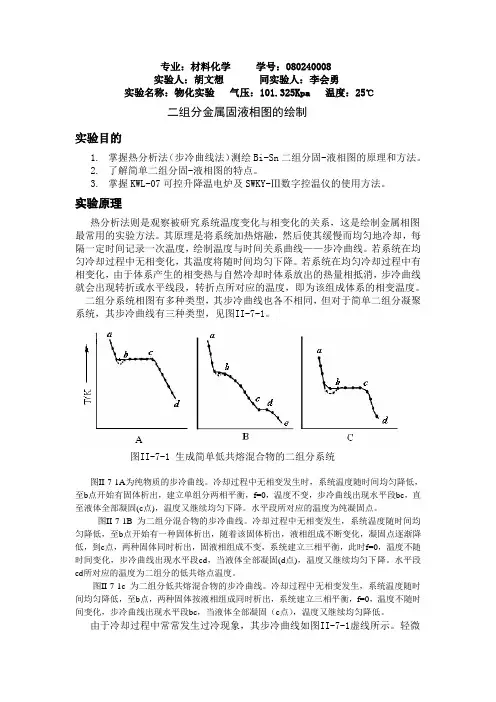
专业:材料化学学号:080240008实验人:胡文想同实验人:李会勇实验名称:物化实验气压:101.325Kpa 温度:25℃二组分金属固液相图的绘制实验目的1.掌握热分析法(步冷曲线法)测绘Bi-Sn二组分固-液相图的原理和方法。
2.了解简单二组分固-液相图的特点。
3.掌握KWL-07可控升降温电炉及SWKY-Ⅲ数字控温仪的使用方法。
实验原理热分析法则是观察被研究系统温度变化与相变化的关系,这是绘制金属相图最常用的实验方法。
其原理是将系统加热熔融,然后使其缓慢而均匀地冷却,每隔一定时间记录一次温度,绘制温度与时间关系曲线——步冷曲线。
若系统在均匀冷却过程中无相变化,其温度将随时间均匀下降。
若系统在均匀冷却过程中有相变化,由于体系产生的相变热与自然冷却时体系放出的热量相抵消,步冷曲线就会出现转折或水平线段,转折点所对应的温度,即为该组成体系的相变温度。
二组分系统相图有多种类型,其步冷曲线也各不相同,但对于简单二组分凝聚系统,其步冷曲线有三种类型,见图II-7-1。
图II-7-1 生成简单低共熔混合物的二组分系统图II-7-1A为纯物质的步冷曲线。
冷却过程中无相变发生时,系统温度随时间均匀降低,至b点开始有固体析出,建立单组分两相平衡,f=0,温度不变,步冷曲线出现水平段bc,直至液体全部凝固(c点),温度又继续均匀下降。
水平段所对应的温度为纯凝固点。
图II-7-1B 为二组分混合物的步冷曲线。
冷却过程中无相变发生,系统温度随时间均匀降低,至b点开始有一种固体析出,随着该固体析出,液相组成不断变化,凝固点逐渐降低,到c点,两种固体同时析出,固液相组成不变,系统建立三相平衡,此时f=0,温度不随时间变化,步冷曲线出现水平段cd,当液体全部凝固(d点),温度又继续均匀下降。
水平段cd所对应的温度为二组分的低共熔点温度。
图II-7-1c 为二组分低共熔混合物的步冷曲线。
冷却过程中无相变发生,系统温度随时间均匀降低,至b点,两种固体按液相组成同时析出,系统建立三相平衡,f=0,温度不随时间变化,步冷曲线出现水平段bc,当液体全部凝固(c点),温度又继续均匀降低。

实验七、双液系气—液平衡相图的测绘专业:11化学姓名:赖煊荣座号:32 同组人:黄音彬时间:2013.12. 3Ⅰ、目的要求1.测定相应组成时的沸点并制作常压下环已烷—无水乙醇双液系的平衡相图。
2.从沸点组成图了解分馏原理。
3.了解沸点的测定技术,掌握两组分液体沸点的测定方法。
4.掌握折光率与组成的关系及阿贝折光仪的使用方法。
Ⅱ、基本原理一、气—液相图两种液态物质混合而成的二组分体系称为双液系。
两个组分若能按任意比例互相溶解,称完全互溶双液系。
液体的沸点是指液体的蒸气压与外压相等时的温度。
在一定的外压下,纯液体的沸点有其确定值。
但双液系的沸点不仅与外压有关,而且还与两种液体的相对含量有关。
根据相律:自由度=组分数-相数+2 。
因此,一个以气—液共存的二组分体系,其自由度为2。
只要任意再确定一个变量,整个体系的存在状态就可以用二维图形来描述。
在T—x相图上,还有温度、液相组成和气相组成三个变量,但只有一个自由度。
一旦设定某个变量,则其它两个变量必有相应的确定值。
二、沸点测定仪沸点仪的构造特点满足:正确测定沸点、便于取样分析、防止过热及避免分馏等。
如图2,是一只带回流冷凝管的长颈圆底烧瓶。
冷凝管底部有一半球形小室,用以收集冷凝下来的气相样品。
溶液中事先加入沸石以减少溶液沸腾时的过热现象及防止暴沸。
三、组成分析本实验选用的环已烷和乙醇,两者折光率相差颇大,而折光率测定又只需少量样品,平衡体系两相组成的获得由事先测得的折光率——组成的工作曲线查得。
折光仪的原理及使用详见参考资料。
Ⅲ、仪器与试剂沸点测定仪一套,普通温度计一支、超级恒温器一套(配接触点温度计、温度计各一支),酒精灯一个、铁架台一附、阿贝折光仪一台、长滴管、烧杯、移液管、擦镜纸等。
环已烷(分析纯)、无水乙醇(分析纯)、丙酮(分析纯)、重蒸馏水等。
Ⅳ、实验步骤1.联接超级恒温器与阿贝折光仪。
调节超级恒温器恒温水浴温度为设定温度25℃,与阿贝折光仪温度一致。
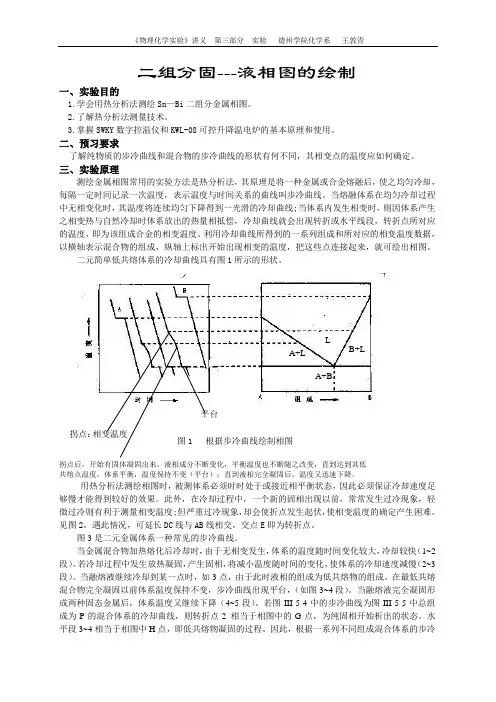
《物理化学实验》讲义 第三部分 实验 德州学院化学系 王敦青二组分固---液相图的绘制一、实验目的1.学会用热分析法测绘Sn —Bi 二组分金属相图。
2.了解热分析法测量技术。
3.掌握SWKY 数字控温仪和KWL-08可控升降温电炉的基本原理和使用。
二、预习要求了解纯物质的步冷曲线和混合物的步冷曲线的形状有何不同,其相变点的温度应如何确定。
三、实验原理测绘金属相图常用的实验方法是热分析法,其原理是将一种金属或合金熔融后,使之均匀冷却,每隔一定时间记录一次温度,表示温度与时间关系的曲线叫步冷曲线。
当熔融体系在均匀冷却过程中无相变化时,其温度将连续均匀下降得到一光滑的冷却曲线;当体系内发生相变时,则因体系产生之相变热与自然冷却时体系放出的热量相抵偿,冷却曲线就会出现转折或水平线段,转折点所对应的温度,即为该组成合金的相变温度。
利用冷却曲线所得到的一系列组成和所对应的相变温度数据,以横轴表示混合物的组成,纵轴上标出开始出现相变的温度,把这些点连接起来,就可绘出相图。
二元简单低共熔体系的冷却曲线具有图1所示的形状。
图1 根据步冷曲线绘制相图 拐点后,开始有固体凝固出来,液相成分不断变化,平衡温度也不断随之改变,直到达到其低共熔点温度,体系平衡,温度保持不变(平台);直到液相完全凝固后,温度又迅速下降。
用热分析法测绘相图时,被测体系必须时时处于或接近相平衡状态,因此必须保证冷却速度足够慢才能得到较好的效果。
此外,在冷却过程中,一个新的固相出现以前,常常发生过冷现象,轻微过冷则有利于测量相变温度;但严重过冷现象,却会使折点发生起伏,使相变温度的确定产生困难。
见图2。
遇此情况,可延长DC 线与AB 线相交,交点E 即为转折点。
图3是二元金属体系一种常见的步冷曲线。
当金属混合物加热熔化后冷却时,由于无相变发生,体系的温度随时间变化较大,冷却较快(1~2段)。
若冷却过程中发生放热凝固,产生固相,将减小温度随时间的变化,使体系的冷却速度减慢(2~3段)。

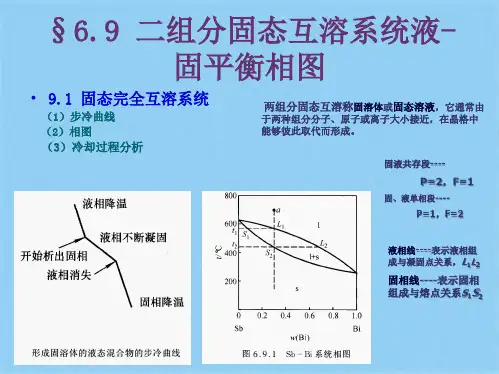
⼆组分固液相图5.4⼆组分系统的固?液平衡5.4.1形成低共熔物的固相不互溶系统当所考虑平衡不涉及⽓相⽽仅涉及固相和液相时,则体系常称为"凝聚相体系" 或"固液体系"0固体和液体的可压缩性甚⼩,⼀般除在⾼压下以外,压⼒对平衡性质的影响可忽略不计,故可将压⼒视为恒量。
由相律:/="= C-^+2-n r=2-d> + 2-l = 3-£Z>因体系最少相数为①=1,故在恒压下⼆组分体系的最多⾃由度数 f * =2,仅需⽤两个独⽴变量就⾜以完整地描述体系的状态。
由于常⽤变量为温度和组成,故在⼆组分固液体系中最常遇到的是T?x (温度?摩尔分数)或T?①(温度?质量分数)图。
⼆组分固?液体系涉及范围相当⼴泛,最常遇到的是合⾦体系、⽔盐体系、双盐体系和双有机物体系等。
在本节中仅考虑液相中可以完全互溶的特殊情况°这类体系在液相中可以互溶,⽽在固相中溶解度可以有差别。
故以其差异分为三类:(1)固相完全不互溶体系;(2)固相部分互溶体系和(3)固相完全互溶体系。
进⼀步分类可归纳如下:F『形成简单低共熔物休系固相完全不互溶体棗形成化合物体系⼻相合熔点化合物怵系不相合熔点化合物俸系EM体疾「没有最1■嚴最⾼熔点型固相完全互熔体茶最瞬点型最⾼熔点型■1固相部分互熔体系,⼀低共熔点型、转熔点型研究固液体系最常⽤实验⽅法为“热分析”法及“溶解度”法。
本节先在“形成低共熔物的固相不互溶体系”中介绍这两种实验⽅法,然后再对各种类型相图作⼀简介。
(⼀)⽔盐体系相图与溶解度法1 ?相图剖析图5-27为根据硫酸铵在不同温度下于⽔中的溶解度实验数据绘制的⽔盐体系相图,这类构成相图的⽅法称为 "溶解度法" 纵坐标为温度t 「C ),横坐标为硫酸铵质量分数(以①表⽰)。
图中FE 线是冰与盐溶液平衡共存的曲线,它表⽰⽔的凝固点随盐的加⼊⽽下降的规律,故⼜称为⽔的凝固点降低曲线。


一、实验目的1.掌握步冷曲线法测绘二组分金属的固液平衡相图的原理和方法。
2、了解固液平衡相图的特点,进一步学习和巩固相律等有关知识。
二、主要实验器材和药品1、仪器:KWL—II金属相图(步冷曲线)实验装置、微电脑控制器、不锈钢套管、硬质玻璃样品管、托盘天平、坩埚钳2、试剂:纯锡(AR)、纯铋(AR)、石墨粉、液体石蜡三、实验原理压力对凝聚系统影响很小,因此通常讨论其相平衡时不考虑压力的影响,故根据相律,二组分凝聚系统最多有温度和组成两个独立变量,其相图为温度组成图.较为简单的组分金属相图主要有三种:一种是液相完全互溶,凝固后固相也能完全瓦溶成固体混合物的系统最典型的为Cu- Ni系统;另一种是液相完全互溶,而固相完全不互溶的系统,最典型的是Bi— Cd 系统;还有一种是液相完全互溶,而固相是部分互溶的系统,如Pb- Sn或Bi- Sn系统。
研究凝聚系统相平衡,绘制其相图常采用溶解度法和热分析法.溶解度法是指在确定的温度下,直接测定固液两相平衡时溶液的浓度,然后依据测得的温度和溶解度数据绘制成相图。
此法适用于常温F易测定组成的系统,如水盐系统。
热分析法(步冷曲线法)则是观察被研究系统温度变化与相变化的关系,这是绘制金属相图最常用和最基本的实验方法。
它是利用金属及合金在加热和冷却过程中发生相变时,潜热的释出或吸收及热容的突变,来得到金属或合金中相转变温度的方法。
其原理是将系统加热熔融,然后使其缓慢而均匀地冷却,每隔定时间记录一次温度,物系在冷却过程中温度随时间的变化关系曲线称为步冷曲线(又称为冷却曲线)。
根据步冷曲线可以判断体系有无相变的发生。
当体系内没有相变时,步冷曲线是连续变化的;当体系内有相变发生时,步冷曲线上将会出现转折点或水平部分.这是因为相变时的热效应使温度随时间的变化率发生了变化。
因此,由步冷曲线的斜率变化可以确定体系的相变点温度。
测定不同组分的步冷曲线,找出对应的相变温度,即可绘制相图。

实验七 二组分固-液相图的绘制一、实验目的及要求1.掌握用步冷曲线法测绘二组分金属固液平衡相图的原理和方法;2.了解采用热电偶进行测温、控温的原理和装置。
二、实验原理用来表示多相体系的温度、压力与体系中各组分的状态、组成之间关系的平面图形称为相图。
二组分固-液相图是描述体系温度与二组分组成之间关系的图形。
由于固液相变体系属凝聚体系,一般视为不受压力影响,因此在绘制相图时不考虑压力因素。
若二组分体系的两个组分在固相完全不溶,在液相可完全互溶,一般具有简单低共熔点,其相图具有比较简单的形式。
根据相律,对于具有简单低共熔点的二组分体系,其相图可分为三个区域,即液相区、固液共存区和固相区。
绘制相图时,根据不同组成样品的相变温度(即凝固点)绘制出这三个区域的交界线—液相线,即图1(b )中的T 1E 和T 2E ,并找出低共熔点E 所处的温度和液相组成。
步冷曲线法又称热分析法,是绘制相图的基本方法之一。
它是将某种组成的样品加热至全部熔融,再均速冷却,测定冷却过程中样品的温度 – 时间关系,即步冷曲线。
根据步冷曲线上的温度转折点获得该组成的相变点温度。
步冷曲线有三种形式,分别如图1(a )中的a 、b 和c 三条曲线。
a 曲线是纯物质A 的步冷曲线。
在冷却过程中,当体系温度到达A 物质凝固点时,开始析出固体,所释放的熔化热抵消了体系的散热,使步冷曲线上出现一个平台,平台的温度即为A 物质的凝固点。
纯B 步冷曲线e 的形状与此相似。
a b c d e a b c d eA B x B t液相区固液共存区固相区低共熔点T 1T 2TT (a )(b )E图1 步冷曲线b 曲线是由主要为A 物质但含有少量B 物质样品的步冷曲线。
由于含有B 物质,使得凝固点下降,在低于纯A 凝固点的某一温度开始析出固体A ,但由于固体析出后使得B 的浓度升高,凝固点进一步下降,所以曲线产生了一个转折,直到当液态组成为低共熔点组成时,A 、B 共同析出,释放较多熔化热,使得曲线上又出现平台。

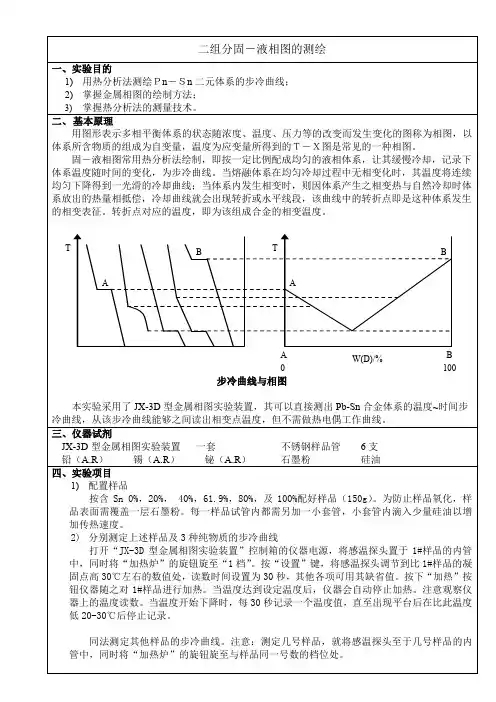

二组分固液系统相图的测定1.实验目的①用热分析法(步冷曲线法)测绘Pb-Sn二组分固液系统相图②了解固液相图的特点,进一步学习和巩固相律等有关知识2.实验原理①步冷曲线法:是相图绘制工作中常用的一种实验方法。
它是利用金属或合金在加热或冷却过程中发生相变时,潜热的释出或吸收及热容的突变,来得到金属或合金中相变温度的方法。
通常的做法是先将金属或合金全部融熔化,然后让其在一定环境中自行冷却,并在记录仪上自动画出(或人工画出)温度随时间变化的步冷曲线。
②当熔融的系统均匀冷却时,如果系统不发生相变,则系统的温度随时间的变化是均匀的,冷却速度较快;若在冷却过程中发生了相变,由于在相变过程中伴随着放热效应,所以系统的温度随时间变化的速率发生变化,系统的冷却速率减慢,步冷曲线上出现转折。
当继续冷却到某一点时,系统以低共熔混合物的固体析出。
在低共熔混合物全部凝固以前,系统温度不变,因此步冷曲线上出现水平线段;完全凝固后,温度才迅速下降。
由此可知,对组成一定的二组分低共熔混合物系统,可以根据它的步冷曲线得出有固体析出的温度和低共熔点温度,根据一系列组成不同系统的步冷曲线的各转折点,即可画出二组分系统的相图。
③本实验通过步冷曲线法获得的数据构建一个相图,用于表示不同温度、组成下的固相、液相平衡。
不同组成的二组分溶液在冷却过程中析出固相的温度可以通过观察温度-时间的曲线斜率变化进行检测。
3.仪器与试剂SWKY-1型数字控温仪、KWL-09可控升降温电炉、PT-100热电阻温度传感器、配套软件、样品管锡(化学纯)、铅(化学纯)4.实验步骤①配置样品。
样品已事先配置好,放入编号为1~10的样品管中,含锡质量百分数分别为0%、10%、15%、20%、35%、50%、62%、80%、95%、100%。
②打开控温仪和电路开关。
启动数据采集系统,点击“设置-通讯口”设置通讯端口。
点击“设置-设置坐标系”设置采样时间长短(约60分钟)和采样温度区间(约50~350℃);设置控制温度,对控温仪按“工作/置数”键,再依次按“×100”、“×10”、“×1”、“×0.1”键(控制温度为380.0℃)。
深圳大学物理化学实验报告--二组分固棗液相图的测绘--张子
科,刘开鑫
二.仪器试剂
三.实验数据及处理热电偶工作曲线
Pb~Sn相图
四.提问思考
1.步冷曲线各段的斜率以及水平段的长度与哪些因素有关?
答:对于斜率来说,与平衡记录仪的走纸速度和混合物中各物质的比例有关;对于水平长度来说,与控制冷却速度有关。
2.根据实验结果讨论各步冷曲线的降温速率控制是否得当。
3.如果用差热分析法或差示扫描发来绘制相图,是否可行?
4.试从实验方法比较测绘气—液相图的异同点。
答:不同点:确定坐标的方式不同。
相同点:都是确定温度与浓度的关系,两者的数据都是热力学平衡下的结果。
按固态互溶情况液态完全互溶而固态完全不互溶液态完全互溶而固态部分互溶液态、固态完全互溶1、二组分固液态完全互溶的固-液平衡相图图a Ge(A) -Si(B)系统的熔点-组成图t /℃a0.00.20.40.60.81.0Ge(A)Si(B)x Bs(A+B)l(A+B)••s+lt 1L 1S 1t 2L 2S 2a 液相线固相线HgBr 2 (A)t /℃HgI 2 (B)w B图a 最低熔点的液固相图t /℃d-香芹(A)l-香芹(B)w B图a 最高熔点液固相图2 液态完全互溶而固态完全不互溶固相线l(A+B )EDCl (A+B )+s Bs(A)+l(A+B )s(A)+s(B)0.00.20.40.60.8 1.0邻硝基氯苯(A)对硝基氯苯(B)x B80602040t /℃*A t *Bt邻硝基氯苯(A )-对硝基氯苯(B )系统的熔点-组成图•••共晶线(温度、三个相的组成都不变)液相线(凝固点降低曲线)E 点:液相能存在的最低温度,也是固相A 和B 能同时熔化的最低温度。
a0.00.20.40.60.81.0300250200Sn(A)Pb(B)x Bt /℃CDE350*At *Bt3272320.0110.260.710.96GFSn (A) -Pb(B)熔点••••••l(A+B)l+s β(A+B)s β(A+B)s α(A+B)+s β(A+B)l+ s α(A+B)aCED (1) 具有低共熔点的熔点-组成图CF 为Pb 在Sn 中的溶解度曲线l(A+B)s α(A+B)+s β(A+B)E 点:低共熔点3.固态部分互熔,液态完全互溶系统的相图(2)具有转变温度的熔点—组成图三相平衡线:Ag (A) –Pt (B)系统熔点-组成图0.00.20.40.60.81.0200016008001200Ag(A)Pt(B)w Bt /℃CE*At*Bt961GFl(A+B)l+s β(A+B)s α(A+B)+s β(A+B)s α(A+B)l+ s α(A+B)转变温度的含义:-l E (A+B) +s α(A+B)+ s β(A+B)ECD CF 为α固熔体中Pt 在Ag 中的溶解度曲线s α(A+B)1200 ℃s β(A+B)+ l Ea(1)热分析法原理:将系统加热到熔化温度以上,然后使其徐徐冷却,记录系统的温度随时间的变化,并绘制温度-时间曲线,叫步冷曲线4、热分析法绘制相图——熔点-组成图有三种类型:(2) 由步冷曲线绘制t —x 图0.00.20.40.60.8 1.0邻硝基氯苯(A)对硝基氯苯(B)x B80602040℃*Bt*At τ/ st /℃80602040邻硝基氯苯(A)对硝基氯苯(x Bt /℃l(A+B )l (A+B )+s(B)s(A)+l(A+B )••x B =0.33x B =0.63相图应用举例(1)——结晶分离ClNO2ClNO 2ClClNO2w =0.33w =0.01w =0.66如何分离?邻硝基氯苯对硝基氯苯表:邻、对位硝基氯苯的物理常数邻硝基氯苯(B)系统结晶分离原理示意图0.00.20.40.60.8 1.0邻硝基氯苯(A)对硝基氯苯(B)x B(A+B )送82.2HG ••••结晶分离-精馏分离熔点-组成图沸点-组成图5、二组分形成化合物系统的相图C = S -R -R ´=3 -1 = 2根据生成化合物的稳定性:(1)形成相合熔点化合物(2)形成不相合熔点化合物几个组分相图?w B0.00.20.40.60.81.015001000t /℃1500Mg(A)Si(B)Mg 2Si(C)*At *Bt1430650•••638E 2看成由两个简单低共熔点相图组合而成x B =0.33a 步冷曲线l+s(B)s (C)+ll(A+B)s(A)+s(C)s(C)+ls(C)+s(B)a(1) 形成相合熔点化合物(熔化后液相与固相组成相同)ANa (A) -K(B)熔点-组成图0.00.20.40.60.81.010050-500Na(A)K(B)x Bt /℃H l(A+B)Js(A)+s(C)s(A)+*At Na 2K (C)(2)形成不相合熔点化合物(熔体与固相组成不同)Na 2K(s)Na(s)+熔体[l (Na+K)]在熔点以上,转晶反应同时消失C(s)降温a二组分系统相图小结(1)二组分相图的基本类型—按相互溶解度分类ABt/℃*At *Bt (a)二组分液态(或固态)完全互ABt /℃*At *Bt (b)二组分液态(或固态)完全不互溶类型*Bt具有转变温度的熔点—组成图生成相合熔点化合物系统二组分固态完全不互溶,液态完全互溶二组分固态部分互溶,液态完全互溶生成不相合熔点化合物系统。
(2023)二组分固液相图的绘制实验报告(一)二组分固液相图实验报告实验目的了解二元混合物在不同温度下的相变关系,并绘制二组分固液相图。
实验材料•实验设备:热梯度仪•实验试剂:硫酸铜,硝酸钠实验步骤1.准备一组已知比例的硫酸铜和硝酸钠混合物。
2.将混合物放置于热梯度仪中,在不同温度下观察样品的相变情况,并记录下数据。
3.根据实验数据,绘制二组分固液相图。
实验结果在实验中,我们观察到硫酸铜-硝酸钠混合物在-10℃以下时为固体,-10℃至27℃之间为固液混合物,27℃以上为液体。
根据实验数据,我们绘制了以下的二组分固液相图:温度/℃相变类型相变点(硝酸钠比例)-10 固体-固液82.3%27 固液-液体53.6%图中横轴代表硝酸钠的比例,纵轴代表温度。
在固液相变区域,相变点上方的为基质,下方的为共晶体。
在液固相变区域,相变点下方的为基质,上方的为共晶体。
结论通过本次实验,我们成功绘制了硫酸铜和硝酸钠的二组分固液相图,并了解了混合物在不同温度下的相变关系。
实验结果对于理解材料的相变规律具有重要的意义。
实验分析固液相变在固液相变区,由于存在共晶,因此相变点会向左平移。
当硫酸铜的比例较高时,相变点随着温度的升高偏向硫酸铜固相方向,相反,当硝酸钠的比例较高时,相变点偏向硝酸钠固相方向。
当二者比例相等时,相变点达到最低点,即共晶点。
液固相变在液固相变区,由于存在共晶,因此相变点同样会向左平移。
当硝酸钠的比例增加时,相变点会偏向硝酸钠固相方向;相反,当硫酸铜的比例增加时,相变点偏向硫酸铜固相方向。
当二者比例相等时,相变点达到最低点,即共晶点。
实验思考本实验的主要任务是绘制硫酸铜与硝酸钠的二组分固液相图,对于掌握二元混合物的相变规律和理解材料的相变特性具有重要的意义。
在实验过程中需要注意的是,实验数据的记录应该准确无误。
此外,由于不同试剂的相变特性各异,因此在实际操作中也应该结合试剂本身的性质,对实验过程进行适当的优化。