高中化学 探究铁及其化合物的氧化性和还原性
- 格式:ppt
- 大小:1.02 MB
- 文档页数:17

实验活动1——铁及其化合物的性质[实验操作]1.铁及其化合物的性质实验(一)铁单质的还原性实验操作实验现象结论及分析反应离子方程式一段时间后,取出铁丝,观察插入CuSO4溶液中的铁丝,表面有红色物质析出Fe具有还原性,与CuSO4溶液反应置换出铜Fe+Cu2+===Cu+Fe2+实验(二)铁盐的氧化性实验操作实验现象结论及分析反应离子方程式加入铜片一段时间后,铜片溶解,溶液变为蓝色Fe3+具有氧化性,能将Cu氧化成Cu2+2Fe3++Cu===2Fe2++Cu2+加入淀粉溶液后,溶液呈蓝色Fe3+具有较强氧化性,能将I-氧化为I22Fe3++2I-===2Fe2++I2实验(三)亚铁盐的氧化性和还原性实验操作实验现象结论及分析反应离子方程式加入锌片一段时间后,锌片溶解,溶液绿色变浅,最后消失Fe2+具有氧化性,能将Zn氧化为Zn2+Fe2++Zn===Zn2++Fe随着FeSO4溶液的滴入,溶液紫色褪去时,再加入Fe2+具有还原性,能被KMnO4酸性溶液氧化成Fe3+5Fe2++MnO-4+8H+===5Fe3++Mn2++4H2OKSCN 溶液,溶液呈红色Fe3++3SCN-===Fe(SCN)32.铁离子的检验实验操作实验现象结论及分析反应离子方程式加入KSCN溶液后,溶液呈红色Fe3+遇KSCN溶液时,溶液变成红色Fe3++3SCN-===Fe(SCN)3加入铁粉后,溶液由黄色变为绿色,再加入KSCN溶液后,溶液无变化Fe2+遇KSCN溶液时,溶液不变色,故可用KSCN溶液检验Fe3+2Fe3++Fe===3Fe2+[实验拓展]研究物质氧化性(或还原性)的方法(1)如果预测某物质具有氧化性,就需要寻找具有还原性的另一物质,通过实验检验两者能否发生氧化还原反应,以验证预测是否正确。
要求设计实验使两者发生反应时,实验操作简单、现象明显。
相应地,如果预测某物质具有还原性,就需要寻找具有氧化性的某一物质,通过实验进行验证。


探究铁及其化合物的氧化性和还原性三维目标知识与技能1、掌握单质铁、氯化铁和氯化亚铁三者之间的转化关系2、掌握科学探究性实验的一般研究方法和步骤过程与方法通过预测与假设、方案设计、实验记录、分析归纳,像科学家那样去进行研究和思维训练,达到知识学习与能力培养的双重教学目的。
情感、态度和价值观1、提高学生的兴趣2、使学生在探究中体验研究的艰辛,体验获得成功的快乐教学重点探究铁及其化合物的氧化性和还原性教学难点探究铁及其化合物的氧化性和还原性教具准备投影仪、相关的实验试剂和用品教学过程【引课】铁是一种常见的金属,是人类最早使用的金属。
它广泛地存在于自然界和动植物体中。
请同学们观看自然界中的铁:【展示投影】展示:铁矿石。
投影图片:“冶炼钢铁”、陨石、含铁元素的动植物、及我国钢铁产量比例图等。
【过渡】自然界中存在大量的含铁物质,同学们也了解不少,那么怎么用化学符号来表示他们呢?请同学们在练习本上写出常见铁的化合物的化学式,并从化合价的角度进行分类。
预测这些物质中哪些具有氧化性,哪些具有还原性?【学生活动】思考、书写【小结】铁元素的常见价态;0、+2、+3【启发】这些价态的铁元素之间如果发生相互转化,则会发生氧化还原反应。
铁及其铁的化合物中哪些具有氧化性?哪些具有还原性?我们以常见的金属铁,氯化亚铁和氯化铁为例进行探究。
请同学们大胆推测!【生】思考、推测【投影小结】0价铁——还原性+2价铁——还原性和氧化性+3价铁——氧化性【师】研究物质性质的基本程序第一步是预测,下来是?【生】思考回答(观察)【师】展示铁,氯化亚铁,氯化铁样品。
(引导学生观察三种实验样品的颜色,注意特征颜色。
)【师】人家说每一个化学老师都是一个小小的魔术师,那么今天老师斗胆也给大家献丑表演一次。
【展示】一张白纸【演示】用小喷壶喷洒淡黄色溶液(白纸上显示血红色字样“你知道反应原理吗?”)【问】你知道反应原理吗?【生】思考回答(说明:必要时,演示FeCl3溶液与KSCN溶液的反应。



《探究铁及其化合物的氧化性和还原性》教学设计
吴忠回民高级中学高华
一、教学目标
知识与技能:通过金属铁、氯化亚铁、氯化铁的氧化性和还原性的探究实验,使学生掌握金属铁、氯化亚铁、氯化铁之间的相互转化关系;了解Fe3+的检验方法;培养学生的操作技能、观察能力、和分析问题的能力。
过程与方法:通过金属铁、氯化亚铁、氯化铁的氧化性或还原性的探究实验,使学生学会预测物质的性质——设计实验方案进行实验并进行观察——分析实
验现象,得出结论的科学探究方法。
通过预测与假设、方案设计、实验记录、分析归纳。
情感、态度和价值观:使学生学会预测物质的性质,并通过实验探究得到证实,体验科学探究成功的喜悦;同时培养他们善于与他人合作的良好心理品质。
并通过“身边的化学”等内容,认识铁在促进人体健康中的作用,了解化学知识在丰富人类生活方面的重要作用。
二、教学重难点
教学重点:知识重点是金属铁、氯化铁、氯化亚铁的性质以及相互转化;
方法重点是教会学生探究物质性质的科学方法。
教学难点:预测金属铁、氯化铁、氯化亚铁的氧化性、还原性并进行探究实验的设计。
三、教学方法
情景教学法、实验探究法、多媒体辅助法、对比分析法
四、教学用具
1、药品及试剂:铁粉、铁丝、FeCl3溶液、FeCl2溶液(加铁粉)、氯水、
稀硝酸、酸性KMnO4溶液、KSCN溶液
预测
还原性Fe Fe+2H+==Fe2++H2↑
Fe2++Zn ==Fe +Zn2+
+2
氧化性和还原性Fe 2Fe2++Cl2== 2Fe3++2Cl-
+3
氧化性Fe 2Fe3++Fe== 3Fe2+。


教学反思在九校联赛中,我开设了《铁及其化合物的氧化性或还原性》的新课,下面对本节课从以下几个方面进行了反思。
一、教学准备方面课前,认真学习了课程标准,明确了考点和等级要求。
本节要实现的知识目标是:1.了解铁及其重要化合物的主要性质及其应用。
2.以Fe2+、Fe3+的相互转化为例,理解变价金属元素的氧化还原反应。
3.能鉴别溶液中的Fe2+、Fe3+。
二、教学设计方面《铁和铁的化合物》的内容是属于高中化学中“元素及其化合物”部分的知识,对于铁及其化合物的知识,我在课堂上首先引导学生按照单质、氧化物、氢氧化物、盐的类别对其进行分类,然后分别研究其性质,又引导学生从化合价转化的角度来分析铁及其化合物性质的变化规律。
这样,通过两个不同角度的研究,使学生体会到元素化合物知识的方法,从整体上更好地把握铁及其化合物性质的变化规律。
并以“亚铁离子和铁离子的性质”的应用为延伸,引导学生进行基础知识的复习,恰到好处地将理论知识与元素及其化合物知识融为一体,充分培养了学生学科知识的综合应用能力,很好地发展了学生的学科素养。
另外,在教学中我还把化学实验与相关知识点相结合,引入到课堂学习中来。
课堂开始以补铁药物的说明书作为引子,激发学生的学习兴趣和热情,很快把他们的注意力拉到课堂上来。
在课的结尾,又重新回到补铁剂的说明书上来,请同学解答为什么是薄膜衣片,为什么“维生素C与铁搭档效果更好”,并请学生设计实验,教师进行演示实验,从而使学生体会到化学知识与日常生活中的密切联系。
三、板书设计方面板书是教学中所应用的一种主要的教学媒体,板书设计是教师在教学过程中运用文字符号、绘图、列表等形式和手段集中反映教材内容,有效提高教学质量的一种教学行为,是整个课堂教学的有机组成部分,是教师应当具备的教学基本功之一。
现代教学媒体的大量涌现不仅没有使板书退出教学课堂的舞台,反而更加彰显出板书不可替代的特点与优势,也更加丰富了板书的显现形式。
我在板书设计上考虑到元素化合物知识的复杂性,利用了坐标系,使复杂的知识点网络化,清晰化,重点更为突出。

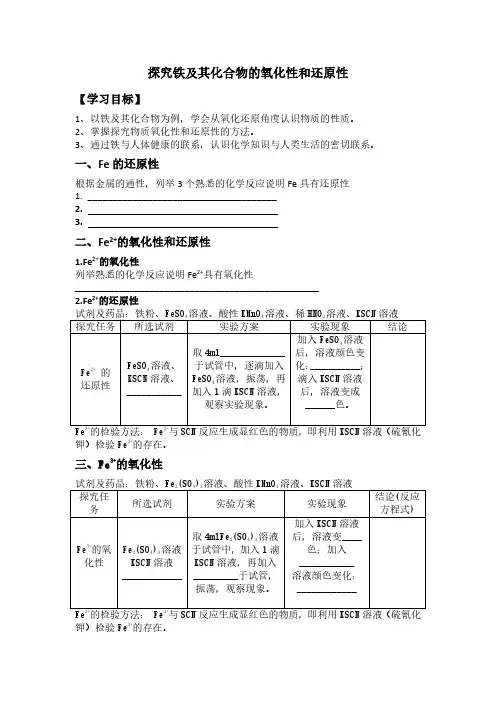
探究铁及其化合物的氧化性和还原性【学习目标】1、以铁及其化合物为例,学会从氧化还原角度认识物质的性质。
2、掌握探究物质氧化性和还原性的方法。
3、通过铁与人体健康的联系,认识化学知识与人类生活的密切联系。
一、Fe的还原性根据金属的通性,列举3个熟悉的化学反应说明Fe具有还原性1.______________________________________2.3.二、Fe2+的氧化性和还原性1.Fe2+的氧化性列举熟悉的化学反应说明Fe2+具有氧化性_________________________________________________2.Fe2+的还原性试剂及药品:铁粉、FeSO4溶液、酸性KMnO4溶液、稀HNO3溶液、KSCN溶液探究任务所选试剂实验方案实验现象结论Fe2+的还原性FeSO4溶液、KSCN溶液、___________取4ml_____________于试管中,逐滴加入FeSO4溶液,振荡,再加入1滴KSCN溶液,观察实验现象。
加入FeSO4溶液后,溶液颜色变化:__________;滴入KSCN溶液后,溶液变成______色。
Fe3+的检验方法:Fe3+与SCN-反应生成显红色的物质,即利用KSCN溶液(硫氰化钾)检验Fe3+的存在。
三、Fe3+的氧化性试剂及药品:铁粉、Fe2(SO4)3溶液、酸性KMnO4溶液、KSCN溶液探究任务所选试剂实验方案实验现象结论(反应方程式)Fe3+的氧化性Fe2(SO4)3溶液KSCN溶液____________取4mlFe2(SO4)3溶液于试管中,加入1滴KSCN溶液,再加入_________于试管,振荡,观察现象。
加入KSCN溶液后,溶液变____色;加入___________溶液颜色变化:____________Fe3+的检验方法:Fe3+与SCN-反应生成显红色的物质,即利用KSCN溶液(硫氰化钾)检验Fe3+的存在。
四、用化学知识解决生活中的实际问题XX医院治疗缺铁(Fe2+)性贫血处方药剂:速力菲(成分为琥珀酸亚铁和Vc)辅助食疗:多食用含铁(Fe3+)丰富的食物和Vc问题1:辅助食疗中Vc的作用是什么?具有什么性?请设计实验验证你的猜想。

铁及其化合物的氧化性和还原性【学习目标】1.知道铁及其常见铁的化合物的物理性质(颜色、状态),了解Fe3+的检验方法。
2.掌握金属铁、氯化铁、氯化亚铁之间的相互转化关系。
3.通过金属铁、氯化铁、氯化亚铁的氧化性或还原性的探究实验,使学生学会“运用已知物质的性质验证未知物质的性质”的科学方法。
【知识回顾】写出化学方程式,,指出氧化剂、还原剂,氧化产物还原产物。
1、三氧化二铁与CO的反应2、氢氧化亚铁在空中被氧化要点突破一、铁元素的存在1.铁元素在地壳中的含量仅次于三种元素。
2.存在形态游离态:存在于中。
化合态:主要以价铁的化合物存在。
如黄铁矿、赤铁矿、磁铁矿、菱铁矿。
二、铁及其化合物的氧化性或还原性1、铁单质具有还原性,能将硫酸电离出的H+还原为氢气离子方程式为________________________________________2含有Fe3+的化合物通常具有氧化性,可氧化Zn AI Fe Cu S2-I-SO2等还原性物质。
如FeCl3遇铁,可将铁原子氧化为Fe2+,自身被还原为Fe2+,离子方程式为________________________________________;此外,还可以氧化其它物质,如: 与锌反应,离子方程式为______________________________________与铜反应,离子方程式为______________________________________3、含有Fe3+的化合物通常具有氧化性,其化合物既可做氧化剂又可做还原剂氧化性:能与Zn、Al等活泼金属作用,表现氧化性,如:与Zn反应的离子方程式为__________________________________ 还原性:可被Cl2,Br2,O2,H2O2,HNO3 ,KMnO4等氧化剂氧化,如:与氯水等反应,离子方程式为_____________________________________________ 2+、Fe3+的检验(氧化性)(氧化性)(还原性)3(还原性)( )1.在铁与硫酸铜溶液的反应中,A .铁被还原,该反应属于化合反应B .铜被还原,该反应属于分解反应C .铁被氧化,该反应属于置换反应D .铜被氧化,该反应属于复分解反应( )2. 能与Fe 3+ 作用,且可证明Fe 3+具有氧化性的微粒是① SCN - ② Fe ③ Fe 2+ ④ Cu ⑤ H 2S ⑥ OH -A.②④⑤B.①③⑥C.①②⑥D.除③外( )3.将铁的化合物溶于盐酸,滴加KSCN 溶液不发生颜色变化,再加入适量氯水,溶液立即呈红色。
铁及其化合物氧化性和还原性实验报告
在铁单质和铁的化合物中,哪些具有氧化性?哪些具有还原性?
哪些既具有氧化性,又具有还原性?我们分别以铁、氯化亚铁和氯化
铁为例进行探究。
实验目的:
探究铁及其化合物的氧化性和还原性实验用品:
试剂:铁粉、稀硫酸、三氯化铁溶液、氯化亚铁溶液、氯水、稀
硝酸、硫氰酸钾溶液、锌片、铜片。
仪器:胶头滴管,试管,烧杯,角匙,镊子。
实验方案:1、设计
依据
铁元素具有还原性:Fe+2H+==Fe2++H2+3价铁的化合物具有氧化性;2fe3++Fe==3fe2++2价铁的化合物既有氧化性又有还原性:
Fe2++Zn==Zn2++fe2fe2++Cl2==2fe3++2cl-2。
方案设计
请以小组为单位,合作设计实验方案;将实验方案与其他小组交流,最终确定最佳方案(操作最简便,预期现象最明显)。
(1)你想用什么实验事实来证明铁的还原性?
(2)你打算通过哪些实验事实来证明+3价铁的化合物具有氧化性?
(3)你打算用什么实验事实来证明+2铁化合物同时具有氧化性和还原性?
实验记录:
方案实施实验内容1.简单铁还原操作步骤2的实验现象结论或解释。
含+3价铁的化合物具有氧化性。
3.含+2价铁的化合物既有氧化性又有还原性。
微专题氧化性和还原性强弱的实验探究1(2023·浙江·高考真题)探究铁及其化合物的性质,下列方案设计、现象和结论都正确的是实验方案现象结论A 往FeCl 2溶液中加入Zn 片短时间内无明显现象Fe 2+的氧化能力比Zn 2+弱B 往Fe 2SO 4 3溶液中滴加KSCN 溶液,再加入少量K 2SO 4固体溶液先变成血红色后无明显变化Fe 3+与SCN -的反应不可逆C 将食品脱氧剂样品中的还原铁粉溶于盐酸,滴加KSCN 溶液溶液呈浅绿色食品脱氧剂样品中没有+3价铁D向沸水中逐滴加5~6滴饱和FeCl 3溶液,持续煮沸溶液先变成红褐色再析出沉淀Fe 3+先水解得Fe (OH )3再聚集成Fe (OH )3沉淀A.AB.BC.CD.D【答案】D【解析】A .FeCl 2溶液中加入Zn 片,Fe 2++Zn =Zn 2++Fe ,溶液由浅绿色变为无色,Fe 2+的氧化能力比Zn 2+强,A 错误;B .溶液变成血红色的原因,Fe 3++3SCN -⇌Fe SCN 3,与SO 2-4和K +无关,B 错误;C .铁离子可能先与单质铁生成亚铁离子,则溶液呈绿色,C 错误;D .向沸水中滴加饱和氯化铁溶液,制取Fe (OH )3胶体,继续加热则胶体因聚沉变为沉淀,D 正确;故答案为:D 。
氧化性和还原性的强弱比较方法一、依据反应原理判断氧化还原反应总是遵循以下规律(简称强弱律):氧化性:氧化剂>氧化产物,氧化剂>还原剂;还原性:还原剂>还原产物,还原剂>氧化剂。
方法二、根据“三表”来判断(1)根据元素在周期表中的相对位置判断(2)依据金属活动性顺序表判断(3)依据非金属活动性顺序表判断方法三、依据“两池”判断(1)两种不同的金属构成原电池的两极。
负极金属是电子流出的极,正极金属是电子流入的极。
其还原性:负极>正极。
(2)用惰性电极电解混合溶液时,在阴极先放电的阳离子的氧化性较强,在阳极先放电的阴离子的还原性较强。