有机化学实验--水蒸气蒸馏
- 格式:ppt
- 大小:1.57 MB
- 文档页数:16



水蒸气蒸馏一、实验目的:1. 学习水蒸气蒸馏的原理及其应用。
2. 掌握水蒸气蒸馏的装置及其操作方法二、实验原理:1.当有机物与水一起共热时,整个系统的蒸汽压根据分压定律应为各组分蒸汽压之和。
р=р(H2O )+рA 。
当P=P 大气,液体沸腾,混合物的沸点低于任何一个组分的沸点。
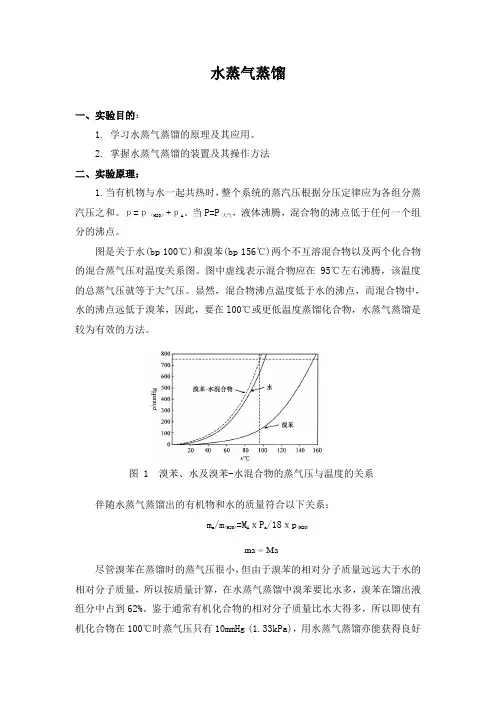
图是关于水(bp 100℃)和溴苯(bp 156℃)两个不互溶混合物以及两个化合物的混合蒸气压对温度关系图。
图中虚线表示混合物应在95℃左右沸腾,该温度的总蒸气压就等于大气压。
显然,混合物沸点温度低于水的沸点,而混合物中,水的沸点远低于溴苯,因此,要在l00℃或更低温度蒸馏化合物,水蒸气蒸馏是较为有效的方法。
伴随水蒸气蒸馏出的有机物和水的质量符合以下关系:m a /m (H2O)=M A xP a /18xp (H2O)ma ∝ Ma尽管溴苯在蒸馏时的蒸气压很小,但由于溴苯的相对分子质量远远大于水的相对分子质量,所以按质量计算,在水蒸气蒸馏中溴苯要比水多,溴苯在馏出液组分中占到62%。
鉴于通常有机化合物的相对分子质量比水大得多,所以即使有机化合物在100℃时蒸气压只有10mmHg (1.33kPa),用水蒸气蒸馏亦能获得良好图 1 溴苯、水及溴苯-水混合物的蒸气压与温度的关系效果。
换句话说,即水蒸气蒸馏可以分离、提纯相对分子质量较高、蒸气压较低的化合物。
2.应用范围:①某些沸点高的有机物,在常压蒸馏虽可与副产品分离,但易将其破坏。
②混合物中含有大量树脂状杂质或不挥发杂质,采用蒸馏、萃取等方法都难于分离。
③从较多固体反应物中分离出被吸附的液体。
3.具备的条件(被提纯的物质)①不溶或难溶于水。
②共沸腾下与水不发生化学反应。
③在1000C左右时,必须具有一定的蒸汽压。
三、实验药品及仪器装置:圆底烧瓶、冷凝管、接受器、电热套、正辛醇水蒸气蒸馏装置由水蒸气发生器和简单蒸馏装置组成,图为常用水蒸气蒸馏装置。
图常用水蒸气蒸馏装置图中A为水蒸气发生器,常用金属制成(也可以用大短颈圆底烧瓶代替),旁边有水位显示玻璃管;B为安全管是一根长1m,直径5mm的玻璃管,将此管插入发生器底部,距底部距离约1cm,如果体系内压力增大,水会沿玻璃管上升,起调节体系内部压力的作用,如果系统发生堵塞,水会从玻璃管上口喷出,这时应停止蒸馏,检查蒸馏系统是否畅通,防止危险发生。

水蒸气蒸馏有机实验报告水蒸气蒸馏有机实验报告引言:水蒸气蒸馏是一种常用的分离纯化有机化合物的方法。
本实验旨在通过水蒸气蒸馏的方法,从混合物中分离出目标有机化合物,并对实验结果进行分析和讨论。
实验步骤:1. 实验前准备:a. 准备所需的实验器材,包括蒸馏装置、冷凝器、烧瓶等。
b. 准备待蒸馏的混合物,确保混合物中含有目标有机化合物。
c. 准备足够的蒸馏水,并将其加入蒸馏装置中。
2. 实验操作:a. 将混合物加入烧瓶中,并将烧瓶与蒸馏装置连接。
b. 打开水源,调节水流量,使水蒸气通过混合物,并将混合物中的目标有机化合物带出。
c. 水蒸气在冷凝器中冷却,形成液体,收集液体。
3. 结果分析:a. 观察收集到的液体的性质,包括颜色、气味等。
b. 进行物质鉴定,使用相关实验方法,如红外光谱、质谱等,确定所收集到的液体是否为目标有机化合物。
c. 计算收率,将实验得到的目标有机化合物的质量与理论质量进行比较,计算出收率。
实验结果与讨论:在本次实验中,我们选择了某种混合物进行水蒸气蒸馏。
经过实验操作,我们成功地从混合物中分离出了目标有机化合物,并收集到了液体。
通过对收集到的液体进行观察和物质鉴定,我们确定了该液体为目标有机化合物。
红外光谱分析结果显示,该化合物具有与目标化合物相符的特征峰。
质谱分析结果进一步证实了该化合物的分子结构。
在计算收率时,我们发现实验得到的目标有机化合物的质量较理论质量略有偏低。
这可能是由于在实验过程中,有部分目标化合物被带出了蒸馏装置,导致收率降低。
此外,实验操作中的温度控制也可能对收率产生影响。
总结:通过本次实验,我们掌握了水蒸气蒸馏的基本原理和操作方法。
通过实践,我们成功地从混合物中分离出了目标有机化合物,并对其进行了性质鉴定和收率计算。
然而,本实验还存在一些改进的空间。
例如,在实验操作中,我们可以进一步优化温度控制,以提高收率。
此外,我们还可以尝试使用其他分析方法,如核磁共振等,对目标化合物进行更详细的结构鉴定。


有机化学实验教案实验名称:水蒸气蒸馏10 化学班第2组:龙顕灼梁海淼梁敏怡【实验原理】水蒸气蒸馏是将水蒸气通入不溶于水的有机物中或使有机物与水经过共沸而蒸出的操作过程。
水蒸气蒸馏是分离和纯化与水不相混溶的挥发性有机物常用的方法。
当水和不(或难)溶于水的化合物一起存在时,整个体系的蒸气压力根据道尔顿分压定律为各组分蒸气压之和。
即p=pA+pB,其中p为总的蒸气压,pA 为水的蒸气压,pB为不溶于的化合物的蒸气压。
当混合物中各组分的蒸气压总和等于外界大气压时,混合物开始沸腾。
所以混合物的沸点比其中任何一组分的沸点都要低。
因此,常压下应用水蒸气蒸馏,能在低于100℃的情况下将高沸点组分与水一起蒸出来。
适用范围:(1)从大量树脂状杂质或不挥发性杂质中分离有机物;(2)某些沸点高的有机化合物,在常压蒸馏虽可与副产品分离,但易将其破坏;(3)从固体多的反应混合物中分离被吸附的液体产物;被提纯物需具有以下条件:(1)不溶或难溶于水;(2)共沸腾下与水不发生化学反应;(3)在100℃左右时,必须具有一定的蒸汽压[至少666.5~1333Pa]本实验是利用水蒸汽蒸馏法从八角茴香果实中提取八角茴香油。
八角茴香油主要成分为大茴香醚(占85%以上),胡椒酚甲醚、黄樟醚、茴香醛、茴香酸等【仪器和药品】仪器:研钵,金属制的水蒸气发生装置,T形管,直三颈烧瓶,直形冷凝管,接液管,锥形瓶,量筒,玻璃管。
药品:10g八角茴香【实验过程和步骤】①安装实验装置(如右图所示)②实验过程和步骤:【注意事项】1、T 形管保持水平;安全管,水蒸气导入管必须插入液面以下,并接近底部处。
2、实验加热前,应先打开T 形管支管的螺旋夹,待有水蒸气从支管处冲出后,关闭螺旋夹。
实验结束时,首先打开螺旋夹,然后再停止加热,以免发生倒吸现象。
3、在操作时,要随时注意安全管中的水柱是否发生不正常的上升现象,以及水蒸气发生器中的液体是否发生倒吸现象,蒸馏部分混合物溅飞是否厉害。

水蒸气蒸馏法教案水蒸气蒸馏法提取精油有机化学实验教案实验名称:水蒸气蒸馏10 化学班第2组:骆永杰王妍雪【实验原理】当水和有机物一起共热时,整个体系的蒸气压力根据分压定律,应为各组分蒸气压之和。
即P=PA+PB,其中P为总的蒸气压,PA 为水的蒸气压,PB为不溶于水的化合物的蒸气压。
当混合物中各组分的蒸气压总和等于外界大气压时,混合物开始沸腾。
而混合物的沸点比其中任何一组分的沸点都要低些。
因此,常压下应用水蒸气蒸馏,能在低于100℃的情况下将高沸点组分与水一起蒸出来。
蒸馏时混合物的沸点保持不变,直到其中一组分几乎全部蒸出(因为总的蒸气压与混合物中二者相对量无关)。
该法适合以下物质:1.不溶或难溶于水。
2.在沸腾下与水长时间共存而不发生化学反应。
3.在100℃左右时必须具有一定的蒸气压。
【仪器和药品】仪器:金属制水蒸气发生器、安全管、玻璃导管、T形管(带乳胶管)、烧杯、三颈烧瓶、直形冷凝管、接液管、锥形瓶、电炉、石棉网、铁架台,铁夹,止水夹,橡胶导管;药品:八角茴香(八角茴香油主要成分为大茴香醚(占85%以上),胡椒酚甲醚、黄樟醚、茴香醛、茴香酸等)、水溶液【实验过程和步骤】①安装实验装置(如下图所示)1.安装正确,连接处严密;2.严守操作程序;水蒸气导入管必须插入三颈烧瓶液面以下,并接近底部处;实验加热前,止水夹应注意打开,待有水蒸气从止水夹处冒出后,关闭止水夹;实验结束时,也首先打开止水夹,然后再停止加热(防止倒吸);5.调节火焰,控制蒸馏速度2~3 d/s,并时刻注意安全管;6.按安装相反顺序拆卸仪器;【注意事项】 3. 4.7.在蒸馏过程中,如发现安全管中的水位迅速上升,则表示系统中发生了堵塞。
此时应立即打开止水夹,然后移去热源,待排除堵塞后再进行水蒸气蒸馏;8.万一冷凝管已经被堵塞,应立即停止蒸馏,并且设法疏通;9.通入和停通冷却水都要缓慢旋动开关,以免水流过急而撑开橡胶导管;【问题设计】1、常用的水蒸气蒸馏装置,它包括几个部分?水蒸气发生器、三颈烧瓶、冷凝管和接受器四个部分2、在水蒸气蒸馏装置中,水蒸气气发生器,通常盛水量以其容积的多少?2/33、在水蒸气蒸馏装置中,蒸馏烧瓶中通常盛水量以其容积的多少?1/34、在水蒸气蒸馏装置中水蒸气导入管应正对烧瓶底中央,距瓶底约8~10mm。

水蒸气蒸馏水蒸气蒸馏是用来分离和提纯液态或固态有机化合物的一种方法,常用于下列几种情况:(1)某些沸点高的有机化合物,在常压下蒸馏虽可与副产品分离,但易被破坏;(2)混合物中含有大量树脂状杂质或不挥发性杂质,采用蒸馏、萃取等方法都难于分离;(3)从较多固体反应物中分离出被吸附的液体。
1.基本原理根据道尔顿分压定律,当与水不相混溶的物质与水共存时,整个体系的蒸气压应为各组分蒸气压之和,即:p=p A+ p B其中p代表总的蒸气压,p A为水的蒸气压,p B为与水不相混溶物质的蒸气压。
当混合物中各组分蒸气压总和等于外界大气压时,这时的温度即为它们的沸点。
此沸点比各组分的沸点都低。
因此,在常压下应用水蒸气蒸馏,就能在低于100℃的情况下将高沸点组分与水一起蒸出来。
因为总的蒸气压与混合物中二者间的相对量无关,直到其中一组分几乎完全移去,温度才上升至留在瓶中液体的沸点。
我们知道,混合物蒸气中各个气体分压(p A,p B)之比等于它们的物质的量(n A,n B)之比,即:而n A=m A/M A;n B=m B/M B。
其中m A、m B为各物质在一定容积中蒸气的质量,M A、M B为物质A和B的相对分子质量。
因此:可见,这两种物质在馏液中的相对质量(就是它们在蒸气中的相对质量)与它们的蒸气压和相对分子质量成正比。
以苯胺为例,它的沸点为184.4℃,且和水不相混溶。
当和水一起加热至98.4℃时,水的蒸气压为95.4 kPa,苯胺的蒸气压为5.6 kPa,它们的总压力接近大气压力,于是液体就开始沸腾,苯胺就随水蒸气一起被蒸馏出来,水和苯胺的相对分子质量分别为18和93,代入上式:即蒸出3.3 g水能够带出1 g苯胺。
苯胺在溶液中的组分占23.3%。
实验中蒸出的水量往往超过计算值,因为苯胺微溶于水,实验中尚有一部分水蒸气来不及与苯胺充分接触便离开蒸馏烧瓶的缘故。
利用水蒸气蒸馏来分离提纯物质时,要求此物质在100℃左右时的蒸气压至少在1.33 kPa左右。


水蒸气蒸馏一、实验目的1、了解水蒸气蒸馏的原理和应用2、掌握水蒸气蒸馏的装置和操作方法二、实验原理水蒸气蒸馏是分离和提纯有机化合物的常用方法。
水蒸气蒸馏的用用途:1、从大量树脂状杂质或无挥发杂质中分离有机物2、除去无挥发的有机杂质3、从固体多的反应混合物种分离被吸附的液体产物提纯物质必须具备以下条件:1、不溶或难溶于水2、与水一起沸腾时不发生化学变化3、在1000C左右该物质气压至少在10mmHg(1.33KPa)以上,水蒸气蒸馏常用于以下几种情1在常压下蒸馏易发生分解的高沸点有机物2含有较多固体的混合物而有一方又难以分离水蒸气蒸馏:在难熔或者不溶于水的有机物中通入水蒸气或与水一起共热,使有机物随水蒸气一起蒸馏出来,这种操作称为水蒸气蒸馏。
三、实验仪器及试剂仪器:铁架台,电炉,石棉网,升降台,三口烧瓶,圆底烧瓶,T行管螺旋夹,蒸馏头,橡皮管,分液漏斗,烧杯,直形冷凝管。
五、实验流程搭装置加料通冷凝水加热关T形管分液拆装置降温升T形管收集称量七、注意事项1、检查装置气密性。
2、尽量减少水蒸汽发生器与蒸馏烧瓶之间的距离,以减少水汽的冷凝。
3、当馏出液体澄清透明,不含有油珠状的有机物时,即可停止蒸馏,这是应该先打开夹子,然后移去热源。
4、在蒸馏过程中,检查安全管中的水位是否正常,如发现其突然升高,意味着有都塞现象,应立即打开止水夹,移去热源,使水蒸气发生器与大气相通,排除故障后在蒸馏,T形管支管处水积聚过多,超出直管部分,打开止水夹,将水放掉。
5、水蒸气蒸馏时,蒸汽导入管的末端插入到接近于容器的底端。
八、误差分析1、蒸馏时没有蒸馏完全。
2、分液时,油状液珠没有聚集在一起,因此,造成一些没有收集。
一、实验目的1. 了解水蒸气蒸馏的原理及其应用。
2. 掌握水蒸气蒸馏的装置和操作方法。
3. 通过实验,提高实验操作技能,加深对化学原理的理解。
二、实验原理水蒸气蒸馏(Steam Distillation)是一种常用的分离和提纯有机化合物的实验方法。
该方法适用于以下几种情况:1. 在常压下蒸馏易发生分解的高沸点有机物。
2. 含有较多固体的混合物,而用其他方法难以分离。
3. 难溶或不溶于水的有机物。
水蒸气蒸馏的原理是:当被提纯物质与水一起加热时,由于沸点低,有机物随水蒸气一起蒸馏出来。
在冷凝过程中,水蒸气冷凝成水,而有机物则因密度较大而沉淀,从而实现分离和提纯。
三、实验仪器与药品1. 仪器:电炉、石棉网、圆底烧瓶、安全管、T型管、螺旋夹、导气管、玻璃塞、蒸馏弯头、冷凝管、接液管、锥形瓶、升降台。
2. 药品:乙酸正丁酯、水、沸石。
四、实验步骤1. 加料:在水蒸气发生器(圆底烧瓶)中加入约占容器3/4的水,并加入2~3粒沸石。
在蒸馏部分(三口烧瓶)中加入50ml乙酸正丁酯。
2. 安装仪器:按照从下到上、从左到右的顺序安装仪器,确保连接牢固。
3. 加热:打开T形管处的螺旋夹,加热水蒸气发生器至沸腾,当有大量水蒸气产生从T形管冲出时,立即旋紧螺旋夹。
4. 蒸馏:保持水蒸气发生器沸腾,观察冷凝管中的馏液。
当馏液澄清透明不再有油状物时,即可停止蒸馏。
5. 收集:先打开螺旋夹,然后停止加热。
将馏液倒入分液漏斗中,静止,分液。
产品用量筒取体积。
五、实验结果与分析1. 实验结果:通过水蒸气蒸馏实验,成功提取出乙酸正丁酯。
2. 结果分析:水蒸气蒸馏法是一种有效的分离和提纯有机化合物的实验方法。
在实验过程中,需要注意以下几点:(1)加料:确保水蒸气发生器中的水占容器3/4,并加入沸石,防止暴沸。
(2)加热:加热水蒸气发生器至沸腾,保持蒸馏过程平稳。
(3)观察:观察冷凝管中的馏液,当馏液澄清透明不再有油状物时,即可停止蒸馏。
有机化学实验教案(水蒸气蒸馏)第一章:实验原理1.1 概述水蒸气蒸馏是一种常用的分离和提纯有机物的方法,它利用有机物与水在不同温度下的沸点差异来实现分离。
本章将介绍水蒸气蒸馏的基本原理和实验操作步骤。
1.2 实验原理水蒸气蒸馏的原理是基于有机物与水在不同温度下的沸点差异。
当有机物与水混合加热时,水蒸气会将有机物携带到蒸馏瓶的顶部,通过冷凝管冷凝成液体,收集分离出的有机物。
1.3 实验仪器与材料本实验所需的主要仪器有蒸馏瓶、冷凝管、温度计、加热器、接收瓶等。
实验材料包括有机物样品、蒸馏水等。
第二章:实验操作步骤2.1 实验准备在实验开始前,检查实验仪器的完整性和清洁度,并准备所需的实验材料。
2.2 装填蒸馏瓶将有机物样品加入蒸馏瓶中,注意不要超过蒸馏瓶的容量。
将蒸馏瓶固定在加热器上。
2.3 连接冷凝管将冷凝管的一端放入水中,另一端连接到蒸馏瓶的顶部。
确保冷凝管的连接牢固,并排除其中的空气。
2.4 加热蒸馏打开加热器,逐渐加热蒸馏瓶。
观察温度计的读数,当温度达到有机物的沸点时,开始收集蒸馏出的液体。
2.5 收集产物将蒸馏出的液体通过冷凝管收集到接收瓶中。
注意及时关闭加热器,并在蒸馏结束后将接收瓶从冷凝管上取下。
第三章:实验注意事项3.1 安全注意事项在进行水蒸气蒸馏实验时,应注意实验室的安全规定,佩戴好个人防护装备,避免接触热源和化学品。
3.2 实验操作注意事项在实验操作过程中,要注意仪器的连接和固定,避免发生泄漏或意外。
要注意观察温度计的读数,确保蒸馏过程的准确性和安全性。
第四章:实验数据处理与分析4.1 实验数据的记录在实验过程中,要记录蒸馏的温度、时间和产物的收率等数据。
确保数据的准确性和完整性。
4.2 实验结果的分析根据实验数据,计算出有机物的沸点和产物的纯度等参数,并进行分析。
通过与理论值的比较,评估实验结果的准确性。
5.1 实验报告的结构实验报告应包括实验目的、实验原理、实验仪器与材料、实验操作步骤、实验数据处理与分析和实验结论等部分。