有机化学实验五 水蒸汽蒸馏
- 格式:doc
- 大小:267.00 KB
- 文档页数:6






有机化学实验蒸馏实验报告有机化学实验蒸馏实验报告引言:有机化学实验是化学专业学生必修的一门实践课程,通过实验掌握有机化合物的合成、分离和鉴定等基本技术。
蒸馏是有机化学实验中常用的一种分离技术,通过利用不同物质的沸点差异,实现对混合物的分离。
本次实验旨在通过蒸馏法分离和纯化混合物,加深对蒸馏原理和操作的理解。
实验方法:1. 实验仪器与试剂准备本次实验所需仪器包括蒸馏装置、温度计、冷却器等。
试剂方面,我们选择了混合物A和混合物B作为待分离的样品。
2. 实验步骤首先,将混合物A倒入蒸馏烧瓶中,装好蒸馏装置,并将温度计插入烧瓶中。
然后,用加热器逐渐升温,观察温度变化。
当温度稳定在某一数值时,开始采集收集液体。
3. 收集液体通过冷却器将蒸馏出的液体冷却,并收集于试管中。
由于混合物A中含有两种不同沸点的成分,因此在收集液体的过程中需要根据温度变化及时更换试管。
实验结果与讨论:经过实验,我们成功地将混合物A分离成两个组分。
通过观察温度的变化,我们发现在开始升温时,温度迅速上升,达到一个平台后保持稳定。
这是因为混合物A中的低沸点组分首先蒸发出来,导致温度上升,而高沸点组分则在较高温度时才开始蒸发。
在收集液体的过程中,我们发现随着温度的升高,试管中的液体逐渐变清澈,呈现出纯净的状态。
这说明我们成功地将混合物中的杂质分离出去,得到了纯净的有机物。
实验中还需要注意的是,由于混合物A中的两个组分沸点相差较大,因此在收集液体时需要及时更换试管,以免混合两个组分。
另外,温度的稳定性也是实验成功的关键,需要控制好加热器的火候,避免温度波动过大。
结论:通过本次实验,我们成功地利用蒸馏法将混合物A分离成两个组分,并得到了纯净的有机物。
实验结果验证了蒸馏法的有效性和可靠性,加深了我们对蒸馏原理和操作的理解。
在实际应用中,蒸馏法广泛应用于化工、制药等领域,用于分离和纯化各种有机物。
通过掌握蒸馏技术,我们可以更好地处理和利用有机化合物,为相关领域的研究和生产提供有力支持。
水蒸气蒸馏一、实验目的:1. 学习水蒸气蒸馏的原理及其应用。
2. 掌握水蒸气蒸馏的装置及其操作方法二、实验原理:1.当有机物与水一起共热时,整个系统的蒸汽压根据分压定律应为各组分蒸汽压之和。
р=р(H2O )+рA 。
当P=P 大气,液体沸腾,混合物的沸点低于任何一个组分的沸点。
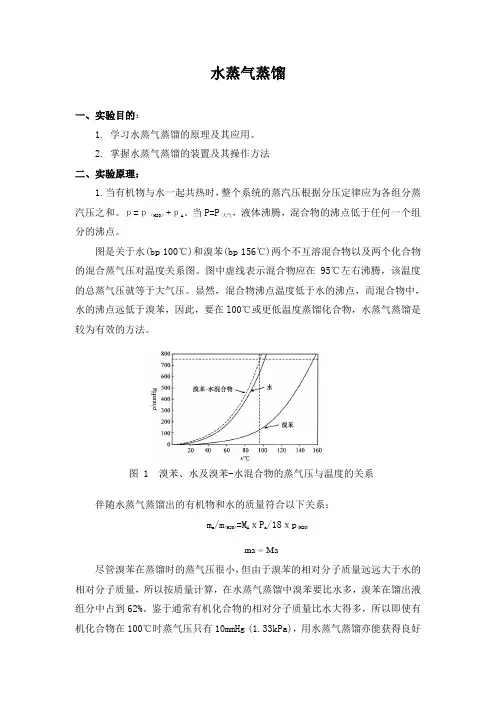
图是关于水(bp 100℃)和溴苯(bp 156℃)两个不互溶混合物以及两个化合物的混合蒸气压对温度关系图。
图中虚线表示混合物应在95℃左右沸腾,该温度的总蒸气压就等于大气压。
显然,混合物沸点温度低于水的沸点,而混合物中,水的沸点远低于溴苯,因此,要在l00℃或更低温度蒸馏化合物,水蒸气蒸馏是较为有效的方法。
伴随水蒸气蒸馏出的有机物和水的质量符合以下关系:m a /m (H2O)=M A xP a /18xp (H2O)ma ∝ Ma尽管溴苯在蒸馏时的蒸气压很小,但由于溴苯的相对分子质量远远大于水的相对分子质量,所以按质量计算,在水蒸气蒸馏中溴苯要比水多,溴苯在馏出液组分中占到62%。
鉴于通常有机化合物的相对分子质量比水大得多,所以即使有机化合物在100℃时蒸气压只有10mmHg (1.33kPa),用水蒸气蒸馏亦能获得良好图 1 溴苯、水及溴苯-水混合物的蒸气压与温度的关系效果。
换句话说,即水蒸气蒸馏可以分离、提纯相对分子质量较高、蒸气压较低的化合物。
2.应用范围:①某些沸点高的有机物,在常压蒸馏虽可与副产品分离,但易将其破坏。
②混合物中含有大量树脂状杂质或不挥发杂质,采用蒸馏、萃取等方法都难于分离。
③从较多固体反应物中分离出被吸附的液体。
3.具备的条件(被提纯的物质)①不溶或难溶于水。
②共沸腾下与水不发生化学反应。
③在1000C左右时,必须具有一定的蒸汽压。
三、实验药品及仪器装置:圆底烧瓶、冷凝管、接受器、电热套、正辛醇水蒸气蒸馏装置由水蒸气发生器和简单蒸馏装置组成,图为常用水蒸气蒸馏装置。
图常用水蒸气蒸馏装置图中A为水蒸气发生器,常用金属制成(也可以用大短颈圆底烧瓶代替),旁边有水位显示玻璃管;B为安全管是一根长1m,直径5mm的玻璃管,将此管插入发生器底部,距底部距离约1cm,如果体系内压力增大,水会沿玻璃管上升,起调节体系内部压力的作用,如果系统发生堵塞,水会从玻璃管上口喷出,这时应停止蒸馏,检查蒸馏系统是否畅通,防止危险发生。

实验名称:水蒸汽蒸馏一、实验目的1、学习水蒸汽蒸馏的原理及其应用。
2、认识水蒸汽蒸馏的主要仪器,掌握水蒸汽蒸馏的装置及其操作方法。
二、实验原理水蒸气蒸馏(Steam Distillation)是将水蒸气通入不溶于水的有机物中或使有机物与水经过共沸而蒸出的操作过程。
水蒸气蒸馏是分离和纯化与水不相混溶的挥发性有机物常用的方法。
适用范围(1)从大量树脂状杂质或不挥发性杂质中分离有机物;(2)除去不挥发性的有机杂质;(3)从固体多的反应混合物中分离被吸附的液体产物;(4)水蒸气蒸馏常用于蒸馏那些沸点很高且在接近或达到沸点温度时易分解、变色的挥发性液体或固体有机物,除去不挥发性的杂质。
但是对于那些与水共沸腾时会发生化学反应的或在100度左右时蒸气压小于1.3KPa的物质,这一方法不适用。
根据分压定律:当水与有机物混合共热时,其总蒸气压为各组分分压之和。
即:P = P H2O + P A,当总蒸气压(P)与大气压力相等时,则液体沸腾。
有机物可在比其沸点低的多的温度,而且在低于100 ℃的温度下随蒸气一起蒸馏出来,这样的操作叫做水蒸气蒸馏。
馏出液组分的计算:假定两组分是理想气体,则根据PV = nRT = WRT / M得W A / W H2O = M A P A /M H2O P H2O。
例:苯甲醛(b.p. 178℃),进行水蒸气蒸馏时,在97.9℃沸腾。
这时P H2O = 703.5 mmHgP C6H5CHO = 760-703.5 = 56.5 mmHg,M C6H5CHO = 106,M H2O = 18,代入上式得W C6H5CHO/W H2O=106×56.5 / 18×703.5 = 0.473 (g)即每蒸出0.473 (g) C6H5CHO,需蒸出水的量为1 g,若蒸10 mL C6H5CHO,需出水量(理论):10×1.041 / 0.4733 = 10.41 / 0.473 = 22 mL(H2O)即蒸馏10 mL C6H5CHO,有22 mLH2O被蒸出。


水蒸气蒸馏实验报告
实验目的:
通过水蒸气蒸馏实验,掌握水蒸气蒸馏的原理和方法,了解其在分离纯净液体
混合物中的应用。
实验仪器和试剂:
1. 蒸馏瓶。
2. 醇。
3. 水。
4. 温度计。
5. 醇液体混合物。
实验原理:
水蒸气蒸馏是利用水蒸气的升华和凝华来分离液体混合物的方法。
在蒸馏瓶中
加热混合物,混合物中的易挥发成分先蒸发成气体,然后与水蒸气一起进入冷凝管,在冷凝管中冷却凝结成液体,从而实现混合物的分离。
实验步骤:
1. 将蒸馏瓶中加入少量水,然后加入醇液体混合物;
2. 将蒸馏瓶连接上冷凝管,并将冷凝管的另一端浸入冷水中;
3. 用酒精灯加热蒸馏瓶中的混合物,同时用温度计监测温度;
4. 观察冷凝管中的液体,直至观察到醇液体分离出来;
5. 将分离出的醇液体收集起来。
实验结果:
经过水蒸气蒸馏,醇液体成功被分离出来,观察到蒸馏瓶中的液体逐渐减少,而冷凝管中逐渐收集到醇液体。
实验分析:
水蒸气蒸馏是一种有效的分离方法,通过利用水蒸气的升华和凝华,可以实现液体混合物的分离。
在本次实验中,我们成功分离出了醇液体,并且观察到整个分离过程。
在实验过程中,温度的控制非常重要,需要确保温度适宜,以保证混合物能够充分蒸发和冷凝。
实验总结:
通过本次实验,我们深入了解了水蒸气蒸馏的原理和方法,掌握了这一实验技术。
水蒸气蒸馏在实际应用中具有重要意义,能够用于分离和提纯液体混合物,具有广泛的应用前景。
通过本次实验,我们不仅掌握了水蒸气蒸馏的操作技能,更加深了对化学原理的理解,为今后的学习和科研打下了坚实的基础。

有机化学实验教案实验名称:水蒸气蒸馏10 化学班第2组:龙顕灼梁海淼梁敏怡【实验原理】水蒸气蒸馏是将水蒸气通入不溶于水的有机物中或使有机物与水经过共沸而蒸出的操作过程。
水蒸气蒸馏是分离和纯化与水不相混溶的挥发性有机物常用的方法。
当水和不(或难)溶于水的化合物一起存在时,整个体系的蒸气压力根据道尔顿分压定律为各组分蒸气压之和。
即p=pA+pB,其中p为总的蒸气压,pA 为水的蒸气压,pB为不溶于的化合物的蒸气压。
当混合物中各组分的蒸气压总和等于外界大气压时,混合物开始沸腾。
所以混合物的沸点比其中任何一组分的沸点都要低。
因此,常压下应用水蒸气蒸馏,能在低于100℃的情况下将高沸点组分与水一起蒸出来。
适用范围:(1)从大量树脂状杂质或不挥发性杂质中分离有机物;(2)某些沸点高的有机化合物,在常压蒸馏虽可与副产品分离,但易将其破坏;(3)从固体多的反应混合物中分离被吸附的液体产物;被提纯物需具有以下条件:(1)不溶或难溶于水;(2)共沸腾下与水不发生化学反应;(3)在100℃左右时,必须具有一定的蒸汽压[至少666.5~1333Pa]本实验是利用水蒸汽蒸馏法从八角茴香果实中提取八角茴香油。
八角茴香油主要成分为大茴香醚(占85%以上),胡椒酚甲醚、黄樟醚、茴香醛、茴香酸等【仪器和药品】仪器:研钵,金属制的水蒸气发生装置,T形管,直三颈烧瓶,直形冷凝管,接液管,锥形瓶,量筒,玻璃管。
药品:10g八角茴香【实验过程和步骤】①安装实验装置(如右图所示)②实验过程和步骤:【注意事项】1、T 形管保持水平;安全管,水蒸气导入管必须插入液面以下,并接近底部处。
2、实验加热前,应先打开T 形管支管的螺旋夹,待有水蒸气从支管处冲出后,关闭螺旋夹。
实验结束时,首先打开螺旋夹,然后再停止加热,以免发生倒吸现象。
3、在操作时,要随时注意安全管中的水柱是否发生不正常的上升现象,以及水蒸气发生器中的液体是否发生倒吸现象,蒸馏部分混合物溅飞是否厉害。
有机化学实验报告蒸馏有机化学实验报告:蒸馏导言:有机化学实验中,蒸馏是一种常用的分离和纯化技术。
通过利用液体的沸点差异,将混合物中的组分分离出来。
本实验旨在通过蒸馏技术分离和纯化某有机化合物,并探究其原理和操作步骤。
实验目的:1. 理解蒸馏技术的基本原理和应用;2. 掌握蒸馏装置的组成和操作方法;3. 学会通过蒸馏分离和纯化有机化合物。
实验仪器和试剂:1. 蒸馏装置:包括加热设备、冷凝器、接收瓶等;2. 有机化合物混合物:例如酒精和水的混合物。
实验步骤:1. 将有机化合物混合物倒入蒸馏烧瓶中;2. 将冷凝器连接到蒸馏烧瓶上,并确保密封良好;3. 加热蒸馏烧瓶,使混合物沸腾;4. 蒸馏过程中,通过冷凝器冷却蒸汽,使其凝结成液体;5. 收集凝结后的液体,即为分离出的有机化合物。
实验结果与讨论:在进行实验时,我们发现酒精和水的混合物可以通过蒸馏技术进行分离。
由于酒精的沸点较低,当加热混合物时,酒精会先蒸发出来,通过冷凝器凝结成液体并收集。
而水则留在蒸馏烧瓶中,无法蒸发出来。
蒸馏技术的原理是基于液体的沸点差异。
不同的有机化合物具有不同的沸点,通过加热混合物,沸点较低的成分会首先蒸发,并通过冷凝器凝结成液体。
这样,我们可以将混合物中的不同成分逐一分离出来。
蒸馏技术在实际应用中有着广泛的用途。
例如,在石油化工行业中,可以利用蒸馏技术将原油分离成不同沸点的组分,从而得到石油产品和化工原料。
此外,在制药工业中,蒸馏技术也常用于纯化药物和去除杂质。
然而,蒸馏技术也存在一些局限性。
对于沸点相差较小的有机化合物,蒸馏效果可能不太理想。
此时,可以通过改变蒸馏条件,如增加蒸馏装置的效率或者改变蒸馏压力,来提高分离效果。
总结:蒸馏是一种常用的有机化学分离和纯化技术。
通过利用液体的沸点差异,我们可以将混合物中的不同成分逐一分离出来。
本实验通过蒸馏技术成功分离了酒精和水的混合物,并探究了蒸馏技术的原理和操作步骤。
蒸馏技术在石油化工和制药工业等领域有着广泛的应用,但也存在一定的局限性。
实验五水蒸气蒸馏1.实验目的:2.学习水蒸汽蒸馏的原理及应用;一.2.掌握水蒸汽蒸馏的装置及其操作方法;3.比较水蒸气蒸馏、普通蒸馏和分馏的异同点。
实验重点和难点:3. 1. 学习水蒸汽蒸馏的原理及应用;4.掌握水蒸汽蒸馏的装置及其操作方法;二.实验类型: 基础性实验学时: 4学时实验装置和药品:实验仪器: 玻璃管250mL圆底烧瓶克氏蒸馏瓶冷凝管接引管接液瓶电热套T形管(弹簧夹) 温度计及套管分液漏斗量筒弯管三.化学试剂: 苯胺(化学纯) 20mL实验装置图: 【参见教材P82图3.8所示】实验原理:水蒸气蒸馏(Steam Distillation)原理, 简言之, 就是当水和不(或难)溶于水的化合物一起存在时, 整个体系的蒸气压力根据道尔顿分压定律, 应为各组分蒸气压力之和。
即:P=P水+ PA (PA为与不(或难)溶化合物的蒸气压)。
当P与外界大气压相等时, 混合物就沸腾。
这时的温度即为它们的沸点, 所以混合物的沸点将比任何一组分的沸点都要低一些。
而且在低于1000C的温度下随水蒸汽一起蒸馏出来。
这样的操作叫水蒸气蒸馏。
水蒸汽蒸馏是用来分离和提纯液态或固态有机化合物的一种方法。
常用在下列几种情况下:(1).某些沸点高的有机化合物, 在常压蒸馏虽可与副产品分离, 但易将其破坏。
(2).混合物中含有大量树脂状杂质或不挥发性杂质,采用蒸馏、萃取等方法都难于分离。
(3).从较多固体反应物中分离出被吸附的液体。
2.被提纯物质必须具备以下几个条件:(1).不溶或难溶于水。
(2).共沸腾下与水不发生化学反应。
(3).在100℃左右时,必须具有一定的蒸气压(一般不小于1.33KPa.。
3.基本原理:当有机物与水一起共热时, 整个体系的蒸气压力, 根据分压定律(道尔顿Dalton分压定律) , 应为各组分蒸气压之和。
即: P=Pa+Pb式中: P----代表总蒸气压;Pa----代表水的蒸气压;Pb----代表与水不相溶物质或难溶物质的蒸气压。
水蒸气蒸馏一、实验目的1、了解水蒸气蒸馏的原理和应用2、掌握水蒸气蒸馏的装置和操作方法二、实验原理水蒸气蒸馏是分离和提纯有机化合物的常用方法。
水蒸气蒸馏的用用途:1、从大量树脂状杂质或无挥发杂质中分离有机物2、除去无挥发的有机杂质3、从固体多的反应混合物种分离被吸附的液体产物提纯物质必须具备以下条件:1、不溶或难溶于水2、与水一起沸腾时不发生化学变化3、在1000C左右该物质气压至少在10mmHg(1.33KPa)以上,水蒸气蒸馏常用于以下几种情1在常压下蒸馏易发生分解的高沸点有机物2含有较多固体的混合物而有一方又难以分离水蒸气蒸馏:在难熔或者不溶于水的有机物中通入水蒸气或与水一起共热,使有机物随水蒸气一起蒸馏出来,这种操作称为水蒸气蒸馏。
三、实验仪器及试剂仪器:铁架台,电炉,石棉网,升降台,三口烧瓶,圆底烧瓶,T行管螺旋夹,蒸馏头,橡皮管,分液漏斗,烧杯,直形冷凝管。
五、实验流程搭装置加料通冷凝水加热关T形管分液拆装置降温升T形管收集称量七、注意事项1、检查装置气密性。
2、尽量减少水蒸汽发生器与蒸馏烧瓶之间的距离,以减少水汽的冷凝。
3、当馏出液体澄清透明,不含有油珠状的有机物时,即可停止蒸馏,这是应该先打开夹子,然后移去热源。
4、在蒸馏过程中,检查安全管中的水位是否正常,如发现其突然升高,意味着有都塞现象,应立即打开止水夹,移去热源,使水蒸气发生器与大气相通,排除故障后在蒸馏,T形管支管处水积聚过多,超出直管部分,打开止水夹,将水放掉。
5、水蒸气蒸馏时,蒸汽导入管的末端插入到接近于容器的底端。
八、误差分析1、蒸馏时没有蒸馏完全。
2、分液时,油状液珠没有聚集在一起,因此,造成一些没有收集。
有机化学实验教案(水蒸气蒸馏)第一章:实验原理1.1 概述水蒸气蒸馏是一种常用的分离和提纯有机物的方法,它利用有机物与水在不同温度下的沸点差异来实现分离。
本章将介绍水蒸气蒸馏的基本原理和实验操作步骤。
1.2 实验原理水蒸气蒸馏的原理是基于有机物与水在不同温度下的沸点差异。
当有机物与水混合加热时,水蒸气会将有机物携带到蒸馏瓶的顶部,通过冷凝管冷凝成液体,收集分离出的有机物。
1.3 实验仪器与材料本实验所需的主要仪器有蒸馏瓶、冷凝管、温度计、加热器、接收瓶等。
实验材料包括有机物样品、蒸馏水等。
第二章:实验操作步骤2.1 实验准备在实验开始前,检查实验仪器的完整性和清洁度,并准备所需的实验材料。
2.2 装填蒸馏瓶将有机物样品加入蒸馏瓶中,注意不要超过蒸馏瓶的容量。
将蒸馏瓶固定在加热器上。
2.3 连接冷凝管将冷凝管的一端放入水中,另一端连接到蒸馏瓶的顶部。
确保冷凝管的连接牢固,并排除其中的空气。
2.4 加热蒸馏打开加热器,逐渐加热蒸馏瓶。
观察温度计的读数,当温度达到有机物的沸点时,开始收集蒸馏出的液体。
2.5 收集产物将蒸馏出的液体通过冷凝管收集到接收瓶中。
注意及时关闭加热器,并在蒸馏结束后将接收瓶从冷凝管上取下。
第三章:实验注意事项3.1 安全注意事项在进行水蒸气蒸馏实验时,应注意实验室的安全规定,佩戴好个人防护装备,避免接触热源和化学品。
3.2 实验操作注意事项在实验操作过程中,要注意仪器的连接和固定,避免发生泄漏或意外。
要注意观察温度计的读数,确保蒸馏过程的准确性和安全性。
第四章:实验数据处理与分析4.1 实验数据的记录在实验过程中,要记录蒸馏的温度、时间和产物的收率等数据。
确保数据的准确性和完整性。
4.2 实验结果的分析根据实验数据,计算出有机物的沸点和产物的纯度等参数,并进行分析。
通过与理论值的比较,评估实验结果的准确性。
5.1 实验报告的结构实验报告应包括实验目的、实验原理、实验仪器与材料、实验操作步骤、实验数据处理与分析和实验结论等部分。
实验五水蒸气蒸馏一.实验目的:1.学习水蒸汽蒸馏的原理及应用;2. 掌握水蒸汽蒸馏的装置及其操作方法;3.比较水蒸气蒸馏、普通蒸馏和分馏的异同点。
二.实验重点和难点:1. 学习水蒸汽蒸馏的原理及应用;2.掌握水蒸汽蒸馏的装置及其操作方法;实验类型:基础性实验学时:4学时三.实验装置和药品:实验仪器:玻璃管250mL圆底烧瓶克氏蒸馏瓶冷凝管接引管接液瓶电热套T形管(弹簧夹) 温度计及套管分液漏斗量筒弯管化学试剂:苯胺(化学纯) 20mL四.实验装置图:【参见教材P82图3.8所示】五.实验原理:水蒸气蒸馏(Steam Distillation)原理,简言之,就是当水和不(或难)溶于水的化合物一起存在时,整个体系的蒸气压力根据道尔顿分压定律,应为各组分蒸气压力之和。
即:P=P水+ P A(P A为与不(或难)溶化合物的蒸气压)。
当P与外界大气压相等时,混合物就沸腾。
这时的温度即为它们的沸点,所以混合物的沸点将比任何一组分的沸点都要低一些。
而且在低于1000C的温度下随水蒸汽一起蒸馏出来。
这样的操作叫水蒸气蒸馏。
水蒸汽蒸馏是用来分离和提纯液态或固态有机化合物的一种方法。
1.常用在下列几种情况下:(1). 某些沸点高的有机化合物,在常压蒸馏虽可与副产品分离,但易将其破坏。
(2). 混合物中含有大量树脂状杂质或不挥发性杂质,采用蒸馏、萃取等方法都难于分离。
(3). 从较多固体反应物中分离出被吸附的液体。
2.被提纯物质必须具备以下几个条件:(1). 不溶或难溶于水。
(2). 共沸腾下与水不发生化学反应。
(3). 在100℃左右时,必须具有一定的蒸气压(一般不小于1.33KPa) 。
3.基本原理:当有机物与水一起共热时,整个体系的蒸气压力,根据分压定律(道尔顿Dalton分压定律) ,应为各组分蒸气压之和。
即:P=Pa+Pb式中:P----代表总蒸气压;Pa----代表水的蒸气压;Pb----代表与水不相溶物质或难溶物质的蒸气压。
那么,当混合物中各组分蒸气压总和P等于外界大气压时,这时的温度即为它们的沸点,则液体沸腾。
显然,混合物的沸点低于任何一个组分的沸点。
即:有机物可在比其沸点低的多的温度,而且在低于100℃的温度下随蒸气一起蒸馏出来,这样的操作叫做水蒸汽蒸馏。
因此,在常压下应用水蒸汽蒸馏就能在低于100℃的情况下将高沸点组分与水一起蒸馏出来。
此法特别适用于分离那些在其沸点附近易分解的物质;也适用于从不挥发物质或不需要的树脂状物质中分离出所需的组分。
蒸馏时混合物的沸点保持不变,直至其中一组分几乎完全移去,温度才上升至留在瓶中液体的沸点。
另外,根据两种物质在馏液中的相对质量(就是它们在蒸气中的相对质量) ,与它们的蒸气压和相对分子量成正比。
即M A/M B=M A×P A / M B×P B根据上式,可计算得到馏液中有机物的大致含量。
六.实验內容及步骤:1.安装实验装置及解析:按教材P83图3.6或上图装置图安装实验装置。
水蒸气蒸馏有两种方法:—种是将水蒸气发生器产生的水蒸气通入盛有被蒸物的烧瓶中,使被蒸物与水一起蒸出;另一种方法是将水加入到装有被蒸物的烧瓶中,与普通蒸馏方法相同,直接加热烧瓶,进行蒸馏,这是一种简化了的水蒸气蒸馏方法;当蒸馏时间较短,不需耗用大量水蒸气时,可采用这种方法。
(1).装置:图3.3.3-1为常用的水蒸气蒸馏装置。
A为水蒸气发生器,常用金属制成,也可以用大圆底烧瓶,一般盛水量为其容量的2/3为宜。
B为安全管,插到发生器底部,如果体系内压力增大,水会沿玻璃管上升,起到调节压力的作用。
如果系统发生阻塞,水会从管的上口喷出,这时应停止蒸馏,查找原因。
D为蒸馏瓶,E为蒸气导入管(2).安装:蒸馏瓶D是500mL以上的长颈圆底烧瓶,烧瓶向发生器方向倾斜45°角,以免溅起的液沫被蒸气带进冷凝管中;瓶内液体不超过其容积的1/3。
在水蒸气发生器A与蒸气导入管E之间用橡胶管连接一个T形管,T形管下端连接一段带有螺旋夹G的乳胶管。
打开螺旋夹G,可以及时放掉蒸气冷凝形成的水滴。
蒸气发生器至蒸馏瓶之间的蒸气导管应尽可能短,以减少蒸气的冷凝。
蒸气导管E的下端应尽量接近瓶底,但不对与瓶底接触,弯曲部分位于瓶中液体的中央并与瓶底垂直,以便于水蒸气与蒸馏物质充分接触并起搅动作用。
与冷凝管连接的导管F为30°角。
进行蒸馏时,打开T形管下瑞的螺旋夹G,加热水蒸气发生器A,直至水沸腾,当有大量水蒸气产生时,将螺旋夹G拧紧,使水蒸气通入蒸馏瓶D中。
为了不使蒸馏瓶D中的液体积累过多,必要时,可在D下面加一石棉网,用小火加热,但应注意控制加热速度,使蒸气能在冷凝管中全部冷凝下来。
在蒸馏固体物质时,它们往往在冷凝管中凝结为固体,这时可暂停甚至放掉冷凝水,如果无效则立即停止蒸馏,用长玻璃棒将固体捅出或用吹风机的热风将固体熔化。
当馏出液澄清不含油滴时,为蒸馏终点。
中途停止蒸馏或结束蒸馏时,应先打开T形管下方的螺旋夹G,然后停止加热,以防蒸馏瓶D中的液体倒吸入水蒸气发生器中。
常用的水蒸气蒸馏装置,它包括蒸馏、水蒸气发生器、冷凝和接受器四个部分。
在水蒸气蒸馏装置图中,A是水蒸气气发生器,通常盛水量以其容积的2/3为宜。
如果太满,沸腾时水将冲至烧瓶。
安全玻管B几乎插到发生器A的底部。
当容器内气压太大时,水可沿着玻管上升,以调节内压。
如果系统发生阻塞,水便会从管的上口喷出。
此时应检查导管是否被阻塞。
水蒸汽导出管与蒸馏部分导管之间由一T形管相联结。
T形管用来除去水蒸气中冷凝下来的水,有时在操作发生不正常的情况下,可使水蒸气发生器与大气相通。
蒸馏的液体量不能超过其容积的1/3。
水蒸气导入管应正对烧瓶底中央,距瓶底约8~10mm,导出管连接在一直形冷凝管上。
见上图2.基本操作在水蒸气发生瓶中,加入约占容器2/3的水,待检查整个装置不漏气后,旋开T形管的螺旋夹,加热至沸。
当有大量水蒸气产生并从T形管的支管冲出时,立即旋紧螺旋夹,水蒸气便进入蒸馏部分,开始蒸馏。
在蒸馏过程中,通过水蒸气发生器安全管中水面的高低,可以判断水蒸气蒸馏系统是否畅通,若水平面上升很高,则说明某一部分被阻塞了,这时应立即旋开螺旋夹,然后移去热源,拆下装置进行检查(通常是由于水蒸气导入管被树脂状物质或焦油状物堵塞)和处理(思考题7)。
如由于水蒸气的冷凝而使蒸馏瓶内液体量增加,可适当加热蒸馏瓶。
但要控制蒸馏速度,以2~3滴为宜,以免发生意外。
当馏出液无明显油珠,澄清透明时,便可停止蒸馏。
其顺序是先旋开螺旋夹,然后移去热源,否则可能发生倒吸现象。
2. 实验步骤:1. 安装实验装置应按从左到右,从上至下,横看一条线,竖看一个面的规则进行。
(烧瓶内先装好一半容量的水),安全瓶浸入水面以下,空气导管的末端保证在液面以下,打开水龙头,通入冷却水。
安装好实验装置后,为了安全要检查实验装置是否阻塞或漏气。
2. 用量筒量取20mL 苯胺装入三颈烧瓶中,后用空心塞塞好。
3. 用酒精灯加热圆底烧瓶,启动水蒸气发生装置。
4. 当有水蒸气通过T型管时,将弹簧夹夹于T型管下端,使水蒸气均匀地进入三颈烧瓶。
5. 当接液管内流出的液体澄清(三颈烧瓶中油滴少量)即可结束蒸馏。
记录温度计读数。
然后打开弹簧夹,熄灭酒精灯。
6.关闭冷凝水后,再从右往左,从上往下的顺序将装置拆除。
7. 将锥形瓶中的液体再用梨形分液漏斗进行分离,然后量取苯胺的体积。
8. 整理实验台面。
结束实验。
七.实验注意事项:1.注意安全;严格按实验装置图安装实验仪器。
2.在水蒸气发生器与盛物的圆底烧瓶之间应装上一个T形管,在T形管下端连一个弹簧夹,以便及时除去冷凝水。
另外,在蒸馏需要中断或蒸馏完毕后,一定要先打开弹簧夹使通大气,然后方可仃止加热,否则,圆底烧瓶中的液体会产生倒流现象。
3.在蒸馏过程中,时刻注意安全管中的水位变化。
如发现安全管中的水位迅速上升,则表示系统中发生了堵塞。
此时应立即打开螺旋夹,然后移去热源,待排除了堵塞后再继续进行水蒸气蒸馏。
4.注意各盛物器中物质的量。
水蒸气发生器盛水量以其容积的3/4为宜。
蒸馏部分的圆底烧瓶不宜超过其容积的1/3。
5.安装正确,连接处严密。
6.调节火焰,控制蒸馏速度2~3 d/s,并时刻注意安全管。
7.停火前必须先打开螺旋夹,然后移去热源,以免发生倒吸现象。
8.按安装相反顺序拆卸仪器。
八.实验相关內容:1、水蒸气蒸馏的适用对象和使用条件:水蒸汽蒸馏是用来分离和提纯液态或固态有机化合物的水蒸气蒸馏适用于从焦油状混合物及树脂样混合物中提取较低沸点物质,也常用于从动植物组织中提取有机物,如植物精油的提取等。
使用水蒸气蒸馏必须满足三个条件:1.被蒸馏物不与水发生化学反应;2.在接近100°C时被提取物有一定的蒸气压;3.被提取物在水中不溶或难溶。
在馏出液冷却后,不溶于水的提取物与水分层,借助分液漏斗可以将其从水中分出。
对一些在水中略有溶解的化合物或有形成乳浊液倾向的物系,为减少损失,可以辅以盐析或加入有机溶剂萃取等方法将其尽可能多地从水中离析出来如果两种液体物质彼此互相溶解的程度很小以至可以忽略不计,就可以视为是不互溶混合物。
在含有几种不互溶的挥发性物质混合物中,每一组分i 在一定温度下的分压p i等于在同一温度下的该化合物单独存在时的蒸气压p i0 :p i=p i0而不是取决于混合物中各化合物的摩尔分数。
这就是说该混合物的每一组分是独立地蒸发的。
这一性质与互溶液体的混合物(即溶液)完全相反,互溶液体中每一组分的分压等于该化合物单独存在时的蒸气压与它在溶液中的摩尔分数的乘积[Raoult定律]。
根据Dalton定律,与一种不互溶混合物液体对应的气相总压力p总等于各组成气体分压的总和,所以不互溶的挥发性物质的混合物总蒸气压如方程式所示:p总= p1+ p2+ ……+ p i从上式可知任何温度下混合物的总蒸气压总是大于任一组分的蒸气压,因为它包括了混合物其它组分的蒸气压。
由此可见,在相同外压下,不互溶物质的混合物的沸点要比其中沸点最低组分的沸腾温度还要低。
图1表示水(bp100°C)和溴代苯(bp156°C)这二个不互溶混合物的蒸气压对温度的关系曲线。
混合物约在95°C 左右沸腾,即在该温度时总蒸气压等于大气压。
正如理论上预见的,此温度低于这个混合物中沸点最低的组分-水的沸点。
由于水蒸汽蒸馏可以在100°C 或更低温度下进行蒸馏操作,对于那些热稳定性较差和高温下要分解的化合物的分离,是一种有效的方法。
水蒸汽蒸馏中冷凝液的组成由所蒸馏的化合物的分子量以及在此蒸馏温度时它们的相应蒸气压决定。
两个不互溶组分A、B的混合物,假如把A和B的蒸气当作理想气体,就可应用理想气体定律,得到下列关系:对于水和溴苯的混合物,在95°C时溴代苯和水的混合物蒸气压分别为p溴苯= 120毫米汞柱和p水= 640毫米汞柱,分子相对质量分别为M溴苯=157、M水= 18,其馏出液的组成可从方程式(1)计算获得:W溴苯: W水= 120×157÷( 640×18) = 1.635由此,在馏出液中,溴苯的质量分数为1.635÷( 1+ 1.635 )×100 % = 62 % 。