药品研发流程图
- 格式:pdf
- 大小:475.25 KB
- 文档页数:4

详解原料药研发的基本流程和原料药备案流程图工艺路线的开发阶段1. 工艺路线的选择质量源于设计,不同的工艺路线导致API的杂质谱会有较大的区别。
故在工艺路线开发阶段,需要对路线全面的工艺分析(反应条件是否苛刻,是否用到有毒物料)。
对不同的工艺路线,分析每个反应步骤的反应机理,后处理方案等,对工艺路线的杂质谱有一个大致的判断。
综合分析,确定拟开发的工艺路线。
然后,根据注册申报指导原则要求,确定工艺路线的起始原料,并结合文献设计关键起始原料对API质量影响的控制策略。
2. 工艺路线摸索(打通工艺阶段)1) 反应设计工欲善其事,必先利其器。
在开始工艺摸索之前,我们要比较全面的了解原料,试剂,溶剂,催化剂及各中间体的物理化学性质。
例如, 化合物的溶解度,为选择适宜的反应介质提供了参考。
根据化合物的化学性质,结合反应的机理,我们可以在理论上分析反应过程中的物料平衡,副反应。
对副产物、副反应产物--杂质,做到心中有数,为后处理设计提供思路和依据。
2) 后处理设计后处理的目的, 一般原则就是尽可能的得到纯度较高的主产物。
一个好的后处理方法,能使主产物和副产物、杂质有效的分离。
后处理设计的关键是利用主产物与副产物、杂质之间的物理化学性质差异,分离纯化得到较高纯度的主产物。
中间体的纯度,直接影响API的质量(含量、有关物质、溶残、重金属以及炽灼残渣等)。
3) 在打通工艺阶段,我们还需要完成以下的研究工作:(1)分析部门开发初步的分析方法。
(2)工艺杂质研究除了中间体、降解杂质,工艺杂质往往是杂质研究中的重中之重。
合成部门在此阶段,通过实验,发现主要的工艺杂质,并结合文献,实验数据,分析判断产生主要工艺杂质的关键工艺步骤和关键工艺参数。
判断关键的工艺杂质,经验告诉我们:关注HPLC 上主峰之后的杂质。
HPLC上主峰之前的杂质,通过重结晶的方式,都能比较容易的有效除去;而主峰之后的一些杂质,很难通过重结晶的方式有效的除去。
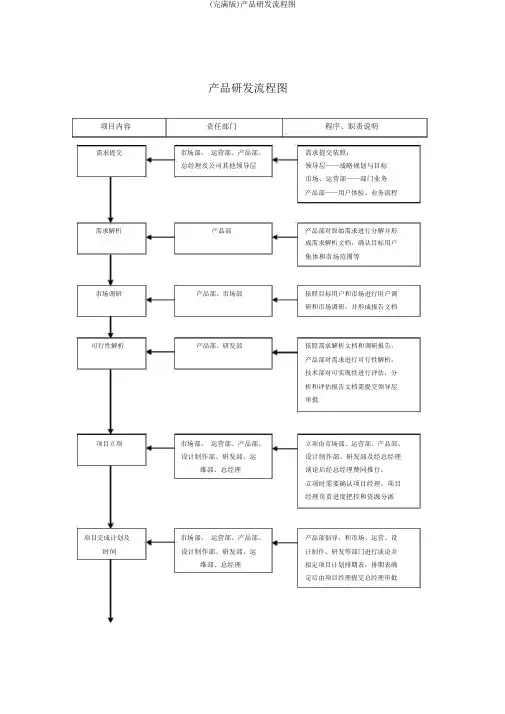
产品研发流程图项目内容责任部门程序、职责说明需求提交市场部、运营部、产品部、总经理及公司其他领导层需求提交依照:领导层——战略规划与目标市场、运营部——部门业务产品部——用户体验、业务流程需求解析产品部产品部对原始需求进行分解并形成需求解析文档,确认目标用户集体和市场范围等市场调研产品部、市场部依照目标用户和市场进行用户调研和市场调研,并形成报告文档可行性解析产品部、研发部依照需求解析文档和调研报告,产品部对需求进行可行性解析,技术部对可实现性进行评估,分析和评估报告文档需提交领导层审批项目立项市场部、运营部、产品部、设计制作部、研发部、运维部、总经理立项由市场部、运营部、产品部、设计制作部、研发部及经总经理谈论后经总经理赞同推行。
立项时需要确认项目经理,项目经理负责进度把控和资源分派项目完成计划及时间市场部、运营部、产品部、设计制作部、研发部、运维部、总经理产品部倡导,和市场、运营、设计制作、研发等部门进行谈论并拟定项目计划排期表,排期表确定后由项目经理提交总经理审批项目经费估量市场部、运营部、产品部、研发部、运维部、总经理各部门提交部门相关项目估量,由项目经理汇总后提交总经理审批产品策划产品部产品部依照需求解析和可行性分析文档,完成产品策划文案提交需求部门和项目经理审察需求文档及产品原型产品部依照经过的产品策划文案,产品部进行需求文档撰写,同时进行产品原型规划。
需求文档和产品原型完成后提交需求部门和项目经理审察UI 设计产品部、设计制作部设计制作部依照从前确认的原型进行 UI 设计,由产品部进行首次确认后,需求部门和项目经理进行二次确认审察交互设计、页面产品部、设计制作部、研设计制作部依照已确认的UI 稿进重构及前端开发发部行重构工作,尔后对重构完成的静态页面进行交互和前端功能开发,工作完成后由项目经理确认产品开发产品部、研发部详尽的研发计划、任务及推行过程由研发部自主安排,产品部进行跟进和功能确认,项目经理协调资源及跟进进度测试产品部、研发部研发部手下测试部门进行黑盒及白盒测试,其中黑盒测试的部分工作可有产品部协调运营部门联合进行。

药品生产典型工艺流
程框图
常见药品生产典型工艺流程框图
药品生产对环境的洁净等级要求与药品的品种、剂型和生产特点有关。
常见药品生产的典型工艺流程及环境区域划分如图1-1至图1-9。
图1-1 非无菌原料药精制、干燥、包装工艺流程框图及环境区域划分
图1-2 无菌原料药精制、干燥、包装工艺流程框图及环境区域划分
图1-3 片剂生产工艺流程框图及环境区域划分
图1-4 硬胶囊剂生产工艺流程框图及环境区域划分
图1-5 压制法软胶囊剂生产工艺流程框图及环境区域划分
图1-6 可灭菌小容量注射剂生产工艺流程框图及环境区域划分
图1-7 可灭菌大容量注射剂生产工艺流程框图及环境区域划分
图1-8 注射用无菌分装产品生产工艺流程框图及环境区域划分
图1-9 注射用冷冻干燥制品生产工艺流程框图及环境区域划分。




新产品开发流程图
1.对市场进行详细系统的分析,确定研发产品类型、规格参数、性能指标、安全性能等信息
2.新产品研发的可行性评估
2.1 上级领导审批通过后,产品研发小组对相关产品情况进行调查;可行性分析、预测;总结、编写可行性研究报告
2.2 《可行性研究报告》上报上级领导,审批 OK后正式进入产品的研发阶段
3.形成产品设计方案
根据审批通过的产品《可行性研究报告》,产品研发小组编制《产品设计方案》
4.确定最终产品设计方案
4.1 市场部、研发部会同生产部从产品可行性、生产技术性、技术来源方面对产品进行评估、筛选出适合的方案
4.2 根据最终选出的《产品设计方案》确定产品设计投入,并进行综合比较,确定最终的《产品设计方案》,并进行项目立项,制定出《新产品开发进度时间表》
5.产品设计
根据确定的《产品设计方案》产品,开发小组成员进行产品设计、绘制产品设计相关图纸及产品的测试检验标准
6.样品试制、测试
6.1 产品设计图纸经过项目负责人审批通过后,可进入样品试制阶段,准备样品制造所需的材料等
6.2 样品试制完成后,对其进行性能检测,并保存测试报告,对于不合格的样品设计不合理的地方进行修改,并重新进行样品试制
7.投入批量生产
对产品进行鉴定,合格后将产品研发设计的相关资料进行保存并发行,再投入批量生产
新产品开发流程图
制定:审核:批准:
第3页,共3页。

新药研究开发与上市流程图人们生活水平提高要求更多更好的新药,药物科学的发展为新药开发提供了理论基础和技术,市场经济竞争也促进了新药快速发展。
美国食品与药物管理局(FDA)近十年来每年批准上市的新药都在20种以上。
我国近年来引进新药品种很多,但需要加快创新。
新药开发是一个非常严格而复杂的过程,各药虽然不尽相同,药理研究却是必不可少的关键步骤。
临床有效的药物都具有相应的药理效应,但具有肯定药理效应的药物却不一定都是临床有效的药物。
例如抗高血压药都能降低血压,但降压药并不都是抗高血压药,更不一定是能减少并发症、延长寿命的好药。
因此新药开发研究必需有一个逐步选择与淘汰的过程。
为了确保药物对病人的疗效和安全,新药开发不仅需要可靠的科学实验结果,各国还对新药生产上市的审批与管理制定了法规,对人民健康及工商业经济权益予以法律保障。
新药来源包括天然产物、半合成及全合成化学物质。
过去选药主要方法是依靠实践经验,现在可以根据有效药物的植物分类学找寻近亲品种进行筛选或从有效药物化学结构与药理活性关系推断,定向合成系列产品,然后进行药理筛选。
近年来对于机体内在抗病物质(蛋白成分)利用DNA基因重组技术,即将DNA 的特异基因区段分离并植入能够迅速生长的细菌或酵母细胞,以获得大量所需蛋白药物。
此外,还可对现有药物进行化学结构改造(半合成)或改变剂型,也可获得疗效更好,毒性更小或应用更方便的药物。
医学教育网搜集整理新药研究过程大致可分三步,即临床前研究、临床研究和售后调研。
临床前研究包括用动物进行的系统药理研究及急慢性毒性观察。
对于具有选择性药理效应的药物,在进行临床试验前还需要测定该药物在动物体内的吸收、分布及消除消除过程。
临床前研究是要弄清新药的作用谱及可能发生的毒性反应。
在经过药物管理部门的初步审批后才能进行临床试验。
目的在于保证用药安全。
临床研究首先在10~30例正常成年志愿者观察新药耐受性,找出安全剂量。
再选择有特异指征的病人按随机分组、设立已知有效药物及空白安慰剂双重对照(对急重病人不得采用有损病人健康的空白对照),并尽量采用双盲法(病人及医护人员均不能分辨治疗药品或对照药品)观察,然后进行治疗结果统计分析,客观地判断疗效。

Quality Management System 文件制订/变更申请单O-053F1.目的落实新产品开发设计之作业流程管制,确保其设计结果能符合客户及公司对品质之要求。
2.范围凡本移动通讯事业群新产品之开发设计案均属之。
3.名词解释3.1 PM:产品经理3.2 MRS:Marketing Requirement Spec3.3 PDS(Product Development Schedule):新产品开发进度3.4 BOM(Bill of Material):材料构成表3.4.1 E-BOM:研发阶段初期之零件表。
不能用于正式生产.3.4.2 M-BOM:研发成熟后,将用于产线生产使用之零件表。
3.5 Kick Off Meeting:设计开发案启动会议3.6 FTA(Full Type Approval):产品认证3.7 ES(Evaluation Specification):提案及市场/客户需求分析、研发计划申请阶段3.8 EV(Evaluation Validation):产品概念发展、设计规划及设计雏型阶段3.9 DV(Design Validation):研发样品、工程试作阶段3.10 PV(Production Validation):量试阶段3.11 MP(Mass Production):量产阶段3.12 EVT 1.x:PCBA样品、手工样品、CNC样品试作代号(通信基本功能、外观参考用)3.13 DVT 2.x:新产品设计验证试作代号(正式模具品Soft/Hard T ooling、全功能验证、研发技转确认产线)3.14 PVT 3.x:产品小量量产验证试作代号(确认制程&良率)4.管理重点:4.1 产品概念发展/设计规划阶段(ES):4.1.1 提案客户产品之开发构想,由产品规划人员提出开发案申请。
4.1.2 市场/客户需求分析:(A)市场信息,销售预计(B)成本预估(C)必要时合同审查之结果(D)国际或国家法规4.1.3 可行性分析:视产品需求,可由产品规划人员主导进行市场分析及技术可行性分析(RD),客制化的专案项目的市场可行性分析可由客户承担4.1.4 提出产品规格书及专案计划:PM依据『MRS』与Project Team人员共同研讨各项设计需求,(A) 项目组织结构:(1)每一新产品研发项目需指派PM 负责整个计划之推动。