硫酸的理化性质及危险特性
- 格式:doc
- 大小:33.50 KB
- 文档页数:2



硫酸的理化性质及危险特性
硫酸(化学式:H2SO4)是一种无色、无味的液体,常见的是
浓硫酸,具有高度的腐蚀性。
下面是硫酸的主要理化性质及危险特性:
1. 密度:硫酸的密度约为1.84 g/cm³,具有较大的密度。
这意
味着硫酸比水更重,需要小心使用和储存,以防止泄漏和事故发生。
2. 溶解性:硫酸是一种强酸,能够与大部分物质反应,包括金属、氧化物和碱。
它在水中溶解能力强,可与水反应生成大量的热量,需要注意加入硫酸时要缓慢而小心。
3. 腐蚀性:浓硫酸具有很高的腐蚀性,能够腐蚀金属和许多有
机物质。
接触硫酸可能导致严重的灼伤,并产生有毒的气体。
在操
作硫酸时,需要佩戴适当的防护设备,如手套、护目镜和防护服。
4. 危险特性:硫酸是一种具有危险性的物质。
它能够引起严重
的眼和皮肤损伤,对呼吸道和消化系统也具有刺激和腐蚀作用。
在
使用硫酸时,需要严格遵守相关法规和安全操作规程,以防止事故
和人身伤害的发生。
5. 环境影响:硫酸对环境也有一定的影响。
在处理硫酸废液时,应遵守相关环保法规,采取适当的处理措施,以防止对水体和土壤
的污染。
这些是硫酸的主要理化性质及危险特性。
在使用硫酸时,务必
要小心操作,遵循安全规程,确保人身安全和环境保护。

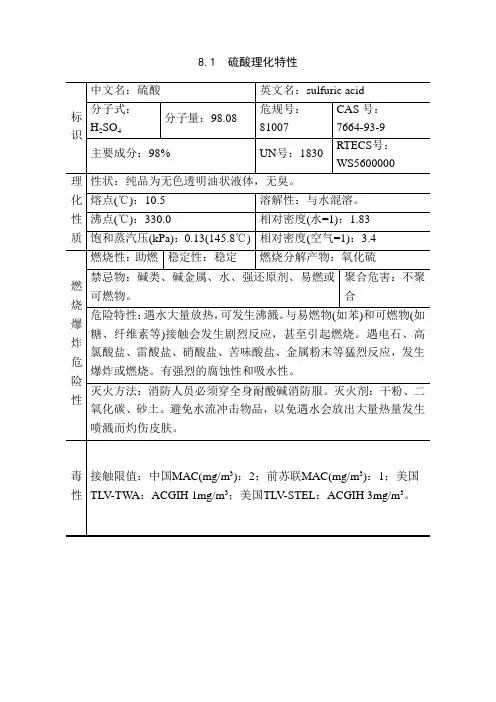
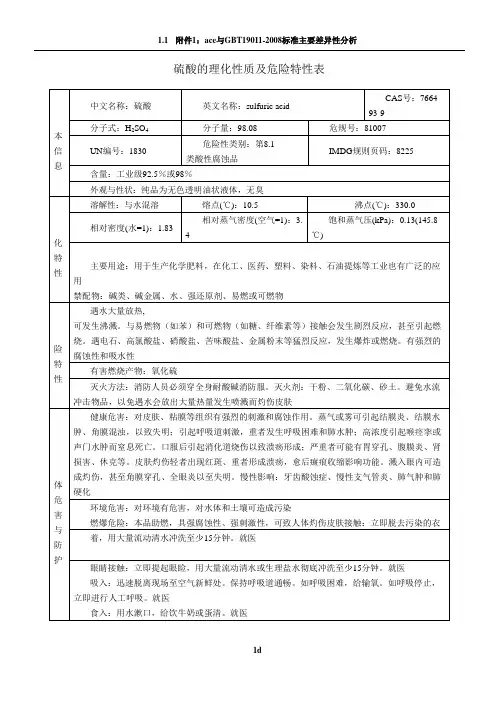
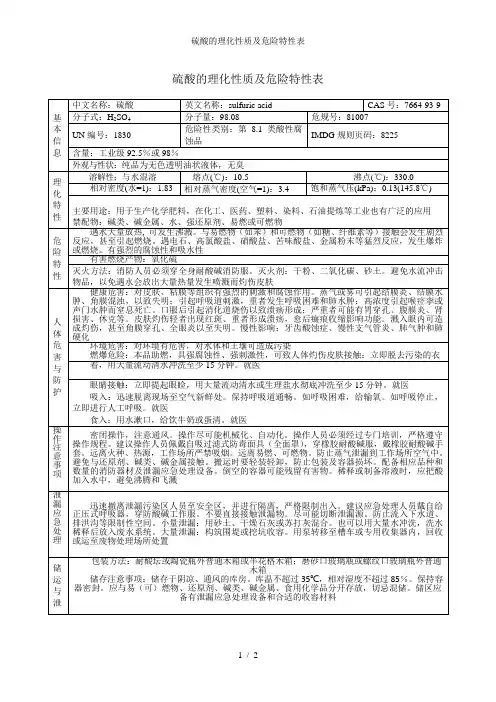
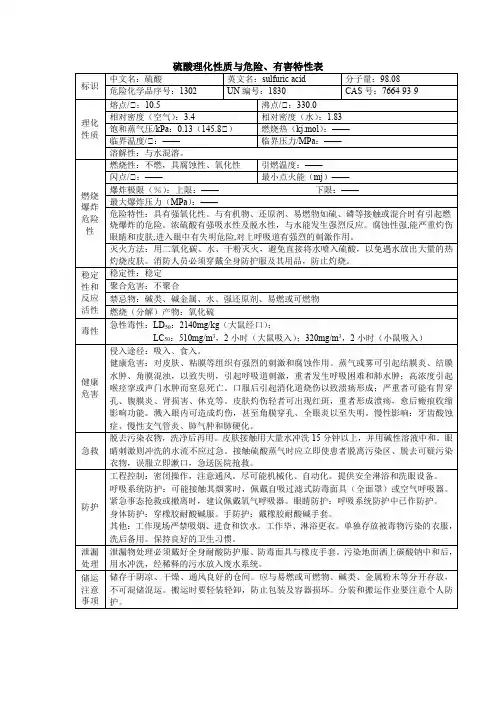
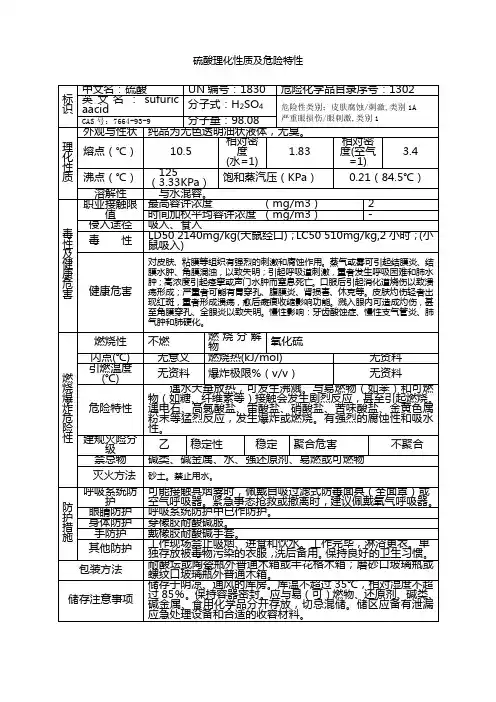
8.1 硫酸理化特性标识中文名:硫酸英文名:sulfuric acid分子式:H2SO4分子量:98.08危规号:81007CAS号:7664-93-9 主要成分:98% UN号:1830RTECS号:WS5600000理化性质性状:纯品为无色透明油状液体,无臭。
熔点(℃):10.5 溶解性:与水混溶。
沸点(℃):330.0 相对密度(水=1):1.83 饱和蒸汽压(kPa):0.13(145.8℃) 相对密度(空气=1):3.4燃烧爆炸危险性燃烧性:助燃稳定性:稳定燃烧分解产物:氧化硫禁忌物:碱类、碱金属、水、强还原剂、易燃或可燃物。
聚合危害:不聚合危险特性:遇水大量放热,可发生沸溅。
与易燃物(如苯)和可燃物(如糖、纤维素等)接触会发生剧烈反应,甚至引起燃烧。
遇电石、高氯酸盐、雷酸盐、硝酸盐、苦味酸盐、金属粉末等猛烈反应,发生爆炸或燃烧。
有强烈的腐蚀性和吸水性。
灭火方法:消防人员必须穿全身耐酸碱消防服。
灭火剂:干粉、二氧化碳、砂土。
避免水流冲击物品,以免遇水会放出大量热量发生喷溅而灼伤皮肤。
毒性接触限值:中国MAC(mg/m3):2;前苏联MAC(mg/m3):1;美国TLV-TW A:ACGIH 1mg/m3;美国TLV-STEL:ACGIH 3mg/m3。
对人体危害对皮肤、粘膜等组织有强烈的刺激和腐蚀作用。
蒸气或雾可引起结膜炎、结膜水肿、角膜混浊,以致失明;引起呼吸道刺激,重者发生呼吸困难和肺水肿;高浓度引起喉痉挛或声门水肿而窒息死亡。
口服后引起消化道烧伤以致溃疡形成;严重者可能有胃穿孔、腹膜炎、肾损害、休克等。
皮肤灼伤轻者出现红斑、重者形成溃疡,愈后癍痕收缩影响功能。
溅入眼内可造成灼伤,甚至角膜穿孔、全眼炎以至失明。
慢性影响:牙齿酸蚀症、慢性支气管炎、肺气肿和肺硬化。
急救皮肤接触:立即脱去污染的衣着,用大量清水彻底冲洗至少15分钟。
就医。
眼睛接触:立即提起眼睑,用大量流动清水或生理盐水彻底冲洗至少15分钟。

硫酸的主要理化和危险特性硫酸是一种常见的无机酸,其化学式为H2SO4。
它是一种无色、无臭、有强烈腐蚀性的液体,通常在实验室和工业中使用。
在本文中,我们将探讨硫酸的主要理化和危险特性。
1. 硫酸的物理和化学性质硫酸是一种高度亲水的液体,其密度大约为1.84克/毫升,沸点为337℃,熔点为10℃。
它是一种高度酸性的液体,可以与大多数物质反应。
在水中很容易溶解,是一种十分重要的化学品。
硫酸是一种双酸,它可以和水反应,产生一定的热量。
这是因为硫酸的离子化程度较高,可以快速释放出H+离子,与水中的OH-离子结合,形成H3O+离子。
这个过程称为自离解反应,化学方程式如下:H2SO4 + H2O ⇆ H3O+ + HSO4-HSO4- + H2O ⇆ H3O+ + SO42-在实验室和工业中,硫酸常用作强酸,用于提纯、脱水和酸性反应。
例如,硫酸可以用于制造硝酸和某些磷酸盐。
它还可以用于处理废水、制造肥料、提取精炼金属和制造化学品等应用方面。
2. 硫酸的危险特性尽管硫酸在实验室和工业中有很多应用,但它的使用也存在危险性。
硫酸腐蚀性很强,可能会对皮肤和眼睛造成严重灼伤。
当硫酸泼溅到皮肤上时,会迅速吸收水分,引起局部脱水和淤血,导致严重的疼痛和灼伤。
在吸入硫酸蒸气时,也会造成呼吸道刺激和感染,在短时间内可能会出现窒息和死亡。
在使用硫酸时,必须采取必要的防护措施。
例如,必须在通风良好的地方使用,并穿戴合适的防护衣、手套和眼镜等。
在使用后必须及时清洗洗手、更衣和防护设备。
此外,硫酸也有一些环境影响。
由于它是一种强酸,如果排入水体或土壤中,会对周围环境造成污染和破坏。
因此,必须采取适当的处理和处置方法,以最大限度地减少其环境影响。
3. 总结硫酸是一种常见的无机酸,具有强烈的化学反应性和腐蚀性。
在实验室和工业中,它有很多应用,例如用作强酸、提纯、脱水和酸性反应等。
然而,硫酸也存在危险性,可能会对人体和环境造成严重的损害。
因此,在使用时必须采取必要的防护措施,并在使用后进行适当的处置。
硫酸的主要理化和危险特性硫酸是一种重要的化学物质,在日常生产和生活中广泛应用。
它是一种无色、透明的液体,有着强烈的刺激性气味和酸味。
硫酸是强酸之一,容易与许多物质反应,所以需要非常小心。
本文将介绍硫酸的主要理化和危险特性。
一、硫酸的理化特性1、化学式:H2SO4。
2、分子量:98.076。
3、相态:在室温下为无色、透明液体,密度较大。
4、熔点:10.4℃。
5、沸点:338℃。
6、水溶性:易溶于水,水溶液有强酸性,可以腐蚀金属和织物。
7、物理性质:具有强烈的腐蚀性,会引起皮肤和眼睛的刺痛和严重的灼伤。
此外,硫酸还有高度的挥发性,能够刺激肺部和呼吸道,长期吸入过量的硫酸蒸气,会引起严重的呼吸道问题。
二、硫酸的危险特性1、腐蚀性硫酸是一种强酸,具有很强的腐蚀性。
它可以腐蚀皮肤和眼睛以及导致人体发生化学灼伤。
一旦硫酸接触到皮肤或眼睛,需要立即进行水冲洗,避免继续伤害。
2、毒性高浓度的硫酸气体对人体有毒性,它会引起呼吸困难、头痛、呕吐等不良症状。
高浓度的硫酸气体会引起严重的呼吸道问题,需要尽快进行急救和治疗。
3、易燃性硫酸有着易燃性,不能与某些物质混合,如草木灰、纸张、有机物质等。
4、环境污染硫酸在生产和处理过程中,会产生大量的二氧化硫,这种气体对环境有很大的危害。
二氧化硫会与其他气体反应,产生酸雨,导致土壤和水质的污染,对环境和人类健康造成很大的伤害。
三、使用硫酸的注意事项1、保持室内通风,保证通风口和排气口畅通。
2、注意个人防护,穿上透气且不易着火的工作服,并佩戴防护眼镜和口罩。
3、禁止直接与皮肤或眼睛接触,一旦发生接触,需要立即用清水冲洗10-15分钟,并就医处理。
4、存储在干燥通风的地方,远离强酸、碱和易燃物。
5、在使用和处理过程中,需要严格按照安全操作规程,以避免发生意外或化学事故。
总之,硫酸是一种非常重要的化学物质,但也具有强烈的腐蚀性和毒性。
在使用和处理硫酸的过程中,我们应该保持高度警惕,妥善处理废弃物、尽快清除泄漏,并进行安全操作。