高中化学第一章认识化学科学`第一节《走进化学科学》知识点鲁科版必修
- 格式:doc
- 大小:1.41 MB
- 文档页数:35

第一章认识化学科学知识概要(一) 走进化学科学化学:就是在原子、分子水平上研究物质的组成、结构、性质、变化、制备和应用的自然科学。
化学的特征是认识分子和制造分子。
(1)化学是具有创造性、实用性的科学(3)化学科学的探索空间(二)研究物质性质的方法和程序(1)研究物质性质的基本方法观察法:是一种有计划、有目的地用感官考察研究对象的方法。
实验法:通过实验来验证对物质性质的预测或探究物质未知性质的方法。
分类法:分门别类地对物质及其变化进行研究,可以总结出各类物质的通性和物性。
比较法:运用比较的方法,可以找出物质性质间的异同,认识物质性质间的内在联系,对物质的性质进行归纳和概括。
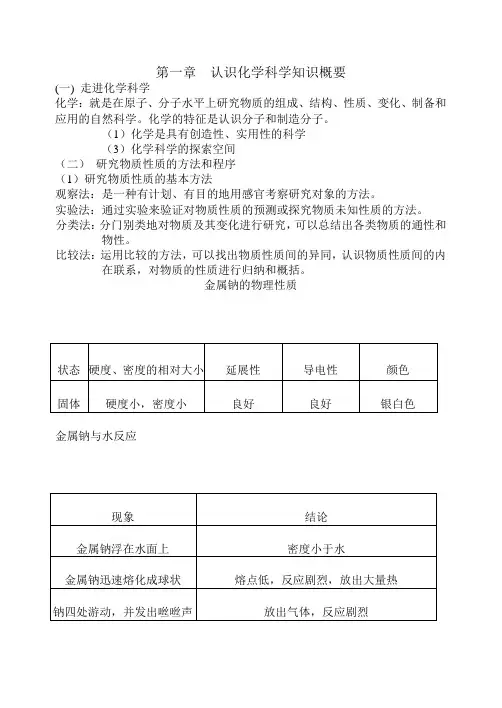
金属钠的物理性质金属钠与水反应总结:2Na + 2H2O == 2NaOH + H2↑钠与氧气反应以上实验说明,金属钠是一种银白色的轻、软金属。
是一种活泼金属。
[补充知识]钠的氧化物的性质:钠有两种氧化物,氧化钠(Na2O)和过氧化钠(Na2O2)。
其中,氧化钠为白色固体,过氧化钠为淡黄色固体。
过氧化钠(Na2O2)的性质:2Na2O2 + 2H2O == 4NaOH + O2↑2Na2O2 + 2CO2 === 2Na2CO3 + O2氧化钠的性质:Na2O+ H2O ==2NaOH(2) 研究物质性质的基本程序人们对物质性质的研究就是一种科学探究的过程。
其一般程序:①通常首先要观察物质的外观,了解物质的存大状态、颜色、气味等;②其次,要通过实验来探究物质的有关性质。
进行实验时,往往要对物质性质进行预测,设计并实施实验来验证所做的预测;③然后,通过对实验现象的观察和分析,归纳出与预测一致的性质,并对实验中出现的特殊现象进行进一步的研究。
总之,在研究过程中,预测性质、设计实验、观察现象以及对实验现象进行分析和解释、对实验结论进行整合,都是非常重要环节。
关于研究物质性质的基本程序可表示为。
认识氯气的物理性质氯气不仅能溶于水,还能与水发生反应,生成盐酸和次氯酸。


第一节 走进化学科学【化学定义】化学科学就是在原子、分子的水平上研究物质的组成、结构、性质、变化、制备和应用的自然科学。
(原子核变化不属于化学研究范畴)【化学的特点】实用性和创造性。
【化学的特征】认识分子和制造分子。
【化学的发展简史】远古时代,从人们开始知道了如何取火和保存火种时,就可以说人类开始了化学实践活动。
长期的生产和实践活动中,人们学会了烧制陶瓷、冶炼金属、酿造酒类等。
1661年,英国化学家、物理学家波义耳提出化学元素的概念,标志着近代化学的诞生。
1771年,法国化学家拉瓦锡建立燃烧现象的氧化学说,使近代化学取得了革命性的进展。
1803年,英国化学家、物理学家道尔顿提出原子学说,为近代化学的发展奠定了坚实的基础。
1869年,俄国化学家门捷列夫发现元素周期律,把化学元素及其化合物纳入一个统一的理论体系。
【探索空间】能源方面,材料科学,环境保护,疾病治疗。
第二节 研究物质的基本方法和程序一、 研究物质性质的方法和程序【基本方法】观察法、实验法、分类法、比较法【基本程序】第一步:观察物质的外观;第二步:预测物质的性质;第三步:观察和实验;第四步:解释和结论。
二、 钠及其化合物的性质:钠Na:银白色的金属;熔点低、密度小(0.97g·cm-3)、硬度小、延展性好。
【钠与空气反应】①钠在空气中缓慢氧化:4Na+O ₂=2Na ₂O 现象:银白色金属表面迅速变暗 ②钠在空气中燃烧:2Na+O2=====△Na ₂O ₂现象:熔成小球,发出黄色火焰,生成淡黄色粉末 故钠应该保存在煤油中。
注意:氧化钠Na ₂O :白色固体;过氧化钠Na ₂O ₂:淡黄的固体(高中所学淡黄色固体只有Na ₂O ₂和单质S )过氧化钠可以用作呼吸面具和潜水艇里氧气的来源。
思考:如果钠粘在烧杯壁上,很快就燃烧起来,为什么?1.过氧化钠与水反应:2Na ₂O ₂+2H ₂O = 4NaOH+O ₂↑2.过氧化钠与二氧化碳反应:2Na ₂O ₂+2CO ₂= 2 Na ₂CO ₃+O ₂钠的用途(1)K —Na 合金用于原子反应堆作导热剂。

第一章认识化学科学第一节认识化学科学知识点1化学科学的形成与发展1.古代化学东方:烧制陶器、冶金、酿酒及炼丹术西方:炼金术2.近代化学1661年,波义耳提出化学元素概念,标志着近代化学的诞生.1777年,拉瓦锡提出氧化学说。
1803年,道尔顿提出原子论为近代化学淡定基础。
1811年,阿伏伽德罗提出分子学说,系统解决了在物质组成和原子量测定方面的混乱问题。
1811年,门捷列夫发现元素周期律,把化学元素及其化合物纳入一个统一的理论体系。
3.现代化学人们对化学物质世界的认识,由宏观到微观,由定性到定量,由静态到动态不断认识,发现了放射性元素,建立量子化学等分支学科。
带动生物等其他学科的发展,1965年我国科学家合成结晶牛胰岛素。
知识点2化学科学的主要特征化学是在原子、分子水平上研究物质的组成、结构、性质、转化及其应用的一门基础学科,其特征是从宏观和微观两个角度认识物质、以符号形式表征物质、在不同层面上创造物质。
青蒿素提取过程:提取有效成分获得晶体确定组成测定结构合成修饰广泛应用知识点3化学科学的探索空间现在化学家已经能在微观层面操纵分子和原子了,组装分子材料,分子器件和分子机器等。
分子齿轮,石墨烯修饰等。
第二节研究物质性质的方法和程序知识点1研究物质的基本方法常用观察、实验、分类、比较等方法,可以观察物质的颜色、状态、气味,观察需要有计划有目的的观察。
1.钠的物理银白色固体,质软,能用小刀切割,密度小于水大于煤油,常保存在煤油中。
2.钠的化学性质①钠与空气中氧气反应4Na+O2=2Na2O2Na+O2点燃Na2O2②钠与水反应2Na+2H2O=2NaOH+H2↑(钠与水反应的现象:浮、熔、游、嘶、红)③钠与氯气、硫等非金属反应Cl2 +2Na 点燃2NaCl(火焰呈黄色,白烟)2Na+S=Na2S(研磨或加热)④钠与盐溶液的反应钠先与水反应生成氢氧化钠和氢气,氢氧化钠再与盐溶液发生反应。
3.钠的氧化物知识点2研究物质性质的基本程序1.氯气的物理性质氯气是一种黄绿色气体,有刺激性气味,有毒,密度比空气大,易液化形成液氯(黄绿色液体),可溶于水(1:2),在工业上用于制造盐酸、有机溶剂和杀菌消毒剂。
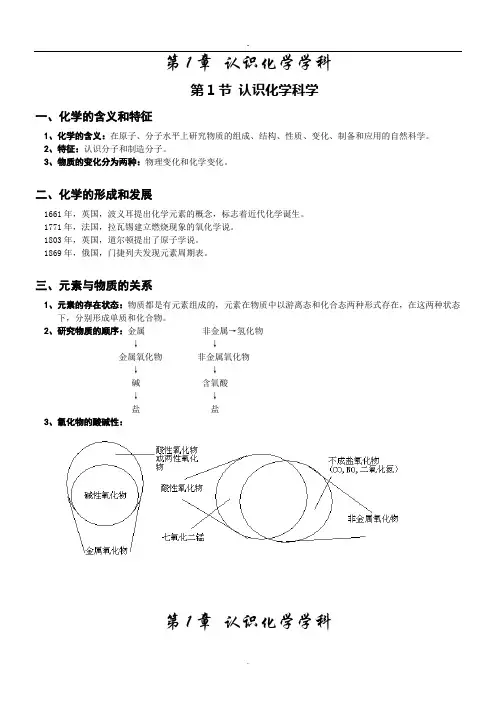
第1章认识化学学科第1节认识化学科学一、化学的含义和特征1、化学的含义:在原子、分子水平上研究物质的组成、结构、性质、变化、制备和应用的自然科学。
2、特征:认识分子和制造分子。
3、物质的变化分为两种:物理变化和化学变化。
二、化学的形成和发展1661年,英国,波义耳提出化学元素的概念,标志着近代化学诞生。
1771年,法国,拉瓦锡建立燃烧现象的氧化学说。
1803年,英国,道尔顿提出了原子学说。
1869年,俄国,门捷列夫发现元素周期表。
三、元素与物质的关系1、元素的存在状态:物质都是有元素组成的,元素在物质中以游离态和化合态两种形式存在,在这两种状态下,分别形成单质和化合物。
2、研究物质的顺序:金属非金属→氢化物↓↓金属氧化物非金属氧化物↓↓碱含氧酸↓↓盐盐3、氧化物的酸碱性:第1章认识化学学科第2节 研究物质性质的方法和程序一、研究物质的基本方法:观察、实验、分类、比较等方法。
(一)Na 的性质1、物理性质:钠是一种银白色金属,熔点为97.8℃,沸点为882.9℃,密度为0.97g/cm 3。
2、化学性质:容易失去一个电子,形成Na +(稳定结构),还原性极强。
(1)与非金属反应:①4Na+O 2====2Na 2O ②2Na+O 2====Na 2O 2 ③2Na+Cl 2====2NaCl④2Na+S==== Na 2S(2)与水反应:2Na+2H 2O====2NaOH+H 2↑现象:浮:Na 浮在水面上;熔:融化成一个小球;游:四处游动;响:发出咝咝响声;红:试液变红。
(3)与酸反应:2Na+2HCl====2NaCl+H 2↑(4)与盐反应:①2Na+2H 2O+CuSO 4====Cu(OH)2↓+Na 2SO 4+H 2↑ ②6Na+6H 2O+2FeCl 3====2Fe(OH)3↓+6NaCl+3H 2↑ ③4Na+TiCl 4(熔融状)高温Ti+4NaCl(5)Na 在空气中的一系列变化:Na −→−2O Na 2O −−→−O H 2NaOH −−−→−O H CO 22,Na 2CO 3·10H 2O −−→−风化Na 2CO 3 4Na+O 2====2Na 2O → Na 2O+H 2O====2NaOH →2NaOH+9H 2O+CO 2====Na 2CO 3·10H 2O → Na 2CO 3·10H 2O 风化Na 2CO 3+10H 2O ↑3、Na 的保存:钠通常保存在煤油或石蜡油中。

化学·必修1(鲁科版)第一章认识化学科学第1节走进化学科学1.知道化学是在原子和分子的基础上认识物质和制备物质的一门科学。
2.了解化学科学的形成和发展,了解化学发展的基本特征和化学发展的趋势。
3.认识化学科学对提高人类生活质量和促进社会发展的重要作用。
知识清单一、化学科学的实用性和创造性1.化学科学。
化学科学是在原子、分子水平上研究物质的组成、结构、性质、变化、制备和应用的自然科学。
研究对象:物质的组成、结构、性质、变化、制备和应用。
研究层次:原子、分子水平。
化学变化中的最小微粒和保持化学性质的微粒分别是什么?答案:原子是化学变化中的最小微粒,分子是保持物质化学性质的一种微粒。
2.学科特征。
(1)创造性的体现:制造自然界中本来就存在的物质、创造自然界不存在的具有特殊性质或功能的新物质,基本能够按照人类社会需求进行设计和制备,改造和支配自然界,创造一个新的物质世界。
化学的特征是认识分子和制造分子。
(2)实用性的体现:合成氨技术、新药物的研制、材料的开发、环境保护、能源的开发和利用。
二、化学科学的形成和发展1.古代化学实践活动:烧制陶瓷、冶炼金属、酿造酒类等。
2.近代化学发展的里程碑。
年代科学家重大发现或成就作用1661年英国科学家波义耳提出化学元素的概念标志着近代化学的诞生(续上表)1771年法国科学家拉瓦锡建立燃烧现象的氧化学说使近代化学取得了革命性的进展1803年英国科学家道尔顿提出原子学说奠定了近代化学发展的基础1869年俄国科学家门捷列夫发现元素周期律把化学元素及其化合物纳入一个统一的理论体系3.辉煌的现代化学时代。
(1)取得了一些重大成就,如放射性元素的发现、现代量子化学理论的建立、创造新分子的合成化学的崛起、高分子化学的创立、化学热力学与动力学的开创研究以及化学工业的迅速发展。
(2)出现了各种分析技术,如X射线、原子吸收光谱、紫外和红外光谱、色谱、质谱、核磁共振等。
(3)带动了生命科学等相关科学的进一步发展。


化学必修一第一章认识化学科学第一节与第二节知识点总结鲁科版化学必修一第一章认识化学科学第一节与第二节知识点总结:第一节:认识化学科学化学科学的起源:1.化学起源于古代的炼金术,追溯到古埃及和美索不达米亚地区。
2.炼金术的目标是将基本金属转变为贵金属,如将铜转变为黄金。
3.随着科学的发展和精密的实验技术的出现,炼金术逐渐转变为化学科学。
化学在工业、农业和生活中的应用:1.工业中的应用:化学工业涉及化学合成、催化、分离、提纯等技术,生产各种化学物质,如化肥、农药、塑料等。
2.农业中的应用:化学肥料可以提供作物所需的营养元素,化学农药可以防治病虫害。
3.生活中的应用:化妆品、洗涤剂、食品添加剂、药品等都是化学产品。
化学与环境保护的关系:1.环境污染:化学物质的大量排放和不当处理会导致水、土壤和大气的污染。
2.环境保护:化学科学可以研发环境友好型的产品和技术,如净化水、废气处理等。
第二节:物质的组成与分类物质的分类:1.纯物质:由同一种化学物质组成的物质。
可分为元素和化合物。
-元素:由一个种类的原子组成,不能被化学方法分解为其他物质。
-化合物:由两种或更多种元素以一定的比例结合而成,可以被化学方法分解为其他物质。
2.混合物:由两种或多种物质按一定比例混合而成,可以通过物理方法分离。
物质的性质:1.物理性质:不改变物质本质的性质,如颜色、形状、密度、熔点、沸点等。
2.化学性质:描述了物质与其他物质发生化学反应时的性质,如可燃性、与酸碱反应等。
元素的分类:1.金属元素:大多数元素都是金属,具有良好的导电性、导热性和延展性。
2.非金属元素:少数元素是非金属,一般具有较差的导电性、导热性和脆性。
3.半金属元素:具有介于金属和非金属之间的一些性质。
元素的符号和元素周期表:1.每个元素都有一个唯一的符号表示,由一个或两个拉丁字母组成。
2.元素周期表是一个按元素的原子序数排列的表格,可以分类和归纳元素的性质。
化合物的命名和表示:1.无机化合物:一般采用离子符号表示,阳离子在前,阴离子在后,中间用“-”连接。


第一节 走进化学科学【化学定义】化学科学就是在原子、分子的水平上研究物质的组成、结构、性质、变化、制备和应用的自然科学。
(原子核变化不属于化学研究范畴)【化学的特点】实用性和创造性。
【化学的特征】认识分子和制造分子。
【化学的发展简史】远古时代,从人们开始知道了如何取火和保存火种时,就可以说人类开始了化学实践活动。
长期的生产和实践活动中,人们学会了烧制陶瓷、冶炼金属、酿造酒类等。
1661年,英国化学家、物理学家波义耳提出化学元素的概念,标志着近代化学的诞生。
1771年,法国化学家拉瓦锡建立燃烧现象的氧化学说,使近代化学取得了革命性的进展。
1803年,英国化学家、物理学家道尔顿提出原子学说,为近代化学的发展奠定了坚实的基础。
1869年,俄国化学家门捷列夫发现元素周期律,把化学元素及其化合物纳入一个统一的理论体系。
【探索空间】能源方面,材料科学,环境保护,疾病治疗。
第二节 研究物质的基本方法和程序一、 研究物质性质的方法和程序【基本方法】观察法、实验法、分类法、比较法【基本程序】第一步:观察物质的外观;第二步:预测物质的性质;第三步:观察和实验;第四步:解释和结论。
二、 钠及其化合物的性质:钠Na:银白色的金属;熔点低、密度小(0.97g·cm-3)、硬度小、延展性好。
【钠与空气反应】①钠在空气中缓慢氧化:4Na+O ₂=2Na ₂O 现象:银白色金属表面迅速变暗 ②钠在空气中燃烧:2Na+O2=====△Na ₂O ₂现象:熔成小球,发出黄色火焰,生成淡黄色粉末 故钠应该保存在煤油中。
注意:氧化钠Na ₂O :白色固体;过氧化钠Na ₂O ₂:淡黄的固体(高中所学淡黄色固体只有Na ₂O ₂和单质S )过氧化钠可以用作呼吸面具和潜水艇里氧气的来源。
思考:如果钠粘在烧杯壁上,很快就燃烧起来,为什么?1.过氧化钠与水反应:2Na ₂O ₂+2H ₂O = 4NaOH+O ₂↑2.过氧化钠与二氧化碳反应:2Na ₂O ₂+2CO ₂= 2 Na ₂CO ₃+O ₂钠的用途(1)K —Na 合金用于原子反应堆作导热剂。
第一章认识化学科学第一节走进化学科学一.知识点知识点一化学是具有创造性的、实用的科学1.化学科学的涵义化学科学就是在原子、分子水平上研究无知的组成、结构、性质、变化、制备和应用的自然科学。
2.化学是一门有创造性的学科化学科学的特征是认识分子和制造分子。
(1)发现物质:从矿物、岩石以及生物体中发现有用物质,并能进行提取和从已有的物质出发制造出来。
(2)装造物质:能够根据需要,运用物质结构理论、化学反应的规律和现代技术,设计具有特殊性质或功能的新分子,创造出自然界中不存在的物质。
3.化学是一门具有实用性的科学(1)探索生物固氮、新型复合肥料及高效新农药的研制、新能源的开发、材料科学的发现、金属的冶炼、新型合成材料的生产、石油炼制、遗传工程等都需要化学发挥作用。
(2)空间技术、高能物理、计算机等的研究和发展,也需要化学提供各种特殊功能材料。
(3)在人来的生活用品方面,化学也发挥着极大的作用。
(4)由于高分子绝缘材料的性能优越,使电器工业得到飞跃发展,促进了电子计算机、遥控技术、电子、激光等一系列新兴工业的兴起。
(5)高分子还使医疗上有了人工器官,攻克了许多医疗难题。
4.化学的发展—由人事原子、分子到操纵原子、分子在化学科学领域,化学家们可以再微观层面上真正实现操纵分子和原子,组装分子材料、分子器件和分子机器等。
知识点二:化学科学的形成和发展1.近代化学的形成和发展(1)从使用火起,人类就开始了化学实践活动。
之后,人类学会了烧制陶瓷、冶炼金属、酿造酒类,并且渴望炼制出使人长生不老的“仙丹”或把廉价的金属炼制成金。
在这些生产和生活时间的基础上,经过几代化学家的不断努力,逐渐形成了近代化学科学。
(2)近代化学发展的里程碑(主要是从17世纪中叶到20世纪末的著名科学家的重大发现或发明创造对近代化学发展的作用)1661年,英国化学家、物理学家波义耳提出化学元素的概念,标志着近代化学的诞生。
1771年,法国化学家拉瓦锡简历燃烧现象的氧化学说,使近代化学取得了革命性的进展。
高中化学(必修)(鲁科版)上册第一章认识化学科学第1节走进化学科学交流·研讨1. 通过初中化学课程的学习,你对化学有了哪些认识?你能否用简短的几句话或几个词语描述一下你心中的化学?2. 化学和人类生活水平的提高和人类社会的发展密切相关,研究领域十分广泛。
你对化学研究的哪些问题感兴趣?一、化学科学的创造性和实用性化学是一门具有创造性的科学。
化学的特征就是认识分子和制造分子。
化学还是一门在人类生产和生活中有着重要作用的实用的科学。
二、化学科学的形成和发展三、化学科学的探索空间交流·研讨在初步认识化学科学的基础上,你认为哪些职业和化学有关?它们涉及到哪些化学方面的内容?你最喜欢其中的哪种职业?概括·整合1. 化学科学是一门什么样的科学?2. 举例说明化学科学的创造性和实用性。
由此可看出,化学科学的特征是什么?3. 怎样理解“化学21世纪的中心科学”这句话的含义?第2节研究物质性质的方法和程序交流·研讨1. 在初中化学的学习中,你认识了哪些物质?你是通过什么方法来研究它们的性质的?2. 你认为研究一种物质的性质,应该按照怎样的程序来进行?你能通过实例说明吗?一、研究物质性质的基本方法研究物质的性质,常常运用观察、实验、分类、比较等方法。
观察·思考观察金属钠及金属钠和水反应的现象在研究物质性质的过程中,可以通过实验来验证对物质性质的预测或探究物质未知的性质。
在进行实验时,要注意控制温度、压强、溶液的浓度等条件,这是因为同样的反应物在不同的条件下可能会发生不同的反应。
在进行研究物质性质的实验前,要明确实验的目的要求、实验用品和实验步骤等;实验中,要仔细观察实验现象,并做好实验记录;实验后,要写好实验报告,并对实验结果进行分析。
活动·探究金属钠和氧气反应的实验交流·研讨1. 运用所学知识,比较金属钠和金属铁的性质。
2. 根据所学的知识和已有的生活经验,预测金属可能具有哪些共同的性质。
第一章认识化学科学`第一节《走进化学科学》1.化学科学就是研究各种各样的物质的组成、结构、性质、变化、制备和应用的自然科学,她具有创造性和实用性,她对于我们认识和利用物质具有重要的作用。
我国古代化学成就2.我国是世界四大文明古国之一,在化学发展史上有过极其辉煌的业绩。
冶金、陶瓷、酿造、造纸、火药等都是在世界上发明和应用得比较早的国家。
如商代的司母戊鼎是目前已知的最大的古青铜器。
1972年在河北出土的商代铁刃青铜钺是我国目前发现的最早的铁器。
我国古代的一些书籍中很早就有关于化学的记载。
著名医药学家李时珍的巨著《本草纲目》(公元1596年)中,还记载了许多有关化学鉴定的试验方法。
第2节研究物质性质的方法和程序1研究物质的性质常常运用观察、实验、分类、比较等方法。
2.四种基本方法(1)观察法①含义:是一种有计划、有目的地用感官考察研究对象的方法。
②内容:可以直接用肉眼观察物质的颜色、状态,用鼻子闻物质的气味,也可以借助一些仪器来进行观察,提高观察的灵敏度。
人们既在观察过程中,不仅要用感官去搜集信息,还要积极地进行思考,及时储存和处理所搜集的信息。
观察要有明确而具体的目的,要对观察到的现象进行分析和综合。
(2)实验法①含义:通过实验来验证对物质性质的预测或探究物质未知的性质的方法。
②注意的问题:在进行实验时,必须注意实验安全。
同时要注意控制温度、压强、溶液的浓度等条件,这是因为同样的反应物质在不同的条件下可能会发生不同的反应。
③实验的步骤:在进行研究物质性质的实验前,要明确实验的目的要求、实验用品和实验步骤等;实验中,要仔细研究实验现象,并做好实验记录;实验后,要写好实验报告,并对实验结果进行分析。
(3)分类法在研究物质性质时,运用分类的方法,分门别类地对物质及其变化进行研究,可以总结出各类物质的通性和特性;反之,知道某物质的类别,我们就可推知该物质的一般性质。
(4)比较法运用比较的方法,可以找出物质性质间的异同,认识物质性质间的内在联系,对物质的性质进行归纳和概括。
● 3.案例:对金属钠的研究1、钠的物理性质软、亮、轻、低、导(软——质软,硬度小;亮——银白色金属光泽;轻——密度小,比水轻;低——熔点低;导——可导电、导热)思考:你在研究钠的物理性质过程中用到什么样的方法?提示:“软”——观察用小刀切割钠的实验;“亮”——观察钠的断面;“轻”——通过钠与水反应的实验,观察到钠浮在水面上;“低”——通过钠与水的实验,观察到钠熔成小球或通过钠与氧气反应的实验,观察到加热时钠很快熔化;“导”——首先通过分类法确定钠属于金属,然后根据金属的通性判断。
2、钠的化学性质(1)与O2反应:常温:4Na+O2=2Na2O (白色固体);点燃或加热:2Na+O2点燃Na2O2 (淡黄色固体);(2)与Cl2反应:2Na+Cl2点燃2NaCl;(3)与水反应:2Na+2H2O=2NaOH+H2↑思考:①在钠与水反应的实验中,你能观察到什么现象?通过这些现象可以得出什么结论?②如果钠粘在烧杯壁上,很快就燃烧起来,为什么?②钠与水反应过程中放出大量的热,如果钠粘在烧杯壁上,产生的热量不能及时的散发出去,引燃产生的氢气并使钠燃烧起来。
(4)与酸反应:非常剧烈,以致爆炸;(5)与盐溶液反应:可认为是先与盐溶液中的水反应,然后再发生复分解反应(其实质都是先于溶液中的H+反应)。
【领悟·整合】一种单质如果属于金属单质,讨论其化学性质的一般思路是,一般能和非金属单质(O2、Cl2、S等)、水、酸、盐等反应以及其他特性等。
钠在一定条件下可以与大部分非金属单质以及包括水在内的化合物反应,说明钠是一种极为活泼的金属。
3、钠的存在与保存(1)元素在自然界的存在有两种形态:游离态:元素以单质形式存在;化合态:元素以化合物形式存在。
钠的化学性质很活泼,在自然界里无游离态,只有化合态(NaCl、Na2CO3、Na2SO4、NaNO3等)(2)保存:因为常温下金属钠能跟空气中的氧气反应,还能跟水、水蒸气反应,所以金属钠保存在煤油或石蜡油中,主要是为了隔绝空气和水。
4、钠的用途(1)K—Na合金用于原子反应堆作导热剂。
(2)制备Na2O2。
(3)做电光源:高压钠灯。
(4)冶炼稀有金属。
【联想·发散】Na2O和 Na2O2:Na2O属于碱性氧化物,可以与酸、酸性氧化物、水反应。
如:Na2O+H2O=2NaOH;Na2O2属于过氧化物,也可以与酸、酸性氧化物、水等物质反应,所不同的是,在这些反应中一般有氧气生成:2Na2O2+2H2O=4NaOH+O2↑,2Na2O2+2CO2=2Na2CO3+O2↑;Na2O2可用与潜艇或宇宙飞船中的供氧剂。
4研究物质性质的基本程序首先,要观察物质的外观性质(包括物质的存在状态、颜色气味等);第二、要对物质的性质进行预测;第三、设计并实施实验来验证所做的预测。
通过对实验现象的观察和分析,归纳出与预测相一致的性质,并对实验中所出现的特殊现象进行进一步的研究;第四、对实验现象进行分析、综合、推论,概括出物质的通性及特性。
● 5.案例:氯气1、Cl2的物理性质在通常情况下,氯气为黄绿色气体,有刺激性气味的有毒气体.易液化,能溶于水(1∶2),氯水颜色呈淡黄色。
闻Cl2时:应距Cl2一尺左右,用手轻轻扇一下集气瓶口上方空气,让少量的Cl2进入鼻孔。
2、Cl2的化学性质(1)与金属反应2Na + Cl2点燃2NaCl(白烟); Cu + Cl2点燃 CuCl2(棕黄色烟,加少量水显绿色,冲稀后变蓝色);2Fe + 3Cl2点燃 2FeCl3(棕红色烟,加少量水显棕黄色)(2)与非金属反应H2 + Cl2点燃2HCl(白雾)。
纯净的H2可在Cl2中燃烧,发出苍白色火焰。
HCl(溶解度1∶500)溶于水成为盐酸.【知识·链接】化学现象中的烟、雾、气烟:大量细小固体颗粒分散在气体中的现象。
例:Cu在Cl2中燃烧生成(CuCl2)棕黄色烟。
雾:大量细小液滴分散在气体中。
例如HCl气体在空气中遇水蒸气生成的雾(盐酸小液滴)。
气:是指气态物质。
若气体无色,则肉眼看不到,气体有色才能观察到。
(3)与水反应: Cl2 + H2O = HCl + HClO说明:氯气的水溶液称为氯水,由于氯气不是简单的溶于水,而是与水反应,氯水的成分和性质较为复杂。
氯水的主要成分有氯气、盐酸、次氯酸等,氯水也兼具有这几种物质的性质。
如次氯酸具有漂白性,氯水也具有漂白性。
(4)与碱反应: Cl2 + 2NaOH = NaClO + NaCl + H2O(该反应可用于Cl2的尾气处理);工业上用Cl2与石灰乳作用制漂白粉: 2Cl2 + 2Ca(OH)2= CaCl2 + Ca(ClO)2 + 2H2O (5)与盐溶液的置换反应:Cl2 + 2NaI = 2NaCl + I2(该反应常用作Cl2的检验); Cl2 + 2NaBr = 2NaCl + Br2【启发·引申】①变价金属与Cl2反应时一般显高价。
②广义的燃烧:任何发光,发热的剧烈化学反应都可以叫燃烧。
③Cl2与碱的反应可认为Cl2先于水反应,生成HCl和HClO,HCl和HClO再与碱反应生成NaCl和NaClO 。
④漂白粉的漂白原理:Ca(ClO)2 + H2O + CO2= CaCO3↓ + 2HClO;起漂白杀菌作用的是HClO。
该反应也说明了碳酸(CO2 + H2O)的酸性强于次氯酸,反应原理是强酸制取弱酸。
【专题放送】氯水的成分和性质(1)氯水的成分氯水是氯气的水溶液,通常情况下为浅黄色溶液,氯水中只有部分Cl2与水反应,其化学方程式为:Cl2 + H2O = HCl + HClO新制的氯水中含Cl2、H2O、HClO等分子和H+、Cl-、ClO-、OH-等离子。
(2)氯水的性质氯水的性质比较复杂,有可能存在多种成分同时作用于一种物质.在一般情况下,认为是溶液中氯分子的性质。
若为盐酸或次氯酸的性质,主要有下面几种情况:①作为盐酸的性质:当与弱酸的盐或硝酸银溶液作用时,主要作为盐酸性质,例如:氯水与Na2CO3溶液反应以及氯水与AgNO3溶液反应。
②作为次氯酸的性质:氯水用于漂白(与有机化合物色素作用)、消毒、杀菌等。
③要注意液氯与氯水的区别:液氯是纯净物,成分是Cl2分子,而氯水是混合物。
第3节化学中常用的物理量——物质的量1 物质的量及其单位——摩尔1.物质的量:物质的量是表示物质所含微粒多少的物理量,是国际单位制中七个基本物理量之一。
物质的量的符号为n。
注意:(1)这里的微粒是指分子、原子、离子、质子、中子、电子或这些粒子的特定组合等微观粒子,不能指宏观颗粒。
(2)“物质的量”是一个专用名词,不能拆开。
例如,不能说“氢气的量、硫酸的量”,而应说“氢气的物质的量、硫酸的物质的量”。
【知识·链接】基本物理量是由人们根据需要选定的,在不同学科中和不同时期,选定的基本物理量有所不同。
例如,在力学中选定的基本物理量是:长度、质量、时间;在热学领域中则采用长度、质量、时间、温度为基本物理量。
1971年前国际制中采用的基本物理量是六个,即:长度、质量、时间、电流、热力学温度、发光强度。
1971年起又增加了物质的量为基本物理量,使基本物理量增加到七个。
2.阿伏加德罗常数:我们把0.012kg12C所含的碳原子数称为阿伏加德罗常数,其近似值为6.02×1023mol-1,符号为N A。
(1)阿伏加德罗常数带有单位,其单位是mol-1。
(2)阿伏加德罗常数的准确值是0.012 kg 12C中所含有的碳原子数目,近似值是6.02×1023 mol-1。
(3)N A数值巨大,作用于宏观物质没有实际意义。
【交流·研讨】为什么选用0.012 kg 12C中所含的碳原子数为阿伏加德罗常数?相对原子质量的确定是以一个12C原子的质量的1/12作为标准,其他原子的质量跟它比较所得的比值。
12C的相对原子质量为12。
选用12g正是因为“12”这个数值能与相对原子质量、相对分子质量联系起来。
如某原子R的相对原子质量为A r,1个12C原子质量为ag,则1个R原子的质量为A r·a/12 g,1mol R原子的质量为N A·A r·a/12 g,N A·a=12g,所以1molR的质量即为A r·a/12 g,同理可推得1mol某分子、离子等的质量(g),其数值正好等于其相对分子质量或式量,这给物质的量的计算和应用带来极大方便。
3.摩尔:摩尔是物质的量的单位,每摩尔物质含有阿伏加德罗常数个微粒。
摩尔简称摩,符号为mol。
注意:在使用摩尔表示物质的量时,应该用化学式指明粒子的种类,而不使用该粒子的中文名称。