高考化学复习第八章 第29讲 难溶电解质的溶解平衡
- 格式:docx
- 大小:1020.23 KB
- 文档页数:12

高中化学《难溶电解质的溶解平衡》说课稿高中化学《难溶电解质的溶解平衡》说课稿作为一名教职工,可能需要进行说课稿编写工作,借助说课稿可以让教学工作更科学化。
那么什么样的说课稿才是好的呢?下面是小编帮大家整理的高中化学《难溶电解质的溶解平衡》说课稿,欢迎阅读,希望大家能够喜欢。
一、说教材这部分内容我主要从教材的地位与作用,教学内容,教学目标,等几方面进行说课。
1、课标的要求,能应用化学平衡理论描述溶解平衡,知道转化的本质。
2、地位和作用: 在学生学习了弱电解质的电离平衡,水的电离和溶液的酸碱性,盐类水解平衡后,再介绍难溶电解质的溶解平衡可以更全面的了解水溶液中离子平衡相关理论,更好地理解在溶液中发生离子反应的原理。
沉淀溶解平衡的过程分析,体现了化学理论的指导作用。
在教学功能上这一节起着延伸、拓展和巩固前面所学知识的作用。
3、教学内容: 难溶电解质的溶解平衡作为一种平衡体系,遵从平衡移动原理。
难溶电解质的溶解度尽管很小,但不会等于零,如Ag2S,难溶≠不溶。
以辩证思维为特征,以溶解与沉淀这两个互逆的过程为研究对象,论证物质溶解的决对性和物质溶解限度大小的相对性,并且在论证物质的“溶”与“不溶”之间更使水溶液中各种微观粒子的相互作用以动态的形式展示出来,最终得出结论:沉淀的生成,沉淀的溶解,沉淀的转化实质就是沉淀溶解平衡的建立和移动的过程。
4、学情分析:在学习本节课之前,学生已经学习了弱电解质的电离平衡,水的电离和溶液的酸碱性,盐类水解平衡,对平衡及平衡移动的基本知识,探究方法有了一定的了解。
因而我采用了理论分析和实验探究并重,以思考与交流为主线,注重学习过程,强调学生主动参与。
5、教学目标。
【知识与技能】1)让学生掌握难溶电解质的溶解平衡及溶解平衡的应用;培养学生的知识迁移能力和逻辑推理能力。
2)了解溶度积的意义;【过程与方法】引导学生根据已有的知识经验,分析推理出新的知识。
【情感态度与价值观】认识自然科学中对立统一的辩证唯物主义。






高考总复习 难溶电解质的溶解平衡【考纲要求】1.运用化学平衡移动原理分析难溶电解质的溶解平衡。
2.知道沉淀转化的本质。
3.了解溶度积常数。
【考点梳理】考点一、沉淀溶解平衡1.溶解度与溶解性的关系20℃时,电解质在水中的溶解度与溶解性存在如下关系:2.溶解平衡(1)、概念:在一定条件下,当难溶电解质溶解和生成速率相等时,得到难溶电解质的饱和溶液,即达到溶解平衡。
(2)、特征:逆、等、定、动、变(与化学平衡相同,适用于平衡移动原理) 要点诠释:a 、逆:溶质溶解的过程是一个可逆过程:b 、等:v(溶解)= v(沉淀)c 、定:达到平衡时,溶液中各离子浓度保持不变d 、动:动态平衡,v(溶解)= v(沉淀) ≠ 0e 、变:当外界条件改变时,沉淀溶解平衡将发生移动,直到达到新的平衡。
例:一定温度下,将难溶电解质AgCl 放入水中时,会发生溶解和沉淀两个过程: AgCl(s)Ag +(aq)+ Cl -(aq) 初始:v(溶)﹥v(沉) 平衡:v(溶)=v(沉)正是这种平衡的存在,决定了Ag +与Cl -的反应不能进行到底。
3.溶度积常数(注:有些省市不考):(1)定义:一定温度下难溶强电解质的饱和溶液中各组分离子浓度幂的乘积为一常数。
AmBn(s) mA n+(aq) + nD m-(aq) Ksp = c m (A n+)·c n (B m-)要点诠释:K SP 反映了难溶电解质在水中的溶解能力a 、用溶度积直接比较时,物质的类型(如AB 型、A 2B 型、AB 2型)必须相同。
b 、对于同种类型物质,K SP 数值越大,难溶电解质在水中的溶解能力越强。
如由K sp 数值可知,溶解能力:AgCl >AgBr >AgI >Ag 2S ,Cu(OH)2<Mg(OH)2。
c 、不同类型的物质,K sp 差距不大时不能直接作为比较依据。
如:AgCl (s) Ag +(aq)+Cl ―(aq),K sp =1.8×10―10,Mg(OH)2 (s) Mg 2+(aq)+2OH ―(aq),K sp =5.6×10―12。


目夺市安危阳光实验学校难溶电解质的溶解平衡考点1 溶解平衡(一)存在:只要有固体存在的悬浊液中都存在例:NaCl(s ) Na+(aq)+Cl-(aq) AgCl(s) Ag+(aq)+Cl-(aq)(二)特征(1)等:(2)动:(3)定:达到平衡时,溶液中(4)变:当外界条件改变,溶解平衡将(三)沉淀反应的应用(1)沉淀的形成和转化加入与溶液中的某些离子生成沉淀,达到分离或除去某些离子的目的。
反应中,离子趋向于生成的物质。
(2)沉淀的溶解根据平衡移动原理,减少溶解平衡体系中的某种离子,会使平衡向沉淀向方向移动,沉淀逐渐。
例: Mg(OH)2(s)≒ Mg2+(aq)+ OH-(aq)OH- + H+ H2O 条件的改变了原难溶电解质的溶解平衡。
[特别提醒]:解决沉淀溶解平衡的一般思路:“看到”粒子——“找到”平衡——“想到”移动[例1]己知碳酸钙和氢氧化钙在水中存在下列溶解平衡Ca(OH)2(固)Ca2++2OH-,CaCO3(固) Ca2++CO32-。
在火力发电厂燃烧煤的废气中往往含有SO2、O2、N2,CO2等,为了除去有害气体SO2变废为宝,常常见粉末状的碳酸钙或熟石灰的悬浊液洗涤废气,反应产物为石膏。
(1)写山上述两个反应的化学方程式:①S02与CaCO3悬浊液反应②S02与Ca(OH)2悬浊液反应(2)试说明用熟石灰的悬浊液而不用澄清石灰水的理由[答案](1)①2SO2+O2+2CaCO3+4H2O=2(CaSO4·H2O)+2CO2或 2SO2+O2+2CaCO3+4H2O=2(CaSO4·H2O)+2CO2②2SO2+O2+2Ca(OH)2+2H2O=2(CaSO4·2H2O)或2SO2+O2+2Ca(OH)2=2CaSO4+2H2O(2) Ca(OH)2微溶于水,石灰水中Ca(OH)2浓度小,不利于吸收SO2[规律总结]根据二氧化硫的还原性和其水溶液的酸性强弱,再结合化学平衡和溶解平衡知识,即可解题。
高二化学下册《难溶电解质的溶解平衡》知识点整理高二化学下册《难溶电解质的溶解平衡》知识点整理(一)沉淀溶解平衡1、沉淀溶解平衡和溶度积定义:在一定温度下,当把PbI2固体放入水中时,PbI2在水中的溶解度很小,PbI2表面上的Pb2+离子和I-离子,在H2O分子作用下,会脱离晶体表面进入水中。
反过来在水中的水合Pb2+离子与水合I-离子不断地作无规则运动,其中一些Pb2+(aq)和I-(aq)在运动中相互碰撞,又可能沉积在固体表面。
当溶解速率与沉淀速率相等时,在体系中便存在固体与溶液中离子之间的动态平衡。
这种平衡关系称为沉淀溶解平衡,其平衡常数叫溶度积常数或溶度积。
沉淀溶解平衡和化学平衡、电离平衡一样,一种动态平衡,其基本特征为:(1)可逆过程;(2)沉积和溶解速率相等;(3)各离子浓度不变;(4)改变温度、浓度等条件平衡移动。
2、溶度积的一般表达式:在一定温度下,难溶电解质在饱和溶液中各离子浓度幂的乘积是一个常数,这个常数称为该难溶电解质的溶度积。
用符号Ksp表示。
3、溶度积的影响因素:溶度积Ksp的大小和溶质的溶解度不同,它只与难溶电解质的性质和温度有关,与浓度无关。
但是,当温度变化不大时,Ksp数值的改变不大,因此,在实际工作中,常用室温18~25℃的常数。
4、溶度积的应用:(1)溶度积Ksp可以用来判断难溶电解质在水中的溶解能力,当化学式所表示的组成中阴、阳离子个数比相同时,Ksp数值越大的难溶电解质在水中的溶解能力越强。
(2)溶度积Ksp可以判断沉淀的生成、溶解情况以及沉淀溶解平衡移动方向。
5、溶度积(Ksp)的影响因素和性质:溶度积(Ksp)的大小只与难溶电解质性质和温度有关,与沉淀的量无关,离子浓度的改变可使平衡发生移动,但不能改变溶度积,不同的难溶电解质在相同温度下Ksp不同。
相同类型的难溶电解质的Ksp越小,溶解度越小,越难溶。
例如:(AgCl) Ksp(AgBr) Ksp(AgI),溶解度:AgCl) Ksp(AgBr) Ksp(AgI)。
难溶电解质的沉淀溶解平衡【热点思维】【热点释疑】1、怎样判断沉淀能否生成或溶解?通过比较溶度积与非平衡状态下溶液中有关离子浓度幂的乘积——离子积Q c的相对大小,可以判断难溶电解质在给定条件下沉淀生成或溶解的情况:Q c>K sp,溶液有沉淀析出;Q c=K sp,溶液饱和,沉淀的生成与溶解处于平衡状态;Q c<K sp,溶液未饱和,无沉淀析出。
2、如何理解溶度积(K sp)与溶解能力的关系?溶度积(K sp)反映了电解质在水中的溶解能力,对于阴阳离子个数比相同的电解质,K sp的数值越大,难溶电解质在水中的溶解能力越强;但对于阴阳离子个数比不同的电解质,不能通过直接比较K sp数值的大小来判断难溶电解质的溶解能力。
3、沉淀溶解平衡有哪些常考的知识点?沉淀生成的两大应用①分离离子:对于同一类型的难溶电解质,如向含有等浓度的Cl-、Br-、I-的混合溶液中滴加AgNO3溶液,AgCl、AgBr、AgI中溶度积小的物质先析出,溶度积大的物质后析出。
②控制溶液的pH来分离物质,如除去CuCl2中的FeCl3就可向溶液中加入CuO 或Cu(OH)2等物质,将Fe3+转化为Fe(OH)3而除去。
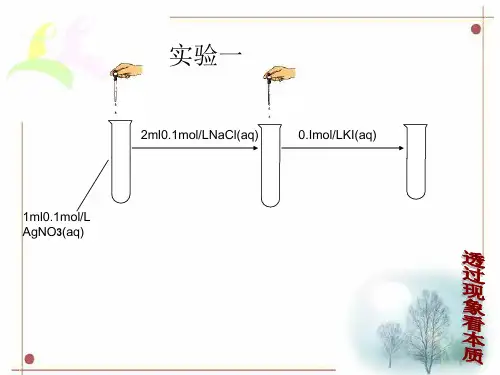
【热点考题】【典例】实验:①0.1 mol·L-1 AgNO3溶液和0.01 mol·L-1 NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c;②向滤液b中滴加0.1 mol·L-1 KI溶液,出现浑浊;③向沉淀c中滴加饱和KI溶液,沉淀变为黄色。
下列分析正确的是()A.通过实验①②证明浊液a中存在沉淀溶解平衡:AgCl(s) Ag+(aq)+Cl-(aq) B.滤液b中不含有Ag+C.③中颜色变化说明AgCl转化为AgID.实验可以证明AgI比AgCl更难溶【答案】C【对点高考】【2014年高考上海卷第11题】向饱和澄清石灰水中加入少量CaC2,充分反应后恢复到原来的温度,所得溶液中()A.c(Ca2+)、c(OH-)均增大B.c(Ca2+)、c(OH-)均保持不变C.c(Ca2+)、c(OH-)均减小D.c(OH-)增大、c(H+)减小【答案】B【解析】试题分析:碳化钙溶于水与水反应生成氢氧化钙和乙炔,反应的化学方程式为CaC2+2H2O→Ca(OH)2+HC≡CH↑。
难溶电解质的溶解平衡一.固体物质的溶解度1.溶解度:在一定温度下,某固体物质在100g 溶剂里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里的溶解度。
符号:S ,单位:g ,公式:S=(m 溶质/m 溶剂 )×100g2.3.绝大多数固体物质的溶解度随温度的升高而增大,少数物质的溶解度随温度变化不明显,个别物质的溶解度随温度的升高而减小。
二?沉淀溶解平衡 1.溶解平衡的建立讲固态物质溶于水中时,一方面,在水分子的作用下,分子或离子脱离固体表面进入水中,这一过程叫溶解过程;另一方面,溶液中的分子或离子又在未溶解的固体表面聚集成晶体,这一过程叫结晶过程。
当这两个相反过程速率相等时,物质的溶解达到最大限度,形成饱和溶液,达到溶解平衡状态。
溶质溶解的过程是一个可逆过程: 2.沉淀溶解平衡绝对不溶解的物质是不存在的,任何难溶物质的溶解度都不为零。
以AgCl 为例:在一定温度下,当沉淀溶解和生成的速率相等时,便得到饱和溶液,即建立下列动态平衡:AgCl(s)Ag +(aq)+Cl -(aq)3.溶解平衡的特征1)动:动态平衡2)等:溶解和沉淀速率相等3)定:达到平衡,溶液中离子浓度保持不变4)变:当外界条件改变时,溶解平衡将发生移动,达到新的平衡。
三.沉淀溶解平衡常数——溶度积1)定义:在一定温度下,难溶性物质的饱和溶液中,存在沉淀溶解平衡,其平衡常数叫溶度积常数。
2)表达式:即:AmBn(s)mA n+(aq)+nB m -(aq) Ksp =[A n+]m ·[B m -]n例如:常温下沉淀溶解平衡:AgCl(s)Ag +(aq)+Cl -(aq),Ksp(AgCl)=[Ag +][Cl -] =1.8×10-10常温下沉淀溶解平衡:Ag 2CrO 4(s)2Ag +(aq)+CrO 42-(aq),Ksp(Ag 2CrO 4)=[Ag +]2[CrO2- 4] =1.1×10-123)意义:反应了物质在水中的溶解能力。
考纲要求 1.了解难溶电解质的沉淀溶解平衡。
2.理解溶度积(K sp)的含义,能进行相关的计算。
考点一沉淀溶解平衡及应用1.沉淀溶解平衡(1)沉淀溶解平衡的概念在一定温度下,当难溶强电解质溶于水形成饱和溶液时,溶解速率和生成沉淀速率相等的状态。
(2)溶解平衡的建立溶液中的溶质固体溶质溶解沉淀①v溶解>v沉淀,固体_____;②v溶解=v沉淀,溶解_____;③v溶解<v沉淀,_____晶体。
(3)溶解平衡的特点2.影响沉淀溶解平衡的因素(1)内因难溶电解质本身的性质,这是决定因素。
(2)外因①浓度:加水稀释,平衡向_____的方向移动;②温度:绝大多数难溶盐的溶解是_____过程,升高温度,平衡向_____的方向移动;③同离子效应:向平衡体系中加入难溶物溶解产生的离子,平衡向_____的方向移动;④其他:向平衡体系中加入可与体系中某些离子反应生成更难溶或更难电离或气体的离子时,平衡向_____的方向移动。
例如:以AgCl(s)Ag+(aq)+Cl-(aq)为例,填写外界条件对溶解平衡的影响。
(3)电解质在水中的溶解度20 ℃时,电解质在水中的溶解度与溶解性存在如下关系:3.沉淀溶解平衡的应用(1)沉淀的生成①调节pH法如:除去NH4Cl溶液中的FeCl3杂质,可加入氨水调节pH至7~8,离子方程式为Fe3++3NH3·H2O===Fe(OH)3↓+3NH+4。
②沉淀剂法如:用H2S沉淀Cu2+,离子方程式为H2S+Cu2+===CuS↓+2H+。
(2)沉淀的溶解①酸溶解法如:CaCO3溶于盐酸,离子方程式为CaCO3+2H+===Ca2++H2O+CO2↑。
②盐溶液溶解法如:Mg(OH)2溶于NH4Cl溶液,离子方程式为Mg(OH)2+2NH+4===Mg2++2NH3·H2O。
③氧化还原溶解法如:不溶于盐酸的硫化物Ag2S溶于稀HNO3。
④配位溶解法如:AgCl溶于氨水,离子方程式为AgCl+2NH3·H2O===[Ag(NH3)2]++Cl-+2H2O。
(3)沉淀的转化①实质:__________的移动(沉淀的溶解度差别越大,越容易转化)。
②应用:锅炉除垢、矿物转化等。
深度思考正误判断,正确的打“√”,错误的打“×”(1)沉淀达到溶解平衡时,溶液中溶质离子浓度一定相等,且保持不变()(2)升高温度,沉淀溶解平衡一定正向移动()(3)室温下,AgCl在水中的溶解度小于在食盐水中的溶解度()(4)BaSO4在同物质的量浓度的Na2SO4溶液和Al2(SO4)3溶液中的溶解度相同()(5)根据AgCl(s)Ag+(aq)+Cl-(aq),CH3COOH CH3COO-+H+,可以判断AgCl、CH3COOH均为弱电解质()题组一沉淀溶解平衡及其影响因素1.已知溶液中存在平衡:Ca(OH)2(s)Ca2+(aq)+2OH-(aq)ΔH<0,下列有关该平衡体系的说法正确的是()①升高温度,平衡逆向移动②向溶液中加入少量碳酸钠粉末能增大钙离子的浓度③除去氯化钠溶液中混有的少量钙离子,可以向溶液中加入适量的NaOH溶液④恒温下,向溶液中加入CaO,溶液的pH升高⑤给溶液加热,溶液的pH升高⑥向溶液中加入Na2CO3溶液,其中固体质量增加⑦向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变A.①⑥B.①⑥⑦C.②③④⑥D.①②⑥⑦2.下列说法正确的是()①难溶电解质达到沉淀溶解平衡时,溶液中各种离子的溶解(或沉淀)速率都相等②难溶电解质达到沉淀溶解平衡时,增加难溶电解质的量,平衡向溶解方向移动③向Na2SO4溶液中加入过量的BaCl2溶液,则SO2-4沉淀完全,溶液中只含Ba2+、Na+和Cl-,不含SO2-4④K sp小的物质其溶解能力一定比K sp大的物质的溶解能力小⑤为减少洗涤过程中固体的损耗,最好选用稀H2SO4代替H2O来洗涤BaSO4沉淀⑥洗涤沉淀时,洗涤次数越多越好A.①②③B.①②③④⑤⑥C.⑤D.①⑤⑥题组二实验探究沉淀转化的原因3.实验:①0.1 mol·L-1AgNO3溶液和0.1 mol·L-1 NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c;②向滤液b中滴加0.1 mol·L-1KI溶液,出现浑浊;③向沉淀c中滴加0.1 mol·L-1KI溶液,沉淀变为黄色。
下列分析不正确的是()A.浊液a中存在沉淀溶解平衡:AgCl(s)Ag+(aq)+Cl-(aq)B.滤液b中不含有Ag+C.③中颜色变化说明AgCl转化为AgID.实验可以证明AgI比AgCl更难溶4.(2016·北京东城区高三期末)为研究沉淀的生成及转化,某小组进行如下实验。
关于该实验的分析不正确的是()A.①浊液中存在平衡:AgSCN(s)Ag+(aq)+SCN-(aq)B.②中颜色变化说明上层清液中含有SCN-C.③中颜色变化说明有AgI生成D .该实验可以证明AgI 比AgSCN 更难溶考点二 溶度积常数及其应用1.溶度积和离子积 以A m B n (s)m A n +(aq)+n B m -(aq)为例:2.K sp 的影响因素(1)内因:难溶物质本身的性质,这是主要决定因素。
(2)外因①浓度:加水稀释,平衡向_____方向移动,但K sp _____。
②温度:绝大多数难溶盐的溶解是_____过程,升高温度,平衡向溶解方向移动,K sp _____。
③其他:向平衡体系中加入可与体系中某些离子反应生成更难溶物质或更难电离物质或气体的离子时,平衡向溶解方向移动,但K sp 不变。
深度思考1.正误判断,正确的打“√”,错误的打“×”(1)K sp (AB 2)小于K sp (CD),则AB 2的溶解度小于CD 的溶解度( )(2)不可能使要除去的离子全部通过沉淀除去。
一般认为残留在溶液中的离子浓度小于1.0×10-5mol·L-1时,已经完全沉淀( )(3)在一定条件下,溶解度较小的沉淀也可以转化成溶解度较大的沉淀( ) (4)常温下,向BaCO 3的饱和溶液中加入Na 2CO 3固体,BaCO 3的K sp 减小( ) (5)溶度积常数K sp 只受温度影响,温度升高,K sp 增大( )(6)常温下,向Mg(OH)2饱和溶液中加入NaOH 固体,Mg(OH)2的K sp 不变( ) 2.已知25 ℃时BaSO 4饱和溶液中存在:BaSO 4(s)Ba 2+(aq)+SO 2-4(aq),K sp =1.102 5×10-10,向c (SO 2-4)为1.05×10-5mol·L-1的BaSO 4溶液中加入BaSO 4固体,SO 2-4的浓度怎样变化?试通过计算说明。
(1)溶解平衡一般是吸热的,温度升高平衡右移,K sp 增大,但Ca(OH)2相反。
(2)对于沉淀溶解平衡:A m B n(s)m A n+(aq)+n B m-(aq),K sp=c m(A n+)·c n(B m-),对于相同类型的物质,K sp的大小反映了难溶电解质在溶液中溶解能力的大小,也反映了该物质在溶液中沉淀的难易。
与平衡常数一样,K sp与温度有关。
不过温度改变不大时,K sp变化也不大,常温下的计算可不考虑温度的影响。
题组一沉淀溶解平衡曲线1.在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。
又知t℃时AgCl的K sp=4×10-10,下列说法不正确的是()A.在t℃时,AgBr的K sp为4.9×10-13B.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点变到b点C.图中a点对应的是AgBr 的不饱和溶液D.在t℃时,AgCl(s)+Br-(aq)AgBr(s)+Cl-(aq)的平衡常数K≈8162.(2016·邯郸一中高考保温试题)已知25 ℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示。
向100 mL该条件下的CaSO4饱和溶液中加入400 mL 0.01 mol·L-1 Na2SO4溶液,下列叙述正确的是()A.溶液中析出CaSO4固体沉淀,最终溶液中c(SO2-4)比原来的大B.溶液中无沉淀析出,溶液中c(Ca2+)、c(SO2-4)都变小C.溶液中析出CaSO4固体沉淀,溶液中c(Ca2+)、c(SO2-4)都变小D.溶液中无沉淀析出,但最终溶液中c(SO2-4)比原来的大3.(2016·豫晋冀三调)某温度时,可用K2S沉淀Cu2+、Mn2+、Zn2+三种离子(M2+),所需S2-最低浓度的对数值lg c(S2-)与lg c(M2+)的关系如图所示。
下列说法正确的是()A.三种离子对应的硫化物中K sp(CuS)最小,约为1×10-20B.向MnS的悬浊液中加入少量水,沉淀溶解平衡向溶解的方向移动,c(S2-)增大C.可用MnS除去MnCl2溶液中混有的少量杂质ZnCl2D.向浓度均为1×10-5mol·L-1的Cu2+、Zn2+、Mn2+混合溶液中逐滴加入1×10-4mol·L-1的Na2S溶液,Zn2+先沉淀沉淀溶解平衡图像题的解题策略(1)沉淀溶解平衡曲线类似于溶解度曲线,曲线上任一点都表示饱和溶液,曲线上方的任一点均表示过饱和溶液,此时有沉淀析出,曲线下方的任一点均表示不饱和溶液。
(2)从图像中找到数据,根据K sp公式计算得出K sp的值。
(3)比较溶液的Q c与K sp的大小,判断溶液中有无沉淀析出。
(4)涉及Q c的计算时,所代入的离子浓度一定是混合溶液中的离子浓度,因此计算离子浓度时,所代入的溶液体积也必须是混合溶液的体积。
题组二K sp及其应用4.按要求回答下列问题。
(1)将AgNO2和AgCl的饱和溶液等体积混合后,加入足量的硝酸银溶液,生成的沉淀n(AgNO2)________n(AgCl)(填“大于”、“小于”或“等于”)。
[该温度下,K sp(AgNO2)=2×10-8;K sp(AgCl)=1.8×10-10](2)已知25 ℃时K sp[Fe(OH3)]=4.0×10-38,此温度下若在实验室中配制5 mol·L-1 100 mL FeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入________ mL 2 mol·L-1的盐酸(忽略加入盐酸体积)。
(3)CaSO3溶液与CaCl2溶液混合会生成难溶的CaSO3(K sp=3.1×10-7),现将等体积的CaCl2溶液与Na2SO3溶液混合,若混合前Na2SO3溶液的浓度为2×10-3mol·L-1,则生成沉淀所需CaCl2溶液的最小浓度为_______________________________________。