几种典型制药工艺流程图
- 格式:doc
- 大小:933.50 KB
- 文档页数:9
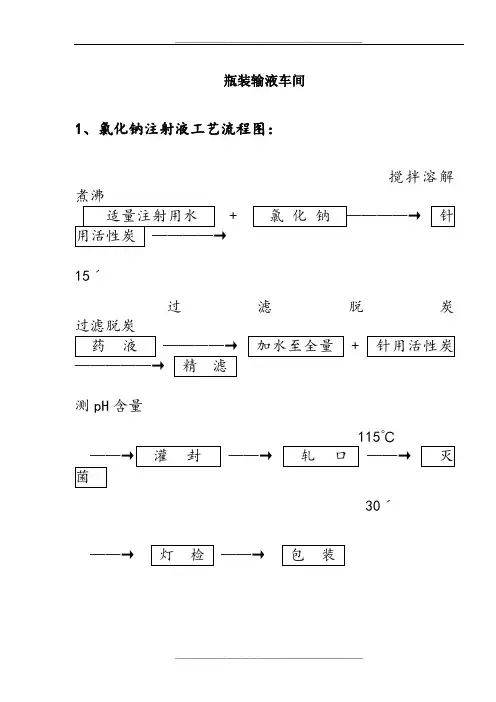
瓶装输液车间1、氯化钠注射液工艺流程图:搅拌溶解煮沸15ˊ过滤脱炭过滤脱炭测pH含量115℃30ˊ氯化钠注射液生产过程质量控制要点:2、葡萄糖注射液工艺流程图:煮沸 搅拌溶解+ 煮沸 过滤脱炭15ˊ过滤脱炭测pH 值含量115℃30ˊ葡萄糖注射液生产过程质量控制要点:3、葡萄糖氯化钠注射液工艺流程图:煮沸 + 15ˊ过滤脱炭 测pH 值含量115℃30ˊ葡萄糖氯化钠注射液生产过程质量控制要点:胶塞洗涤水可见异物1次/每锅灌装后半成品药液装量1次/每小时可见异物1次/批轧口铝盖铝盖紧密度随时/班灭菌灭菌柜标志、装量、压力、温度、时间、记录每柜灭菌前半成品标志、存放区每柜灭菌后半成品外壁清洁度、标志、存放区每柜灯检灯检品可见异物每个工号/班每瓶标志随时/班包装贴签内容、外观随时/班装箱数量、装箱单、内容每箱4、复方氨基酸注射液(15AA)工艺流程图:复方氨基酸注射液(15AA)生产过程质量控制要点:灌装后半成品药液装量1次/每小时可见异物1次/批轧口铝盖铝盖紧密度随时/班灭菌灭菌柜标志、装量、压力、温度、时间、记录每柜灭菌前半成品标志、存放区每柜灭菌后半成品外壁清洁度、标志、存放区每柜灯检灯检品可见异物每个工号/班每瓶标志随时/班包装贴签内容、外观随时/班装箱数量、装箱单、内容每箱5、复方氨基酸注射液(18AA)工艺流程图:复方氨基酸注射液(18AA)生产过程质量控制要点:灌装后半成品药液装量1次/每小时可见异物1次/批轧口铝盖铝盖紧密度随时/班灭菌灭菌柜标志、装量、压力、温度、时间、记录每柜灭菌前半成品标志、存放区每柜灭菌后半成品外壁清洁度、标志、存放区每柜灯检灯检品可见异物每个工号/班每瓶标志随时/班包装贴签内容、外观随时/班装箱数量、装箱单、内容每箱6、复方氨基酸注射液(18AA)30g工艺流程图:复方氨基酸注射液(18AA)30g生产过程质量控制要点:7、甘露醇注射液工艺流程图:煮沸 搅拌溶解 + + 煮沸30 ˊ 过滤脱炭过滤脱炭+泵至稀配锅测PH 含量120℃40ˊ甘露醇注射液生产过程质量控制要点:8、甲硝唑氯化钠注射液工艺流程图:+ +过滤脱炭+ 测PH 含量115℃30ˊ甲硝唑氯化钠注射液生产过程质量控制要点:9、氧氟沙星葡萄糖注射液工艺流程图:搅拌溶解 煮沸+15ˊ冷却至30℃ 搅拌————→NaOH 溶液乳酸过滤 ———————→ 调节PH4.0-5.0116℃———→ ———→ ———→ 30ˊ氧氟沙星葡萄糖注射液生产过程质量控制要点:灌装后半成品药液装量1次/每小时可见异物1次/批轧口铝盖铝盖紧密度随时/班灭菌灭菌柜标志、装量、压力、温度、时间、记录每柜灭菌前半成品标志、存放区每柜灭菌后半成品外壁清洁度、标志、存放区每柜灯检灯检品可见异物每个工号/班每瓶标志随时/班包装贴签内容、外观随时/班装箱数量、装箱单、内容每箱10、硫酸依替米星氯化钠注射液工艺流程图:硫酸依替米星氯化钠注射液生产过程质量控制要点:软包装输液车间1、氯化钠注射液工艺流程图:搅拌溶解煮沸+15ˊ过滤脱炭过滤脱炭+测pH 含量115℃30ˊ氯化钠注射液生产过程质量控制要点:2、葡萄糖注射液工艺流程图:煮沸搅拌溶解+ + 煮沸+ 15ˊ过滤脱炭测pH值含量葡萄糖注射液生产过程质量控制要点:3、葡萄糖氯化钠注射液工艺流程图:煮沸+ 15分钟过滤脱炭测pH值含量葡萄糖氯化钠注射液生产过程质量控制要点:4、甲硝唑氯化钠注射液工艺流程图:搅拌溶解+ +过滤脱炭115℃+测PH含量30ˊ甲硝唑氯化钠注射液生产过程质量控制要点:小容量注射液车间1、苯甲醇注射液工艺流程图:搅拌至溶解测PH值+ +(必要时加热)测含量100℃30ˊ苯甲醇注射液生产过程质量控制要点:2、酚磺乙胺注射液工艺流程图:+测PH 值酚磺乙胺注射液生产过程质量控制要点:3、肌苷注射液工艺流程图:加热微沸边加边搅拌 搅拌 调PH 值+ 85℃保温30分钟测定含量 通N 2 100℃+ 30ˊ肌苷注射液生产过程质量控制要点:4、氟罗沙星注射液工艺流程图:加热至85-90℃ +搅拌80℃保温30溶解冷却至45℃100℃30ˊ氟罗沙星注射液生产过程质量控制要点:5、甲钴胺注射液工艺流程图:+ + +甲钴胺注射液生产过程质量控制要点:6、利巴韦林注射液工艺流程图:搅拌后搅拌溶解+ +过滤测PH 至澄明100℃含量30ˊ利巴韦林注射液生产过程质量控制要点:7、硫酸阿米卡星注射液:充N 2 30ˊ搅拌温度15~20℃搅拌 搅拌均匀测PH 值+药液温度≤20℃用NaOH 调PH 值通N2 搅拌15ˊ 100℃ + 静止15ˊ 30ˊ硫酸阿米卡星注射液生产过程质量控制要点:8、硫酸奈替米星注射液工艺流程图:通氮气20ˊ溶解后+ +搅拌均匀+ +搅拌20ˊ 105℃静置10ˊ 20ˊ硫酸奈替米星注射液生产过程质量控制要点:9、硫酸庆大霉素注射液工艺流程图:+30ˊ硫酸庆大霉素注射液生产过程质量控制要点:10、硫酸小诺霉素注射液工艺流程图:搅拌++搅拌30ˊ 充氮 100℃ + 30ˊ硫酸小诺霉素注射液生产过程质量控制要点:。

药品生产典型工艺流
程框图
常见药品生产典型工艺流程框图
药品生产对环境的洁净等级要求与药品的品种、剂型和生产特点有关。
常见药品生产的典型工艺流程及环境区域划分如图1-1至图1-9。
图1-1 非无菌原料药精制、干燥、包装工艺流程框图及环境区域划分
图1-2 无菌原料药精制、干燥、包装工艺流程框图及环境区域划分
图1-3 片剂生产工艺流程框图及环境区域划分
图1-4 硬胶囊剂生产工艺流程框图及环境区域划分
图1-5 压制法软胶囊剂生产工艺流程框图及环境区域划分
图1-6 可灭菌小容量注射剂生产工艺流程框图及环境区域划分
图1-7 可灭菌大容量注射剂生产工艺流程框图及环境区域划分
图1-8 注射用无菌分装产品生产工艺流程框图及环境区域划分
图1-9 注射用冷冻干燥制品生产工艺流程框图及环境区域划分。

造粒车间工艺流程图一、引言造粒车间是制药工厂中的关键环节之一,主要用于将药物原料转化为固体颗粒状,以便后续的包装和贮存。
本文将详细描述造粒车间的工艺流程图,以便于操作人员和相关人员了解和执行。
二、工艺流程图以下是造粒车间的工艺流程图,包括了主要的步骤和操作要点:1. 原料准备- 原料称量:根据配方要求,将所需原料按照一定比例称量。
- 原料检查:对原料进行外观、颜色、气味等方面的检查,确保原料的质量符合要求。
2. 制粒过程- 混合:将称量好的原料进行混合,以确保药物成份均匀分布。
- 研磨:将混合好的原料进行研磨,使其达到所需的颗粒大小。
- 湿法造粒:将研磨好的原料与粘结剂一起加入造粒机中,通过湿法造粒的方法将原料转化为颗粒状。
- 干燥:将湿法造粒后的颗粒进行干燥,以去除多余的水分。
3. 筛分和包装- 筛分:将干燥后的颗粒进行筛分,以去除不合格的颗粒。
- 包装:将筛分好的颗粒根据包装要求进行分装,通常采用自动包装机进行操作。
4. 清洁和消毒- 清洁:定期对造粒车间进行清洁,包括地面、设备、工作台等的清洁。
- 消毒:定期对造粒车间进行消毒,以确保无菌环境。
5. 记录和报告- 记录:对每一个步骤进行记录,包括原料的批次号、操作人员、时间等信息。
- 报告:根据记录的数据生成相应的报告,以便于管理人员进行分析和决策。
三、数据示例以下是一个示例数据,用于说明造粒车间的工艺流程中的一些关键数据:- 原料称量:A药物100g,B药物200g,C药物50g。
- 原料检查:外观正常,颜色无异物,气味符合要求。
- 混合:将A、B、C药物按比例混合,混合时间10分钟。
- 研磨:将混合好的药物研磨至颗粒大小在100-200微米之间。
- 湿法造粒:将研磨好的药物与粘结剂按比例加入造粒机中,造粒时间30分钟。
- 干燥:将湿法造粒后的颗粒进行干燥,干燥温度80摄氏度,干燥时间2小时。
- 筛分:通过筛网筛分,颗粒大小符合要求的通过,不合格的剔除。



药厂典型工艺流程
《药厂典型工艺流程》
药厂的工艺流程是指将原料药经过一系列工艺步骤加工制成成品药的过程。
药厂典型的工艺流程可以大致分为以下几个步骤:
1. 原料采购:药厂首先要购买原料药,并进行严格的质量检验。
原料的来源和质量直接影响到成品药的质量和安全性。
2. 原料处理:经过质量检验合格的原料药需要进行一系列的处理步骤,包括称量、混合、粉碎等。
这些步骤可以根据不同的药品类型和工艺要求进行调整。
3. 反应制备:某些制剂需要经过反应才能得到所需的成品药。
这个步骤需要在特定的温度、压力和时间下进行,以确保反应的完整和准确。
4. 分离纯化:经过反应制备得到的混合物需要接下来进行分离和纯化,以去除不需要的杂质和不纯物质。
这个步骤通常包括过滤、结晶、蒸馏等方法。
5. 成型制剂:分离和纯化后的物质需要进行成型制剂,包括压片、制粒、注射液灌装等。
这个步骤可以根据药品的用途和形式进行不同的处理。
6. 包装包装:最后,成型制剂需要进行包装,以确保药品的安全性和稳定性。
包装包括瓶装、盒装、胶囊装等不同的形式。
以上是药厂典型的工艺流程,其中每一个步骤都需要严格执行和控制,以确保药品的质量和安全性。
同时,药厂也需要根据不同的药品类型和工艺要求进行调整和优化,以提高生产效率和降低成本。



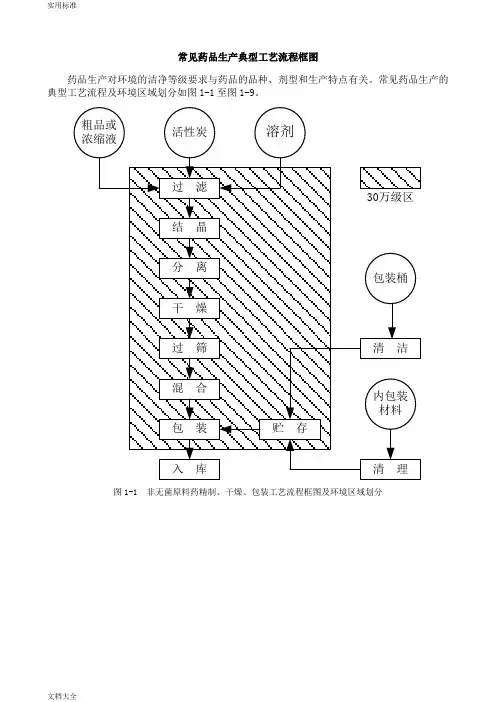
常见药品生产典型工艺流程框图
药品生产对环境的洁净等级要求与药品的品种、剂型和生产特点有关。
常见药品生产的典型工艺流程及环境区域划分如图1-1至图1-9。
图1-1 非无菌原料药精制、干燥、包装工艺流程框图及环境区域划分
图1-2 无菌原料药精制、干燥、包装工艺流程框图及环境区域划分
图1-3 片剂生产工艺流程框图及环境区域划分
图1-4 硬胶囊剂生产工艺流程框图及环境区域划分
图1-5 压制法软胶囊剂生产工艺流程框图及环境区域划分
图1-6 可灭菌小容量注射剂生产工艺流程框图及环境区域划分
图1-7 可灭菌大容量注射剂生产工艺流程框图及环境区域划分
图1-8 注射用无菌分装产品生产工艺流程框图及环境区域划分
图1-9 注射用冷冻干燥制品生产工艺流程框图及环境区域划分。

制药企业工艺流程图1. 原料采购:从可靠的供应商处采购各种原料,如药物成分、原料药、添加剂等。
2. 原料检验:对采购的原料进行严格的检验,确保符合药品生产的质量要求。
3. 原料准备:对通过检验的原料进行必要的准备处理,如筛选、清洗、粉碎等。
4. 混合制备:将各种原料按配方比例混合,形成药物成分的混合物。
5. 反应制备:按照工艺要求进行各种反应制备,制备出原料药或中间体。
6. 加工制备:对反应制得的产物进行必要的加工,如结晶、干燥、研磨等。
7. 成品制备:将原料药按照配方要求进行成品制备,形成最终的制剂。
8. 包装:将制得的最终制剂进行包装,标注相关信息并进行最终质检。
9. 库存管理:对成品制剂进行库存管理,确保产品的质量和供应的充足性。
10. 质量控制:在整个生产过程中,对产品进行严格的质量控制,确保药品符合国家相关标准。
以上流程便是制药企业的工艺流程图,贯穿整个生产线,确保产品质量和产能的实现。
制药企业的工艺流程图是一个复杂而有序的系统,它涵盖了从原料采购到最终产品包装的整个生产过程。
在每一个环节都进行着严格的质量控制,确保产品的安全、有效性和质量。
下面将详细介绍制药企业工艺流程图中各个环节的相关内容。
原料采购环节是制药企业生产的第一步,原料的质量和来源直接影响着整个产品的质量。
因此,企业需要选择可靠的原料供应商和严格的原料采购标准,确保原料的纯度、稳定性和安全性。
采购的原料主要包括药物成分、原料药、添加剂等。
企业需要建立完善的原料采购管理系统,对原料进行严格的甄别和检验,排除质量不合格的原料。
原料检验环节是保证产品质量的重要环节之一。
对采购的原料进行严格的检验,包括外观检查、理化性质检测、微生物检验等,确保原料符合药品生产的质量要求。
同时,对原料进行严格的抽样检验和记录,确保原料质量数据可溯源。
原料准备环节是将通过检验的原料进行必要的准备处理,包括筛选、清洗、粉碎等。
这一环节的目的是为了使原料能够更好地投入到下一步的生产过程中,确保生产设备的正常运行和产品质量的稳定。
造粒车间工艺流程图一、引言造粒车间是制药工厂中的重要环节,用于将原料药物或药物成分进行造粒处理,以便于后续的制剂加工和包装。
本文将详细介绍造粒车间的工艺流程图,包括原料准备、混合、造粒、干燥、筛分、包装等环节。
二、工艺流程图以下是造粒车间的工艺流程图:1. 原料准备- 原料A、原料B、原料C等原料按照配方比例准备。
- 原料进入称量区,通过称量设备进行准确称量。
- 称量完成后,将原料送入混合设备。
2. 混合- 将称量好的原料放入混合设备中。
- 启动混合设备,将原料进行充分混合。
- 混合完成后,将混合后的原料送入造粒设备。
3. 造粒- 将混合后的原料送入造粒机。
- 启动造粒机,将原料进行造粒处理。
- 造粒完成后,将造粒物料送入干燥设备。
4. 干燥- 将造粒物料送入干燥设备。
- 启动干燥设备,将物料进行干燥处理。
- 干燥完成后,将干燥后的物料送入筛分设备。
5. 筛分- 将干燥后的物料送入筛分设备。
- 启动筛分设备,将物料进行筛分处理。
- 筛分完成后,将筛分后的物料送入包装设备。
6. 包装- 将筛分后的物料送入包装设备。
- 启动包装设备,将物料进行包装处理。
- 包装完成后,将包装好的产品进行质量检验。
7. 质量检验- 从包装好的产品中取样,送入质量检验室进行检验。
- 根据药品质量标准,对产品进行各项指标的检测。
- 合格的产品将进行入库存放,不合格的产品将进行处理或退货。
三、总结以上是造粒车间的工艺流程图,从原料准备到最终的包装和质量检验,每个环节都有相应的设备和操作步骤。
通过严格的工艺流程控制,可以确保药品的质量和安全性。
同时,对于每个环节都需要进行记录和数据统计,以便于追溯和质量管理。
制药企业应根据自身的实际情况,对工艺流程进行优化和改进,以提高生产效率和产品质量。
造粒车间工艺流程图一、引言造粒车间是制药工厂中的重要环节之一,主要用于将原料药粉末转化为颗粒状,以便后续的制剂工艺使用。
本文将详细介绍造粒车间的工艺流程图及各个步骤的操作要点。
二、工艺流程图以下是造粒车间的工艺流程图,包括了主要的工艺步骤和设备。
1. 原料准备- 原料药粉的称量:根据配方要求,将所需的原料药粉进行准确的称量。
- 原料药粉的筛选:通过筛网将原料药粉进行筛选,以去除杂质和团聚的颗粒。
2. 湿法造粒- 溶液制备:将一定比例的溶剂和辅料加入搅拌槽中,充分搅拌均匀。
- 混合:将称量好的原料药粉逐步加入搅拌槽中,与溶液进行充分混合。
- 湿法造粒:将混合好的药物溶液通过喷雾装置喷洒到旋转的造粒盘上,形成颗粒状的湿团。
- 干燥:将湿团放入烘干设备中,通过热风将水分蒸发,使颗粒逐渐变干。
3. 干法造粒- 原料药粉的筛选:同样需要对原料药粉进行筛选,以去除杂质和团聚的颗粒。
- 干法造粒:将筛选好的原料药粉通过造粒机进行干法造粒,通过机械力的作用使粉末会萃成颗粒。
- 筛分:将干法造粒得到的颗粒进行筛分,以控制颗粒的大小范围。
4. 成品处理- 冷却:将造粒后的颗粒通过冷却设备进行降温,以防止颗粒在后续的包装过程中变软或者粘连。
- 包装:将冷却好的颗粒通过自动包装机进行包装,通常使用密封袋或者瓶装。
5. 清洁和消毒- 设备清洁:定期对造粒车间的设备进行清洁,以确保生产环境的卫生和产品质量的稳定。
- 环境消毒:定期对车间进行消毒处理,以杀灭细菌和微生物,防止交叉污染。
三、操作要点1. 原料准备阶段:- 确保原料药粉的准确称量,避免误差对产品质量造成影响。
- 注意原料药粉的筛选工作,确保颗粒的均匀性和纯净度。
2. 湿法造粒阶段:- 溶液制备时要充分搅拌均匀,确保药物和溶剂的充分混合。
- 控制喷雾装置的喷雾量和角度,以获得均匀的湿团。
- 干燥过程中要控制热风的温度和流量,避免颗粒过度干燥或者过度结块。
3. 干法造粒阶段:- 控制干法造粒机的转速和压力,以获得理想的颗粒形态和大小。
常见药品生产典型工艺流程框图
药品生产对环境的洁净等级要求与药品的品种、剂型和生产特点有关;常见药品生产的典型工艺流程及环境区域划分如图1-1至图1-9;
图1-1 非无菌原料药精制、干燥、包装工艺流程框图及环境区域划分
图1-2 无菌原料药精制、干燥、包装工艺流程框图及环境区域划分
图1-3 片剂生产工艺流程框图及环境区域划分
图1-4 硬胶囊剂生产工艺流程框图及环境区域划分
图1-5 压制法软胶囊剂生产工艺流程框图及环境区域划分
图1-6 可灭菌小容量注射剂生产工艺流程框图及环境区域划分
图1-7 可灭菌大容量注射剂生产工艺流程框图及环境区域划分
图1-8 注射用无菌分装产品生产工艺流程框图及环境区域划分
图1-9 注射用冷冻干燥制品生产工艺流程框图及环境区域划分。
常见药品生产典型工艺流程框图
药品生产对环境的洁净等级要求与药品的品种、剂型和生产特点有关。
常见药品生产的典型工艺流程及环境区域划分如图1-1至图1-9。
图1-1 非无菌原料药精制、干燥、包装工艺流程框图及环境区域划分
图1-2 无菌原料药精制、干燥、包装工艺流程框图及环境区域划分
图1-3 片剂生产工艺流程框图及环境区域划分
图1-4 硬胶囊剂生产工艺流程框图及环境区域划分
图1-5 压制法软胶囊剂生产工艺流程框图及环境区域划分
图1-6 可灭菌小容量注射剂生产工艺流程框图及环境区域划分
图1-7 可灭菌大容量注射剂生产工艺流程框图及环境区域划分
图1-8 注射用无菌分装产品生产工艺流程框图及环境区域划分
图1-9 注射用冷冻干燥制品生产工艺流程框图及环境区域划分。