第一章
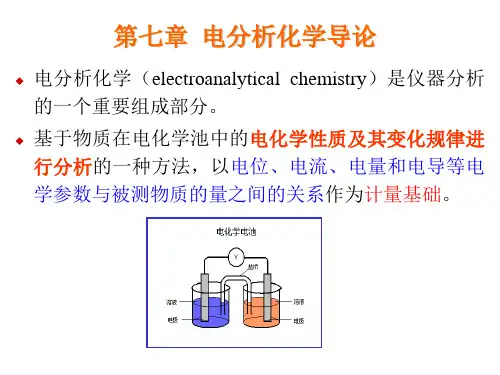
电分析化学导论
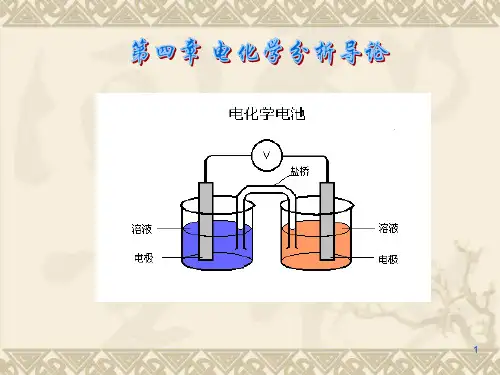
化学电池
Electrochemical Cell
电极电位
Electrode Potential
液接电位与盐桥
Liquid Junction Potential and Salt Bridge
电极的极化与超电位
Polarization on Electrodes and Overpotential
Hg
2+
0.059V 2/Hg+ 2
lg
Ksp1, Hg2C2O4 Ksp2 , Ca2C2O4
所以 E = K +
0.059V 2
lgaca2+
(四)零类电极: 由惰性金属与含有可溶性的氧化和还原质的溶 液。 例如Pt|Fe2+,Fe3+电极,
电极反应为: 电极电位为: Fe3+ + e E= Eθ Fe2+ + 0.059V lg
5、写出下列电池的半电池反应及电池反应,计算 其电动势,该电池是电解池还是原电池?
Zn│ZnSO4(0.1mol/L) ║AgNO3(0.01mol/L) │Ag 6、下述电池的电动势为0.413V, Pt,H2(101325Pa)|HA(0.215mol/L),NaA(0.116mol/L) ║SCE Esce=0.2443V,计算弱酸HA的解离常数。 7、下述电池的电动势为0.921V, Cd |CdX2-4(0.200mol/L),X-(0.150mol/L) ║SCE EθCd2+/Cd=-0.403V,Esce=0.2443V,计算Cd2-4的形成常数。 8、下述电池的电动势为0.893V, Cd |CdX2(饱和),X-(0.02mol/L) ║SCE EθCd2+/Cd=-0.403V,Esce=0.2443V,计算CdX2的溶度积常数。