银川一中理科学霸高中化学笔记_硫及其主要化合物_2015高考状元笔记
- 格式:pdf
- 大小:3.78 MB
- 文档页数:7
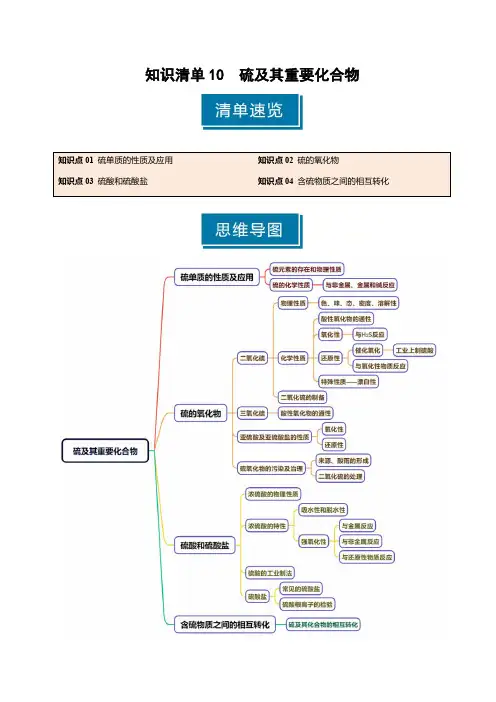
知识清单10硫及其重要化合物知识点01硫单质的性质及应用1.硫元素的存在形态游离态:_________附近或地壳的_________;化合态:主要以_________和_________的性质存在。
2.硫的物理性质______色或______色固体;俗称_______,质脆,易研成粉末,密度比水大,_____溶于水,______溶于酒精,易溶于________。
3.硫的化学性质S -2←――――氧化性S 0――→还原性S +4(1)与非金属单质反应与氧气反应:___________________________与氢气反应:___________________________(2)与金属反应与钠反应:___________________________与铁反应:___________________________与铜反应:___________________________与汞反应:___________________________应用:去除洒落的汞硫与变价金属反应生成______价态化合物(3)与NaOH 溶液反应:____________________________________应用:清洗试管壁残留的硫(1)硫与Fe 反应生成FeS ,与Cu 反应生成CuS()(2)汞蒸气有毒,实验室里不慎洒落一些汞,可撒上硫粉进行处理()(3)硫与少量的O 2反应生成SO 2,与过量的O 2反应生成SO 3()(4)硫与少量的O 2反应生成SO 2,与过量的O 2反应生成SO 3()(5)实验室洗涤附着在试管内壁上的硫,可用酒精清洗()1.硫和氯气的氧化性强弱比较方法(1)与变价金属反应,Cl 2与变价金属反应生成_______价态化合物,S 与变价金属反应生成______价态化合物;(2)氢化物的稳定性:HCl____H 2S ;(3)置换反应:____________________________________;(4)最高价含氧酸的酸性:HClO 4_____H 2SO 4;(5)还原性:S 2-_______Cl -。

高一必修一化学知识点总结硫高一必修一化学知识点总结:硫化学作为一门自然科学,研究的是物质的组成、性质以及变化规律。
在高一的化学学习中,我们接触到了众多的元素和化合物,其中之一就是硫。
下面,我们将对硫的相关知识点进行总结。
1. 硫的性质硫是一种非金属元素,具有一系列特定的性质。
它的物态为黄色结晶固体,在常温下无色气体没有味道。
硫的熔点较低,为115.21℃,沸点为444.674℃。
在自然界中,硫一般以硫矿石的形式存在,如黄铁矿、黄锌矿等。
2. 硫的化合物硫具有很高的活泼性,常与氧、金属等元素形成化合物。
其中,最常见的一种化合物就是二氧化硫(SO2)。
SO2是一种无色的气体,具有刺激性气味。
它与水反应生成亚硫酸(H2SO3),在大气中也能与水蒸气反应生成硫酸(H2SO4),导致酸雨的形成。
此外,硫还能形成其他多种化合物,如三氧化硫(SO3)、四氧化硫(SO4)等。
这些化合物在工农业生产中有着广泛的应用,如硫酸广泛用于制造化肥和制药等领域。
3. 硫的生物地球化学作用硫在生物地球化学过程中发挥着重要作用。
硫在地壳中存在的主要形态是硫酸盐,而在生物体内则以无机硫和有机硫的形式存在。
硫在生物体内参与着蛋白质、维生素等生物分子的组成。
硫还是一种重要的微量元素,对植物的生长和发育起着促进作用。
此外,硫在地球大气中的含量对大气层的稳定也有着重要的作用。
4. 硫在人类生活中的应用硫及其化合物在人类生活中有着广泛的应用。
硫酸是一种非常重要的化学品,广泛用于工农业生产中。
硫还在医药领域有重要应用,常用于制造药物的原料。
此外,硫还被用于制作染料、橡胶等。
5. 硫的环境问题尽管硫是一种在工业生产和人类生活中广泛应用的元素,但同时也带来了一些环境问题。
主要表现为硫燃烧产生的二氧化硫(SO2)排放过多导致的大气污染问题,如酸雨和雾霾的形成。
为了解决硫排放过多的问题,一方面需要改善生产工艺,减少硫的排放。
另一方面,也需要人们共同呼吁、参与环保行动,提高环保意识,减少对环境造成的负面影响。


高一硫及其化合物知识点总结摘要:一、概述高一硫及其化合物的重要性二、总结高一硫化合物的基本性质和特点三、分析高一硫化合物在实际应用中的案例四、提出学习高一硫化合物的方法和建议正文:高一硫及其化合物是高中化学中的重要知识点,对于学生来说,掌握高一硫化合物的基本性质、特点及实际应用具有重要意义。
本文将对高一硫及其化合物进行总结,并分析其在实际应用中的案例,同时提出学习高一硫化合物的方法和建议。
一、概述高一硫及其化合物的重要性高一硫及其化合物是高中阶段化学课程的核心内容之一,涉及到硫元素及其化合物的基础知识。
在学习过程中,学生需要了解硫的化学性质、物理性质,以及在不同条件下形成的化合物。
掌握高一硫化合物有助于学生进一步学习化学,为高考和未来的科研工作打下基础。
二、总结高一硫化合物的基本性质和特点1.硫的化学性质:硫元素在自然界中以硫化物、硫酸盐等形式存在,具有还原性和氧化性。
在高中阶段,学生需要学习硫的氧化还原反应、酸碱中和反应等基本化学反应。
2.硫的物理性质:硫单质为黄色固体,具有刺激性气味。
硫晶体具有多种同素异形体,如α-硫、β-硫等。
3.高一硫化合物的特点:硫化合物具有多样性,包括硫化物、硫酸盐、硫酸酯等。
其中,硫化物具有良好的导电性和热稳定性;硫酸盐具有较强的酸性和吸附性;硫酸酯具有较高的沸点等特点。
三、分析高一硫化合物在实际应用中的案例1.硫酸盐在农业中的应用:硫酸钾、硫酸铵等化肥中含有高一硫化合物,可作为植物生长的营养元素,促进作物增产。
2.硫化橡胶在工业中的应用:硫化橡胶具有优异的耐磨、耐老化性能,广泛应用于轮胎、密封件等领域。
3.硫酸酯在医药中的应用:硫酸酯类化合物具有良好的生物活性,如硫酸阿托品、硫酸钡等,在医药领域具有广泛应用。
四、提出学习高一硫化合物的方法和建议1.强化基础知识:学生应加强对硫元素及其化合物的基础知识的掌握,熟练掌握硫的化学性质、物理性质及高一硫化合物的特点。
2.理论联系实际:在学习过程中,要将理论知识与实际案例相结合,加深对高一硫化合物的理解和应用。

2019高考化学一轮复习硫及其化合物知识点硫是一种非金属元素,化学符号S,原子序数16,下面是查字典化学网整理的硫及其化合物知识点,希望考生可以及时了解详情。
1.自然界中的硫?(1 )游离态:存在于火山喷口附近或地壳的岩层里。
(2)化合态硫化物:如硫铁矿?FeS2?、黄铜矿?CuFeS2?等。
硫酸盐:如石膏?CaSO4?、芒硝?Na2SO4?10H2O?等。
2.物理性质?俗称硫黄,颜色状态:淡黄色固体,溶解性:水中不溶,酒精中微溶,CS2中易溶。
3.化学性质?(1)与非金属反应与H2、O2反应的化学方程式为:S+H2=====△H2S,S+O2=====点燃SO2(现象:紫色火焰)。
(2)与金属反应与Fe、Cu反应的化学方程式为:Fe+S=====△FeS,2Cu+S=====△Cu2S。
(3)与碱反应与NaOH反应的化学方程式为:3S+6NaOH=====△2Na2S+Na2SO3+3H2O。
问题二、硫化氢的性质?师生活动:1.物理性质颜色:无色,气味:臭鸡蛋气味,毒性:有毒。
2.化学性质(1)弱酸性氢硫酸是一种二元弱酸,能与NaOH溶液反应。
NaOH足量:2NaOH+H2S===Na2S+2H2O,NaOH不足:NaOH+H2S===NaHS+H2O。
(2)还原性H2S与O2反应O2过量:2H2S+3O2=====点燃2SO2+2H2O,O2不足:2H2S+O2=====点燃2S+2H2O。
3.制备实验室常用硫化物与酸反应制取H2S,如FeS与盐酸的反应的化学方程式为FeS+2HCl===FeCl2+H2S↑。
问题三:二氧化硫的性质师生活动:1.物理性质SO2是无色、有刺激性气味的有毒气体,密度比空气大,容易液化,易溶于水。
2.化学性质(1)酸性氧化物通性①与H2O反应:SO2+H2O===H2SO3。
②与碱性氧化物反应与CaO的反应为:CaO+SO2===CaSO3。
③与碱反应与NaOH溶液的反应为:2NaOH+SO2===Na2SO3+H2O。

第14讲硫及其重要化合物考点一硫及其氧化物硫化氢亚硫酸一、硫单质1.硫元素的存在形态2.硫单质的物理性质俗称颜色状态溶解性水酒精CS2硫黄黄色晶体不溶微溶易溶3.二、硫的氧化物1.二氧化硫(SO2)(1)物理性质颜色气味状态水溶性毒性无色刺激性气味气体易溶,1体积水约溶解40体积SO2有毒①酸性氧化物的通性⎩⎪⎨⎪⎧能使紫色石蕊溶液变红色与H 2O 反应:SO 2+H 2OH 2SO 3与碱反应⎩⎨⎧NaOH 足量:SO 2+2OH -===SO 2-3+H 2O NaOH 少量:SO 2+OH -===HSO-3与碱性氧化物反应:CaO +SO 2===CaSO3②氧化性与H 2S 溶液反应:SO 2+2H 2S===3S ↓+2H 2O(生成黄色沉淀);③还原性⎩⎪⎪⎨⎪⎪⎧与O 2反应:2SO 2+O 2催化剂△2SO 3使溴水褪色:SO 2+Br 2+2H 2O===H 2SO 4+2HBr使酸性KMnO 4溶液褪色:5SO 2+2MnO -4+2H 2O===5SO 2-4+2Mn 2++4H +与FeCl 3溶液反应:SO 2+2Fe 3++2H 2O===SO 2-4+2Fe 2++4H +与H 2O 2溶液反应:SO 2+H 2O 2===H 2SO4④漂白性:SO 2可使品红溶液褪色,加热后,溶液恢复红色。
2.三氧化硫(SO 3)SO 3在标准状况下为无色、针状晶体,能与水反应,化学方程式为SO 3+H 2O===H 2SO 4,放出大量的热。
SO 3是酸性氧化物,它跟碱性氧化物或碱都能反应生成相应的硫酸盐。
3.硫的氧化物的污染与治理 (1)硫的氧化物的来源、危害及治理(2)硫酸型酸雨的形成过程三、三类漂白剂的漂白原理比较类型原理举例特点备注氧化型将有机色质内部“生色团”破坏掉HClO、NaClO、Ca(ClO)2、Na2O2、H2O2、O3等化学变化、不可逆、持久无选择性加合型与有机色质内部“生色团”化合成无色物质SO2化学变化、可逆、不持久有选择性吸附型将有色物质吸附而褪色活性炭物理变化吸附色素(1)SO2使品红溶液褪色表现的是漂白性,加热后溶液恢复至红色;SO2使酸性高锰酸钾溶液、溴水、氯水、碘水褪色表现的是还原性,加热后溶液颜色不复原。

硫及其化合物一、硫及其重要化合物的主要性质及用途: 1.硫:(1)物理性质: 硫为淡黄色固体;不溶于水, 微溶于酒精, 易溶于CS2(用于洗去试管壁上的硫);硫有多种同素异形体: 如单斜硫、斜方硫、弹性硫等。
(2)化学性质: 硫原子最外层6个电子, 较易得电子, 表现较强的氧化性。
①与金属反应(与变价金属反应, 均是金属氧化成低价态)Al 2S 3的唯一途径) 2S (黑色) ②与非金属反应2 (说明硫化氢不稳定)③与化合物的反应 S+6HNO 34+6NO 2↑+2H 2O S+2H 2SO 4+2H 2O 2S+Na 2SO 3+3H 2O (用热碱溶液清洗硫)(3)用途: 大量用于制造硫酸、三药一柴: 医药、火药、农药、和火柴的原料。
2. 硫的氧化物: (1)二氧化硫:①SO2是无色而有刺激性气味的有毒气体, 密度比空气大, 容易液化, 易溶于水。
②SO2是酸性氧化物, 能跟水反应生成亚硫酸。
③SO 2有强还原性 常见氧化剂(见上)均可与SO 2发生氧化一还原反应 如: SO2 + Cl 2 +2H2O == H2SO4 + 2HCl④SO 2也有一定的氧化性 2H 2S + SO 2 == 3S ↓ +2H 2O⑤SO2具有漂白性, 能跟有色有机化合物生成无色物质(可逆、非氧化还原反应)⑥实验室制法: Na2SO3 + H2SO4(浓) == Na2SO3 + H2O +SO2↑ 或Cu + 2H 2SO 4(浓) === CuSO 4 + 2H 2O + SO 2↑(2)三氧化硫: 是一种没有颜色易挥发的晶体;具有酸性氧化物的通性, 遇水剧烈反应生成硫酸【练习】分析数据, 回答下列问题: (已知Cl2+SO2+2H2O H2SO4+2HCl)①雨水样品的pH变化的原因是(用化学反应方程式表示)____________________。
②如果将刚取样的上述雨水和自来水相混合, pH将变________(填“大”或“小”)。

知识清单10 硫及其重要化合物知识点01 硫单质的性质及应用1.硫元素的存在形态游离态:火山口附近或地壳的岩层里; 化合态:主要以硫化物和硫酸盐的性质存在。
2.硫的物理性质黄色或淡黄色固体;俗称硫黄,质脆,易研成粉末,密度比水大,难溶于水,微溶于酒精,易溶于CS 2。
3.硫的化学性质S -2←――――氧化性S 0――→还原性S +4(1)与非金属单质反应 与氧气反应:S+O 2=====点燃SO 2 与氢气反应:S+H 2=====△H 2S (2)与金属反应与钠反应:2Na+S===Na 2S 与铁反应:Fe+S=====△FeS 与铜反应:2Cu+S=====△Cu 2S与汞反应:Hg+S===HgS 应用:去除洒落的汞 硫与变价金属反应生成低价态化合物(3)与NaOH 溶液反应:3S+6NaOH=====△2Na 2S+Na 2SO 3+3H 2O 应用:清洗试管壁残留的硫(1)硫与Fe 反应生成FeS ,与Cu 反应生成CuS(×)错因:硫与变价金属反应时,生成低价态金属硫化物(如Cu 2S 、FeS)2。
(2)汞蒸气有毒,实验室里不慎洒落一些汞,可撒上硫粉进行处理(√) (3)硫与少量的O 2反应生成SO 2,与过量的O 2反应生成SO 3(×)错因:硫燃烧只能生成SO 2,与O 2的量无关,SO 2与O 2反应生成SO 3,需要温度较高,且有催化剂存在才可以。
(4)硫与少量的O 2反应生成SO 2,与过量的O 2反应生成SO 3(×)错因:硫燃烧只能生成SO 2,与O 2的量无关,SO 2与O 2反应生成SO 3,需要温度较高,且有催化剂存在才可以。
(5)实验室洗涤附着在试管内壁上的硫,可用酒精清洗(×)错因:硫微溶于酒精,易溶于CS2,残留在试管内壁上的硫可用CS 2溶解除去,也可用热的NaOH 溶液除去。
1.硫和氯气的氧化性强弱比较方法(1)与变价金属反应,Cl 2与变价金属反应生成高价态化合物,S 与变价金属反应生成低价态化合物; (2)氢化物的稳定性:HCl >H 2S ; (3)置换反应:H 2S +Cl 2 ===2HCl +S↓; (4)最高价含氧酸的酸性:HClO 4>H 2SO 4; (5)还原性:S 2->Cl -。
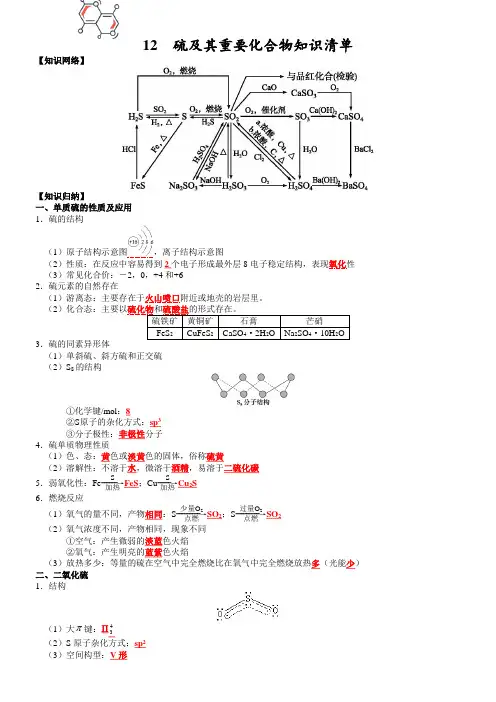

硫及其化合物知识点(总8页) -本页仅作为预览文档封面,使用时请删除本页-硫及其化合物一、硫及其重要化合物的主要性质及用途:1.硫:(1)物理性质:硫为淡黄色固体;不溶于水,微溶于酒精,易溶于CS 2(用于洗去试管壁上的硫);硫有多种同素异形体:如单斜硫、斜方硫、弹性硫等。
(2)化学性质:硫原子最外层6个电子,较易得电子,表现较强的氧化性。
①与金属反应(与变价金属反应,均是金属氧化成低价态)2S (剧烈反应并发生爆炸) 2Al+3S Al 2S 3的唯一途径) Fe+S FeS 2S (黑色) ②与非金属反应 2 S+H 2 H 2S③与化合物的反应 H 2SO 4+6NO 2↑+2H 2O S+2H 22↑+2H 2O 2S+Na 2SO 3+3H 2O (用热碱溶液清洗硫)(3)用途:大量用于制造硫酸、硫化天然橡胶,也用于制药和黑火药。
三药一柴:医药、火药、农药、和火柴的原料。
2.硫的氢化物:①硫化氢的物理性质:H 2S 是无色、有臭鸡蛋气味的有毒气体;能溶于水,密度比空气略大。
②硫化氢的化学性质A .可燃性:当22/O S H n n ≥2/1时,2H 2O (H 2S 过量) 当22/O S H n n ≤2/3时,2H 2S+3O 2 点燃 2SO 2+2H 2O (O 2过量)当23222<<O S H n n 时,两种反应物全部反应完,而产物既有硫又有SO 2 B .强还原性:常见氧化剂Cl 2、Br 2、I 2、Fe 3+、HNO 3、浓H 2SO 4、KMnO 4等,甚至SO 2均可将H 2S 氧化。
③H 2S 的水溶液叫氢硫酸,是二元弱酸。
除杂:用CuSO 4溶液除去H 2S : CuSO 4+H 2S===CuS↓+H 2SO 43.硫的氧化物:(1)二氧化硫:①SO 2是无色而有刺激性气味的有毒气体,密度比空气大,容易液化,易溶于水。
②SO 2是酸性氧化物,能跟水反应生成亚硫酸,亚硫酸是中强酸。

点燃第五章化工生产中的重要非金属元素第一节硫及其化合物一、硫和二氧化硫(一)硫1、结构特点:第三周期,第VIA 族,易得2个电子,S 单质具有氧化性,但比氧气的氧化性弱,常见的化合价是-2、0、+4、+6,最高价氧化物对应的水化物是H 2SO 42、存在形式:(1)游离态:存在于火山喷口或地壳的岩层,火山喷出物中含大量的硫化物,如H 2S 、SO 2、SO 3等,硫有多种同素异形体(2)化合态:主要以硫化物和硫酸盐的形式存在:黄铁矿(FeS 2)、黄铜矿(CuFeS 2)、石膏(CaSO4•2H2O )、芒硝(Na2SO4•10H2O )(3)硫是一种生命元素,组成某些蛋白质时离不开它,这也正是煤、石油、天然气等化石燃料中经常含硫的原因3、物理性质:硫(俗称硫黄)是一种黄色晶体,质脆,易研成粉末。
硫难溶于水,微溶于酒精,易溶于二硫化碳(CS 2),注:常用CS 2把S 与其它物质分开,也可用CS 2洗去沾在试管内壁的S 4、化学性质:比较活泼(1)与金属反应:Fe+S FeS (黑色)2Cu+S Cu 2S (黑色)S+Hg=HgS (有红色和黑色立方。
自然界中呈红褐色,称为辰砂或朱砂)2Na+S Na 2S (剧烈反应并发生爆炸)、2Al+3S Al 2S 3(制取Al 2S 3的唯一途径)注:①S 与变价金属反应时,一般只能生成低价态的金属硫化物②汞洒落在地面可撒些硫磺覆盖,这样可以防止汞蒸气中毒(2)与非金属反应:S+H 2H 2SS+O 2SO 2(空气中:淡蓝色火焰;纯氧:蓝紫色火焰)S+H 2H 2S(说明硫化氢不稳定)(3)与NaOH 反应:3S+6NaOH 2Na 2S+Na 2SO 3+3H 2O 3S+6OH -2S 2-+SO 32-+3H 2O利用热的碱液可以洗去附着在试管壁上的S 。
S+6HNO 3(浓)H 2SO 4+6NO 2↑+2H 2O S+2H 2SO 4(浓)2SO 2↑+2H 2O(4)用途:大量用于制造硫酸、硫化天然橡胶,也用于制药和黑火药。
1、硫(1)物理性质:硫为淡黄色固体;不溶于水,微溶于酒精,易溶于CS2(用于洗去试管壁上的硫);硫有多种同素异形体:如单斜硫、斜方硫、弹性硫等。
(2)化学性质:硫原子最外层 6 个电子,较易得电子,表现较强的氧化性。
①与金属反应(与变价金属反应,均是金属氧化成低价态)S+6HN3O(浓)H2SO4+6NO2↑+2H2O2Na+S===N2aS (剧烈反应并发生爆炸)2Al+3S Al 2S3(制取Al 2S3的唯一途径)Fe+S△FeS (黑色)2Cu + S △Cu 2S(黑色)②与非金属反应S+O2 点燃SO 2S+H 2 △H 2S(说明硫化氢不稳定)③与化合物的反应S+2H2SO4(浓)△2SO 2↑ +2H2O3S+6NaOH △2Na 2S+Na2SO3+3H2O(用热碱溶液清洗硫)(3)用途:大量用于制造硫酸、硫化天然橡胶,也用于制药和黑火药。
2、硫的氢化物①硫化氢的制取:Fe+H2SO4(稀)=FeSO4+H2S↑(不能用浓H2SO4 或硝酸,因为H2S具有强还原性)——H2S是无色、有臭鸡蛋气味的有毒气体;能溶于水,密度比空气略大。
②硫化氢的化学性质A.可燃性:2H2S+O2 点燃2S+2H2O(H2S 过量)2H2S+3O2 点燃2SO2+2H2O (O2 过量)B.强还原性:常见氧化剂Cl 2、Br2、O2、Fe3+、HNO3、KMnO4等,甚至SO2 均可将H2S氧化成S。
C.不稳定性:300℃以上易受热分解③H2S的水溶液叫氢硫酸,是二元弱酸。
3、硫的氧化物(1)二氧化硫:①SO2是无色而有刺激性气味的有毒气体,密度比空气大,容易液化,易溶于水。
②S O2是酸性氧化物,能跟水反应生成亚硫酸,亚硫酸是中强酸。
③S O2有强还原性常见氧化剂(见上)均可与SO2 发生氧化一还原反应如:SO2 + Cl 2 +2H2O == H2SO4 + 2HCl ④SO2也有一定的氧化性2H2S + SO2 == 3S↓ +2H2O ⑤SO2具有漂白性,能跟有色有机化合物生成无色物质(可逆、非氧化还原反应)⑥实验室制法:Na2SO3 + H2SO4(浓)== Na2SO3 + H2O +SO2↑或Cu + 2H2SO4(浓)CuSO4 + 2H 2O + SO2↑(2)三氧化硫:是一种没有颜色易挥发的晶体;具有酸性氧化物的通性,遇水剧烈反应生成硫酸并放出大量的热。
高考化学复习硫单质及其化合物知识点
6.与碱反应
7.有漂白性(与有机色质化合成无色物质,生成的无色物质不太稳定,受热或时日一久便返色)
(三)硫酸性质用途小结
1.强酸性
(1)、与碱反应
(2)、与碱性氧化物反应(除锈;制硫酸铜等盐)
(3)、与弱酸盐反应(制某些弱酸或酸式盐)
硫单质及其化合物知识点的全部内容就是这些,查字典化学网预祝考生可以取得更优异的成绩。
2019年高考第一轮复习备考专题已经新鲜出炉了,专题包含高考各科第一轮复习要点、复习方法、复习计划、复习试题,大家来一起看看吧~。