物质构成的微粒
- 格式:pdf
- 大小:997.58 KB
- 文档页数:10


构成物质的微粒1.微粒的基本性质2.离子(1)定义:带电的原子(或原子团)叫离子。
(2)分类:①阳离子:带正电的原子或原子团,如Na+、Mg2+、NH+4 。
②阴离子:带负电的原子或原子团,如Cl-、O2-、CO2-3 、SO2-4 。
3.原子结构(1)由于质子与核外电子的电量相等、电性相反,故原子呈电中性;(2)原子序数=质子数=核电荷数=核外电子数。
4.原子结构示意图数子电的上层子电层子子原)核质子数相同的原子属于同种元素;原子的最外层电子数决定元素的化学性质,一般来说最外层电子数相同的化学性质相似,但不是一定相似。
注意:氦和镁原子的最外层电子数均为2,但化学性质不相同。
5.相对原子质量(1)定义:以碳-12原子质量的1/12为标准,其他原子的质量跟它相比所得的比值,就是这种原子的相对原子质量,符号为Ar 。
(2)表达式:相对原子质量(Ar )=一个原子的实际质量一个碳-12原子质量的1/12(3)相对原子质量≈质子数+中子数注意:相对原子质量的单位为“1”,省略不写,不是“g ”。
原子原子核核外电子(每个电子带1个单位负电荷)质子(每个质子带1个单位正电荷)中子(不带电)7.化学符号周围数字的意义个子粒数个团子原或子数荷电带所化(1)a :表示有a 个R 粒子(原子、分子、离子)例:2H 表示两个氢原子;2H 2表示两个氢分子;2H +表示两个氢离子。
(2)b :表示一个粒子中含有b 个原子例:CO 2中的“2”表示一个二氧化碳分子中含有2个氧原子。
(3)c :表示一个R 离子带c 个正(或负)电荷例:Mg 2+中的“2”表示一个镁离子带2个单位的正电荷。
(4)d :表示(某化合物中)R 元素的化合价为±d 价例:FeO +2中的“2”表示氧化亚铁中,铁元素的化合价为+2价。
【解题技巧】1. 理解和熟记微粒的基本性质及相关的知识,需要根据所给的问题情景或图表信息等结合所学的知识及自己的生活经验细致地分析推理后,按照题目要求进行解答。

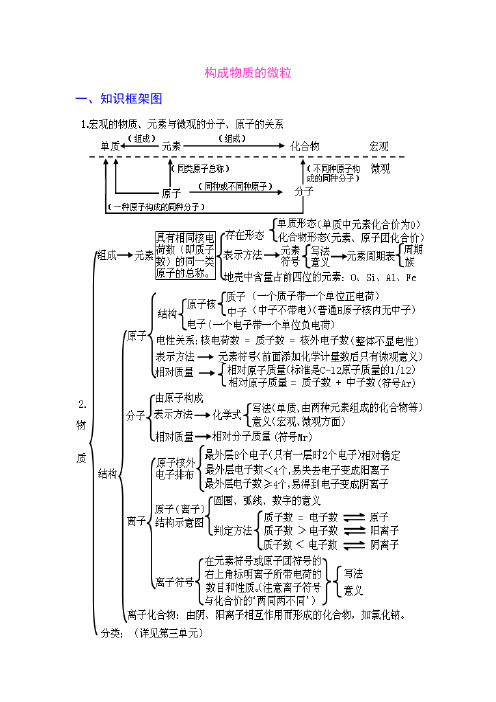
构成物质的微粒一、知识框架图二、学生应该掌握的核心知识构成物质的微粒(一)、概述微观的粒子有:原子、离子、分子、电子、质子等,它们都是微观概念,既表示种类又可表示个数。
分子、原子、离子都是构成物质的粒子。
A 、金属单质和稀有气体由原子直接构成;B 、非金属单质、非金属与非金属形成的化合物由分子构成。
C 、化合物中既有金属元素又有非金属元素的离子化合物是由离子构成。
(二)、分子:分子是保持物质化学性质的最小粒子。
分子由原子构成。
例:1个水分子由2个氢原子和1个氧原子构成A 、分子是构成物质的一种微粒,常见由分子构成的物质:水、氢气、氧气、氮气、二氧化硫、二氧化碳等。
【由分子构成的物质,在物理变化中,分子本身不发生改变;在化学变化中,分子本身发生改变,生成新的分子。
】B 、分子的微观特性:分子总是在不断地运动着;分子之间存在间隔;分子的质量很小。
(三)、原子:1、原子是构成物质的另一种微粒。
原子构成分子,原子也可直接构成物质,如金属汞、稀有气体等。
2、在化学变化中,分子本身发生变化,而原子本身没有变化,只是重新组合成新的分子,构成新的物质,所以,原子是化学变化中的最小粒子。
(注意:原子不是构成物质的最小粒子。
)化学反应的实质:在化学反应中分子分裂为原子,原子重新组合成新的分子。
(四)、相对原子质量:以一种碳原子(碳-12)质量的1/12作为标准,其他原子的质量跟它相比较所得的数值,是该种原子的相对原子质量。
相对原子质量=一个碳原子的质量一个某原子的质量×12 (相对原子质量是个比,单位为1)相对原子质量≈质子数 +中子数 (五)、原子的构成原子的的构成:原子由核外带负电的电子和带正电的原子核构成,原子核由带正电的质子 和不带电的中子构成。
在不显电性的粒子里: 核电荷数=质子数=核外电子数注意:原子不是构成物质的最小粒子。
原子只是化学变化中的最小粒子; 普通氢原子核中只有质子无中子,氢原子的原子核就是一个质子。


第十讲构成物质的微粒元素周期表一、考点梳理知识点一构成物质的微粒1.分子(1)定义:由分子构成的物质,分子是保持其化学性质的最小粒子;(2)构成:分子由原子构成(3)性质:分子的质量和体积都很小;分子总是在不断运动,温度越高,运动越快;分子间有间隔;同种分子构成的物质化学性质相同,不同种分子构成的物质化学性质不同。
(4)分子运动现象的实验探究a.实验装置:b.实验现象:一段时间后,烧杯A中的溶液变红c.解释:烧杯B中浓氨水有挥发性,氨分子运动到烧杯A中与水反应生成了氨水,氨水呈碱性,使酚酞溶液变红d.实验结论:分子在不断运动2.原子(1)定义:化学变化中的最小粒子,即在化学变化中不能再分;(2)构成:原子由原子核和核外电子构成,原子核又由质子和中子构成,一个质子带一个单位正电荷,中子不带电,一个电子带一个单位负电荷;核电荷数=质子数=核外电子数(3)性质:原子的质量和体积都很小;原子总是在不断运动,温度越高,运动越快;原子间有间隔;(4)原子结构示意图(以氯原子为例):第一层最多排2个电子,第二层最多排8个电子,最外层不能超过8个电子。
(5)最外层电子数的应用:最外层电子数是8(氦为2)的是稳定结构;最外层电子数小于4的,易失电子,活泼;最外层电子数大于4的,易得电子,活泼。
(6)相对原子质量≈质子数+中子数(相对原子质量没有单位)3.离子(1)定义:带电的原子或原子团;(2)分类:带正电的原子或原子团叫阳离子,带负电的原子或原子团叫阴离子(3)表示方法:在元素符号的右上角标上离子所带的电荷数及电性,数字在前,正、负号在后;若离子带的电荷数是1,则“1”省略不写;如O 2-; 0H - (4)原子和离子的判断 原子:质子数=核外电子数 阳离子:质子数>核外电子数 阴离子:质子数<核外电子数 知识点二 元素及元素周期表 1.元素(1)定义:质子数(即核电荷数)相同的一类原子的总称。
注:决定元素种类的是质子数(2)地壳中含量居前五位的元素是:氧、硅、铝、铁、钙。
构成物质的微粒有哪些
构成物质的微粒包括原子、分子和离子。
这些微粒是物质的基本组成单位,根据物质的性质和化学结构的不同,它们可以以不同的方式组合和排列。
1. 原子:原子是构成物质的最基本的微粒,是化学元素的基本单位。
每种元素都由一种特定类型的原子组成,其化学性质由其原子的结构和排列决定。
2. 分子:分子是由两个或更多个原子以共价键相连形成的结构单元。
分子可以是同一种元素的原子组成的,也可以是不同元素的原子组成的化合物。
例如,氧气分子(O2)由两个氧原子以共价键连接形成。
3. 离子:离子是由失去或获得一个或多个电子而带有电荷的原子或分子。
正离子是失去了一个或多个电子的,带有正电荷;负离子是获得了一个或多个电子的,带有负电荷。
离子通过离子键相互吸引形成化合物,如氯化钠(NaCl)中的钠离子和氯离子。
这些微粒以不同的方式组合和排列形成各种不同类型的物质,如元素、化合物和混合物。
对于理解物质的性质和行为,以及化学反应的机理和速率等方面都至关重要。
1/ 1。
构成物质的微粒知识点1、 原子的构成(1)质子数=核外电子数=核电荷数=原子序数相对原子质量≈质子数+中子数原子的质量主要集中在原子核上。
三决定:①决定元素种类:质子数(核电荷数)②决定元素化学性质:最外层电子数③决定原子的质量:原子核说明:最外层电子数相同其化学性质不一定都相同(Mg ,He 最外层电子数为2) 最外层电子数不同其化学性质有可能相似(He ,Ne 均为稳定结构)(2)元素性质特别是化学性质与原子核外电子的排布,特别是最外层上的电子数目有密切关系。
最外层具有8个电子(只有一个电子层的具有2个电子)的结构,属于相对稳定结构。
金属元素最外层电子一般少于4个,在反应中易失去电子;非金属元素最外层电子一般等于或多于4个,在反应中易得到电子。
稀有气体最外层电子都是8个电子(氦为2个),属于相对稳定结构。
“小失大得”(3)相对原子质量① 定义:以一种碳原子质量的1/12为标准,其他原子的质量跟它相比所得的值; ② 注意:它不是原子的真实质量;③ 没有单位。
(4)核外电子的排布原子核外电子是分层排布的,可用原子结构示意图简单表示(如下图)。
上图表示的是铝原子的结构——核电荷数为13,核外第一电子层上有2个电子,第二电子层上有8个电子,第三电子层上有3个电子。
(5)核外电子层排布规律:①第一层最多容纳2个电子,第二层最多容纳8个电子,第三层最多容纳18个电子。
②最外层电子层不超过8个,(只有一层的不超过2个)2、元素(1)、定义:具有相同核电荷数(即核内质子数)的一类原子的总称(2)、决定因素:核电荷数或质子数。
注意: *一种元素与另一种元素的本质区别:质子数不同*由同种元素组成的物质不一定是单质,(如由O2、O3组成的混合物或金刚石与石墨的混合物)不可能是化合物。
(3)、特点:只讲种类,不讲个数(4)、地壳中元素居前八位的:氧、硅、铝、铁、钙、钠、钾、镁。
原子原子核(+) 核外电子(-)质子(+) 中子(不带电)生物体中元素居前四位:氧、碳、氢、氮。
专题二 构成物质的微粒【复习目标】1.认识物质的微粒性,知道分子、原子和离子等是构成物质的微粒;能用微粒的观点解释某些常见的现象。
2.知道原子是由原子核和核外电子构成的。
3.知道原子可以结合成分子,同一元素的原子和离子可以相互转化,初步认识核外电子在化学反应中的作用。
【知识要点梳理】一、物质与其构成粒子之间的关系二、认识物质的微粒性1.构成物质的微粒有原子、分子和离子。
它们都能直接构成物质,都属于微观概念。
2.分子(1)定义:分子是保持物质化学性质的最小粒子。
(2)分子的特征: ①分子的体积和质量都很小;②分子在不断地运动。
温度越高,分子运动速率越快。
③分子之间有间隔。
物体热胀冷缩现象,就是物质分子间的间隔受热时增大,遇冷时缩小的缘故。
④同种物质的分子性质相同,不同物质性质不同。
(3)分子的构成:分子由原子构成。
其中同种元素的原子构成单质分子,如:O 2、O 3 、C 60。
不同种元素的原子构成化合物分子。
如:H 2O 、CO 2、H 2O 2 、HCl 等。
3.原子(1)原子的概念:原子是化学变化中的最小粒子。
【注解】原子和分子的本质区别是在化学变化中,分子可以再分,而原子不能再分。
(2)原子的结构:原子是由原子核和核外电子构成的。
原子核一般是由质子和中子构成。
【注解】:①原子中:核电荷数=质子数=核外电子数;②整个原子不显电性(原因是原子核带的正电荷和核外电子带的负电荷电量相等,电性相反)。
③不是所有原子中都含有质子、中子和电子。
如:H 原子中没有中子。
④原子的质量主要集中在原子核上。
所以:相对原子质量≈质子数+中子数。
(3)原子核外电子是分层排布的,可用原子结构示意图简单表示。
【注解】原子结构示意图中各部分含义:圆圈表示原子核;圆圈里的数字表示核电荷数(即质子数);弧线表示电子层;弧线上的数字表示该电子层中的电子数;最后一层上的电子数叫做最外层电子数。
(4元素种类 最外层电子数元素的化学性质 稀有气体 8个(He 为2个) 稳定金属 一般<4个 易失去最外层电子 非金属 一般>4个 易得到电子【注解】4.离子(1)离子的形成:原子得失电子形成离子;(2)概念:带电的原子或原子团叫做离子。