免疫层析标记物及其标记技术
- 格式:pdf
- 大小:1.54 MB
- 文档页数:30

pct免疫层析实验原理PCT(procalcitonin,降钙素原)是一种临床上常用的生物标记物,用于评估感染性疾病的情况。
PCT免疫层析实验是一种常用的检测PCT浓度的方法。
本文将详细介绍PCT免疫层析实验的原理。
PCT是一种由C-AMP基因编码的前降钙素原,是甲状腺C细胞分泌的激素。
在健康人体内,PCT的水平非常低,一般不超过0.1 ng/ml。
然而,在感染性疾病中,炎症反应可以刺激PCT的分泌,导致其浓度显著升高。
PCT的浓度与感染的严重程度有关,因此可以用于判断感染的程度及疾病的预后。
PCT浓度较低时可能是炎症反应的正常生理反应,但是当PCT浓度超过0.5 ng/ml时,通常表示存在严重感染。
此外,PCT浓度还可用于区分病毒感染和细菌感染,对于指导抗生素的使用也具有重要的临床意义。
PCT免疫层析实验是一种常用于检测PCT浓度的方法。
其原理是利用抗体与目标物(PCT)之间的特异性结合来实现检测。
一般来说,PCT免疫层析实验包括以下几个步骤:1.样品处理:将待检测的样品加入试剂盒中,与试剂中的溶剂混合,使样品与试剂中的抗体充分接触。
2.抗体结合:待测样品中的PCT与试剂中的抗体发生特异性结合,形成一个PCT-抗体复合物。
3.免疫层析:将待测样品通过一张免疫层析膜,该膜上含有特定的抗体。
在免疫层析膜的一端,还存在一个检测线(T线),这是由于抗体-抗原结合后,PCT抗原与免疫层析膜上的抗体结合,并迁移到检测线上。
4.定量分析:等待一定时间后,读取结果。
如果在T线上出现了一个明显的颜色线条,则说明样品中存在PCT,并且颜色的强弱可以提示PCT的浓度水平。
PCT免疫层析实验原理的关键在于抗体的特异性。
抗体是由免疫动物(如小鼠)经免疫刺激后产生的。
免疫动物的体内会参与抗原与抗体的结合,从而免疫动物就可以识别出这个抗原。
当该抗体与其专一性的抗原重结合后,就会产生浑浊效应。
通过测定浑浊度的高低,可间接确定抗原的浓度。

时间分辨荧光免疫层析技术原理
时间分辨荧光免疫层析技术(TRFIA)是一种非同位素免疫分析技术,利用
镧系元素标记抗原或抗体,通过时间分辨技术测量荧光。
具体来说,当含有待测抗原(抗体)的样品滴在加样区时,待测样品中的抗原(抗体)与结合垫中的荧光纳米微球标记的抗体(抗原)结合并通过毛细作用向前层析。
当达到检测区后,与检测线上固定的抗体(抗原)结合,形成微粒-抗体-抗原-抗体夹心复合物并被固定在检测线上,而多余的荧光微
球标记物继续向前层析,与固定在质控线上的二抗结合。
反应结束后,用紫外光源(340nm)对检测区扫描检测,检测线和质控线
上荧光纳米微球发出高强度的荧光(615nm),且衰变时间也较长。
通过
测量延缓时间,待样品基质中自然发生的短寿命荧光(1-10ns)全部衰变后,再测量稀土元素的特异性荧光,这样就可以排除非特异本底荧光的干扰。
通过检测线和质控线荧光强度的强弱及其比值,即可分析出样品中待测物的浓度。
这种技术具有高灵敏度、高特异性和可定量分析等特点。
以上内容仅供参考,如需更多信息,建议查阅时间分辨荧光免疫层析相关文献或咨询该领域专家。

纳米颗粒在免疫层析技术中的应用纳米颗粒又称为超微颗粒,是指颗粒大小为1-100nm的粒子。
纳米颗粒具有大的比表面积,从而导致其光、热、磁敏感特性和表面稳定性不同于正常的粒子,因而在生物和医疗领域有广阔的应用前景。
目前已经用于免疫层析标志物的纳米材料包括胶体金、镧系元素、量子点、荧光乳胶、荧光微球、磁珠等几类。
免疫层析技术是通过标记物来得到结果分析信号的,因此,一种灵敏度高、稳定性好的标记物,可以大幅度提高其检测性能。
目前应用和研究的热点主要是胶体金免疫层析技术、荧光免疫层析技术、磁珠免疫层析技术等。
1胶体金免疫层析技术胶体金免疫标记技术是以胶体金作为示踪标志物应用于抗原抗体反应的一种免疫标记技术。
胶体金,又称为胶体纳米金,金纳米颗粒在水溶液中呈胶体状,因此称为胶体金。
胶体金颗粒具有纳米材料所特有的三大效应:表面效应、小尺寸效应和宏观量子隧道效应,具有很大的比表面积,独特的光学、导电、导热等物理特性以及良好的生物相容性,对蛋白质有较强的吸附能力,可以与免疫球蛋白、毒素、酶、糖蛋白、抗生素、激素、牛血清白蛋白、多肽化合物等非共价结合,同时,胶体金具有高电子密度特性,即金标物在相应配体处大量聚集,肉眼可见红色或粉色斑点,因而,目前多用于定性或半定量的快速免疫检测方法。
优点:简单、快速、准确、无污染、检测不依赖昂贵的激光检测仪器,只需普通光学仪器,甚至肉眼即可辨别。
目前,市场上已经有检测各种成分(如各种病原体、标志物等)的胶体金免疫层析试纸条试剂盒。
缺点:这灵敏度不高,主要用于定性或半定量,对一些肿瘤标志物、神经性肽、心血管疾病标志物的检测,其灵敏度是远远不够。
2荧光免疫层析技术荧光纳米材料由于其独特的结构和光、电、磁性质,使其在标记检测方面有着极大的应用价值。
荧光免疫层析技术结合了荧光免疫技术和层析技术的优点,是当前研究的热点2.1 量子点层析技术量子点(QuantumDots,QDs)又称无机纳米半导体晶体,是主要由ⅡB族~ⅥA族(如CdSe,CdTe,CdS,ZnSe等)或ⅢA族~ⅤA族(InP,InAs等)元素构成的能够产生荧光的半导体纳米颗粒。

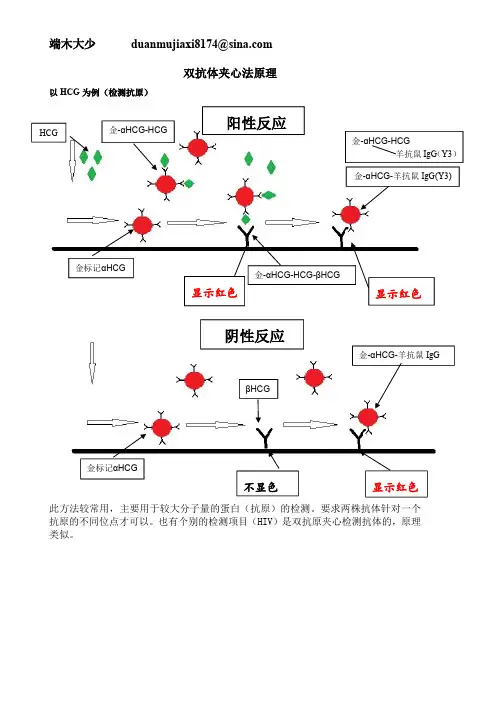
双抗体夹心法原理以HCG 为例(检测抗原)此方法较常用,主要用于较大分子量的蛋白(抗原)的检测。
要求两株抗体针对一个抗原的不同位点才可以。
也有个别的检测项目(HIV)是双抗原夹心检测抗体的,原理类似。
HCG 金标记αHCG 金-αHCG-HCG 金-αHCG-HCG -βHCG金-αHCG -羊抗鼠IgG(Y3)金-αHCG-HCG羊抗鼠IgG (Y3)显示红色显示红色金标记αHCG不显色显示红色金-αHCG -羊抗鼠IgG阴性反应阳性反应βHCG以吗啡为例(检测抗原)此方法主要用于小分子抗原(毒品、农药、肽链等)的检测。
由于抗原分子量小不能直接固定于NC 膜上,常常用化学方法把小分子偶联到BSA 等大分子物质上再固定于NC 膜上。
此结果与双抗原夹心法相反,阴性CT 两条都是红线,阳性只有C 线一条红线,T 线不显色。
金-吗啡抗体-吗啡吗啡-BSA 金标记吗啡抗体显示红色不显色金-吗啡抗体-吗啡羊抗鼠尿液(含吗啡)显示红色显示红色金标记吗啡抗体金-吗啡抗体-羊抗鼠阴性尿液抗体-吗阴性反应阳性反应金标记吗啡抗体-吗啡-BSA乙肝E 抗体为例金标记e 抗体e 抗原e 抗体金标记e 抗体-e 抗原-e 抗体金标记e 抗体-e 抗原-e 抗体-羊抗鼠不显色显示红色金标记e 抗体e 抗原金标记e 抗体-e 抗原金标记e 抗体-e 抗原-e 抗体显示红色显示红色金标记e 抗体-e 抗原羊抗鼠阳性反应阴性反应间接法原理检测抗体此方法主要用于血清中抗体检测,纯化或者重组的抗原固定于NC 膜上,标记多为蛋白A(ProteinA 或叫SPA,与抗体Fc 端结合而与其它蛋白质不结合)或者鼠抗人(如检测为IgM,则标记为鼠抗人IgM)。
此方法要求胶体金过量(待测样品往往含有大量多种抗体,所检测抗体所占份额很小),一般来说样品再加入前需要稀释或者加极少量后再加样品缓冲液。
一般斑点免疫渗滤法使用也是间接法。
显示红色显示红色金标记SPA 目的抗体杂抗体阳性反应抗原杂抗体金标记SPA 抗原不显色显示红色阴性反应。



荧光微球免疫层析原理 trfia荧光微球免疫层析法(TRFIA)是一种高灵敏度、高特异性、容易操作和自动化程度高的免疫分析技术。
TRFIA采用荧光微球作为标记物,通过对微球上特异性抗体和样品中特定抗原的结合进行荧光检测,从而实现对该抗原的检测和定量。
TRFIA的原理与传统的免疫层析法基本相同,但是它采用荧光检测方式,比传统的免疫层析法具有更高的灵敏度和特异性。
荧光微球免疫层析法主要分为荧光微球的制备和修饰、试剂的配制以及荧光微球免疫层析的操作等几个部分。
荧光微球的制备和修饰荧光微球通常由聚合物微球和荧光分子组成。
聚合物微球可以通过乳化聚合、溶剂挥发法、乾燥共沉淀法、凝胶聚合、微波聚合等方法制备。
荧光分子则是一种具有荧光特性的化合物,可以将荧光分子与聚合物微球表面的官能团进行共价修饰得到。
通常荧光微球的表面会修饰一定量的活性官能团,如羧酸、氨基、疏水基团等,以便于进行进一步的修饰。
比如,荧光微球表面修饰具有特异性的抗体、酶、核酸等生物大分子,从而用于特异性的检测和定量抗原、抗体等生物分子。
试剂的配制TRFIA试剂包括荧光微球悬液、标准品、稀释液和样品等。
其中荧光微球悬液需要根据不同的试剂盒和具体实验要求来进行配制。
标准品根据需要,可以选择进口标准品、自制标准品等,以确保标准品具有较高的纯度和稳定性。
稀释液通常是一种可以增加检测敏感性的缓冲液,如PBS、BSA溶液等。
样品包括体液、组织、细胞等等。
与传统免疫层析法相似的是,TRFIA试剂的配制需要严格控制稀释倍数、样品加入量等因素,以确保实验结果的可靠性和准确性。
荧光微球免疫层析的操作荧光微球免疫层析的操作步骤较为简单,包括:添加标准品和样品、加入荧光微球悬液、荧光检测和数据处理等。
在实验操作的过程中,需要注意荧光微球悬液的均匀悬浮和标准品与样品的混匀等因素,以确保实验结果的精确性和稳定性。
1. 高灵敏度:荧光微球标记物的灵敏度较高,可以在低浓度的样品中进行检测。

免疫层析标记一步法和二步法的区别
免疫层析是一种常用的蛋白质检测方法,常用于检测蛋白质的存在、定量以及相互作用。
免疫层析标记一步法和二步法的主要区别在于抗原与抗体之间是否可以提前结合。
1. 一步法:在免疫层析一步法中,待测样品中的抗原与标记有机化合物(比如酶,荧光剂等)提前结合,形成抗原-标记物
复合物。
然后,复合物会与被固定在凝胶上的抗体结合,并在凝胶上显示出对应的带状条纹。
这种方法更简便、快速,适用于定性分析。
2. 二步法:在免疫层析二步法中,先在凝胶上固定抗原,然后将待测样品添加到凝胶上,使抗原与抗体结合。
此后,增加一个标记有机化合物与结合在凝胶上的抗原-抗体复合物发生反应,形成标记的复合物。
这种方法更复杂,但适用于定量分析,因为标记物的量可以与复合物的量成正比关系。
总结起来,免疫层析标记一步法是先将抗原与标记物结合,再与抗体进行反应;而免疫层析标记二步法是先与抗体结合,再加入标记物与复合物进行反应。

免疫层析试剂结构
免疫层析试剂是一种利用天然或人工制备的抗体或抗原选择性地结合
其相对应的抗原或抗体的化学试剂,用于检测或纯化目标蛋白质或分
子的技术。
在免疫层析过程中,靶分子通过和特异性抗体结合来进行
分离和检测。
因此,免疫层析试剂具有特异性和敏感性的优点,被广
泛应用于生物化学、医学、生命科学等领域中。
免疫层析试剂结构包括以下几个主要组成部分:固相载体、抗体或抗原、标记物、缓冲液和其他添加剂。
固相载体是免疫层析试剂的核心部分之一,它是一个固定的基质,用
于固定抗体或抗原。
目前常用的固相载体主要有丙烯酰胺凝胶、硅胶、纳米金颗粒等材料。
这些固相载体具有不同的特点和应用,可根据实
验要求选择不同的固相载体。
抗体和抗原是免疫层析试剂的另一个主要组成部分。
抗体和抗原之间
的特异性结合是免疫层析的关键步骤。
抗体和抗原的制备是一项复杂
的工作,常用的方法包括动物免疫、滴度蓝染色法等。
标记物是一种用于标记抗体或抗原的化学物质,广泛应用于免疫层析
试剂中。
标记物的选择也是实验设计中的一个重要环节,常用的标记
物有发光素酶、放射性同位素、发光材料等。
缓冲液和其他添加剂是免疫层析试剂中必不可少的组成部分,它们可调节pH值、离子强度、渗透压、抗氧化剂、保护剂等,提高试剂稳定性和灵敏度。
总体来说,免疫层析试剂的结构是一个复杂的体系,其中各组分之间相互协作,共同完成特定的生物化学功能。
研究免疫层析试剂的结构和优化其中的组成部分,能够提高免疫层析试剂的效率和稳定性,实现更为精准和高效的分离和检测。
保护层
玻璃纤维
纸
GICT
猪痢疾
胶体金试剂条实验操作
•样品制备:
•组织样品处理:按常规方法取病变组织器官制成1:2(W/V )组织悬液,反复冻融3次后,离心,上清液即为待
测样品。
•肛拭子处理:按常规方法处理即可。
•实验步骤:
•将密封袋打开,取出试纸条。
•取40ul 待检样本加在试纸条/板的•加样区,在加样区滴加1滴稀释液。
•
30分钟内观察并记录试验结果。
•结果判断:
•阳性结果:观察窗T 、C 线均出现一条紫红色条带。
•阴性结果:观察窗仅C 线出现一条紫红色条带。
•无效结果:观察窗未出现紫红色条带。
谢!Thank you!。