二氧化硫的化学性质。
- 格式:doc
- 大小:32.00 KB
- 文档页数:2


二氧化硫的性质及应用二氧化硫,化学式为SO2,是一种无色、有刺激性气味的气体。
它广泛存在于自然界中,并在许多工业和商业应用中发挥着关键作用。
然而,由于其具有某些有害特性,二氧化硫的排放也引起了环境和健康问题。
一、二氧化硫的性质二氧化硫是由硫和氧组成的化合物,化学式为SO2。
它是一种无色、有刺激性的气体,在常温下易溶于水。
二氧化硫的分子结构使其具有多种化学性质,包括氧化性、还原性和酸性。
二、二氧化硫的应用1、工业用途二氧化硫在工业中应用广泛。
首先,它被广泛用于纸浆和纸张的漂白。
其次,二氧化硫也是制造硫酸和其他化学物质的重要原料。
此外,二氧化硫还用于制造肥料、橡胶制品和食品加工。
2、食品添加剂在食品工业中,二氧化硫被用作防腐剂和抗氧化剂,以延长食品的保质期。
它还被用于制作一些特定的食品,如葡萄酒和啤酒,以保持其口感和质量。
3、生物医学应用在生物医学领域,二氧化硫也被用于多种应用。
例如,它被用于制作一些药物和生物试剂,以及用于治疗某些疾病。
此外,二氧化硫也被用于消毒和清洁医疗设备。
三、二氧化硫的排放和环境影响尽管二氧化硫在某些应用中具有重要作用,但其排放也带来了环境和健康问题。
二氧化硫的排放主要来自燃煤和石油燃烧,以及一些工业过程。
这些排放可能导致酸雨和其他环境问题。
因此,许多国家和地区都实施了严格的环保法规,以限制二氧化硫的排放。
四、结论二氧化硫是一种具有重要应用的有害气体。
尽管其应用广泛,但其排放也带来了环境和健康问题。
因此,我们需要继续研究和开发更环保的替代品和技术,以减少二氧化硫的排放和对环境的影响。
对于现有的二氧化硫应用,我们也需要采取适当的措施来减少其对环境和人类健康的影响。
“二氧化硫的性质”教学设计一、教材分析二氧化硫是高中化学硫及其化合物的性质一节中安排的重要内容之一,是高中化学重要的基本概念和理论的重要组成部分,也是高考必考的重要内容之一。
本节课不仅具有很强的基础性,而且其理论性和实用性都很强,对于强化学生的环境保护意识,加强对大气污染的防治有着重要的意义。



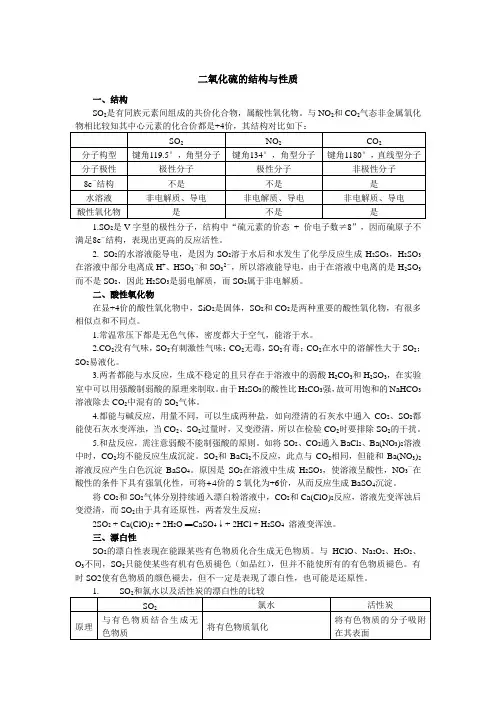
二氧化硫的结构与性质一、结构SO2是有同族元素间组成的共价化合物,属酸性氧化物。
与NO2和CO2气态非金属氧化物相比较知其中心元素的化合价都是+4价,其结构对比如下:SO2NO2CO2分子构型键角119.5°,角型分子键角134°,角型分子键角1180°,直线型分子分子极性极性分子极性分子非极性分子8e-结构不是不是是水溶液非电解质、导电非电解质、导电非电解质、导电酸性氧化物是不是是1.SO2是V字型的极性分子,结构中“硫元素的价态+ 价电子数≠8”,因而硫原子不满足8e-结构,表现出更高的反应活性。
2. SO2的水溶液能导电,是因为SO2溶于水后和水发生了化学反应生成H2SO3,H2SO3在溶液中部分电离成H+、HSO3-和SO32-,所以溶液能导电,由于在溶液中电离的是H2SO3而不是SO2,因此H2SO3是弱电解质,而SO2属于非电解质。
二、酸性氧化物在显+4价的酸性氧化物中,SiO2是固体,SO2和CO2是两种重要的酸性氧化物,有很多相似点和不同点。
1.常温常压下都是无色气体,密度都大于空气,能溶于水。
2.CO2没有气味,SO2有刺激性气味;CO2无毒,SO2有毒;CO2在水中的溶解性大于SO2;SO2易液化。
3.两者都能与水反应,生成不稳定的且只存在于溶液中的弱酸H2CO3和H2SO3,在实验室中可以用强酸制弱酸的原理来制取。
由于H2SO3的酸性比H2CO3强,故可用饱和的NaHCO3溶液除去CO2中混有的SO2气体。
4.都能与碱反应,用量不同,可以生成两种盐,如向澄清的石灰水中通入CO2、SO2都能使石灰水变浑浊,当CO2、SO2过量时,又变澄清,所以在检验CO2时要排除SO2的干扰。
5.和盐反应,需注意弱酸不能制强酸的原则。
如将SO2、CO2通入BaCl2、Ba(NO3)2溶液中时,CO2均不能反应生成沉淀。
SO2和BaCl2不反应,此点与CO2相同,但能和Ba(NO3)2溶液反应产生白色沉淀BaSO4。


二氧化硫、三氧化硫和硫酸的性质一、二氧化硫(SO)2)物理性质1.二氧化硫(SO2二氧化硫是一种具有强烈刺激性的无色气体。
其液化点(或沸点)在常压下为-10.1℃,分子量是64.06,密度2.9266g/l,冰点-75.48℃,沸点-10.02℃,溶解度在20℃时10.55gSO2/100gH2O(就是说100水在20℃时可以溶解10.55gSO2)。
二氧化硫气体对人体是有害的:吸入二氧化硫会刺激呼吸道、引起鼻咽腔发炎、气管炎、支气管炎。
如果人体长时期经常受SO2作用,则可发生慢性呼吸道炎症和坏齿症,因此,现行卫生规范只允许在操作场所的空气中存在很少量的SO2——不超过0.02g/m³。
为了达到这样的条件,在硫酸车间中,设备要密封,通风要良好。
按化学反应式计算,每制造1吨H2SO4需SO2:1000×64÷98=653.1kg1000×22.4÷98=228.6Nm3其中:1000——1吨=1000kg64——SO2的摩尔质量,单位:kg/kmol98——H2SO4的摩尔质量,单位:kg/kmol 在现代的硫酸装置中,SO2用率约为93~97%((平均95%);进入转化系统的气体中SO2的含量一般为7%~9%((体积百分)。
因此,每吨硫酸所需要的二氧化硫气体为:228.6×100÷0.95(7~9)=3437~2674Nm3生成硫酸时,每两个体积SO2需要一个体积的O2。
这就是说:由上述进入系统的气体生成一吨硫酸时,要消耗228.6m3的SO2和114.3m3的氧,即共消耗343m3。
其余的气体经过制酸系统后,即排到大气中去。
2.二氧化硫(SO2)的化学性质和用途①关于SO2的热分解温度,有1200℃和1700℃等说法。
②把SO2和H2的混合物加热,则生成S、H2S和H2O。
SO2+3H2=2H2O+H2S+216.9kJH2S同SO2作用生成S。

一、介绍二氧化硫和漂白粉的化学性质二氧化硫(SO2)是一种无色有刺激性气体,常见于燃烧过程中产生的烟气中。
它具有强烈的还原性,可以与许多其他化合物发生化学反应。
漂白粉(Ca(OCl)2)是一种常用的氧化剂,也被用作漂白剂和消毒剂。
它具有强氧化性,与许多有机和无机物质都可以发生化学反应。
二、二氧化硫和漂白粉的化学方程式二氧化硫和漂白粉可以发生化学反应,产生硫酸钙和氯化钠。
其化学方程式如下所示:SO2 + Ca(OCl)2 → CaSO4 + 2NaCl三、反应过程的解释1. 二氧化硫与漂白粉作用时,二氧化硫很容易被漂白粉中的氯气氧化成硫酸钙,而漂白粉自身则还原成氯化钠。
2. 在这个反应过程中,二氧化硫起到了还原剂的作用,而漂白粉则起到了氧化剂的作用。
四、反应的影响因素1. 反应速率:二氧化硫和漂白粉的反应速率取决于它们的浓度、温度和反应物之间的接触方式。
通常来说,浓度越高、温度越高,反应速率越快。
2. 反应条件:在酸性条件下,二氧化硫对漂白粉的氧化作用更为明显。
而在碱性条件下,二氧化硫对漂白粉的氧化作用会减弱。
五、反应的应用1. 环境保护:二氧化硫是一种常见的工业废气排放物,其对人体和环境均有害。
漂白粉可以被用来净化含有二氧化硫的烟气,减少二氧化硫的排放,保护环境。
2. 食品消毒:漂白粉常被用作食品消毒剂,可以有效地杀灭细菌和真菌。
当漂白粉与含有二氧化硫的食品发生反应时,也能有效地去除其中的二氧化硫,提高食品的质量和安全性。
六、反应机理的深入探讨在二氧化硫和漂白粉的化学反应过程中,涉及到了复杂的化学机理。
二氧化硫是一种弱酸性物质,它在水中可以形成亚硫酸(H2SO3),而亚硫酸又可以进一步氧化为硫酸(H2SO4)。
漂白粉中的活性氯也具有强氧化性,可以与水反应生成次氯酸(HClO),而次氯酸也可以进一步解离产生氯离子(Cl-)和氢离子(H+)。
二氧化硫和漂白粉的反应机理可以在水中进行更为深入的探讨。
当二氧化硫与漂白粉作用时,二氧化硫气体首先溶解在水中形成亚硫酸:SO2 + H2O → H2SO3漂白粉中的活性氯也在水中形成次氯酸:Ca(OCl)2 + H2O → 2HOCl + Ca(OH)2随后,亚硫酸进一步与次氯酸反应,生成硫酸钙和氯离子:2H2SO3 + 2HOCl → CaSO4 + 2H2O + 2Cl-漂白粉中的氧化钠也与二氧化硫反应生成氯化钠和硫酸钙:3Ca(OH)2 + 2SO2 → 3CaSO3 + 3H2OCaSO3 + 2HOCl → CaSO4 + 2H2O + 2Cl-整个反应过程可以分解为多个步骤,包括二氧化硫的溶解、亚硫酸和次氯酸的生成,以及最终生成硫酸钙和氯化钠的过程。
第六章第二节二氧化硫第二课时
教学重、难点:二氧化硫的化学性质。
教学过程:
1、1872年,美国化学家Smith,首先提出了“酸雨”一词,直到本世纪四十年代,酸雨问题才引起人们的广泛关注。
2、1972年6月5日,具有历史意义的人类环境会议在瑞典首都斯德哥尔摩召开,通过了著名的《人类环境宣言》,并确定每年6月5日为“世界环境日”。
从1974年起,每年由联合国环境规划署确定一个主题,开展“世界环境日”的活动,其中1983年的主题是防治酸雨。
3、1985年,几场酸雨过后,我国四川奉节县9万亩华山松全部枯死,重庆南山2.7万亩马尾松死亡过半。
提出问题:酸雨的危害如此之大,造成酸雨的罪魁祸首是谁呢?——是二氧化硫,今天我们共同讨论关于二氧化硫的问题。
教师板书:第二节二氧化硫
演示实验:收集一试管二氧化硫气体,将其倒置在水槽中,晃动试管。
学生活动:观察SO2气体的颜色、状态;闻气体的气味;分析SO2的水溶性。
教师引导:二氧化硫的其它物理性质如何?请同学结合已有知识,阅读课本158页第二段。
学生活动:略。
教师板书:
教师引导:二氧化硫溶于水后是否与水反应?
演示实验:将充有水的试管倒立过来,向其中滴入几滴紫色石蕊试液。
学生活动:观察、分析实验现象。
书写相应的化学方程式。
教师板书:化学性质
教师引导:看来,作为酸性氧化物来说,SO2可以与水作用,生成亚硫酸。
但亚硫酸不稳定,容易分解,请同学书写有关化学方程式。
教师引导:我们把两个化学方程式放在一起观察,你发现什么?
学生活动:是可逆反应。
符合条件:同时、同条件。
教师引导:看来化学方程式应写为:SO2 + H2O H2SO3(学生完成)作为酸性氧化物,除了和水反应,生成相应的酸外,还可以和哪类物质反应?
学生回答:碱。
教师引导:了解二氧化硫的这些性质后,请同学讨论如何收集二氧化硫?
学生讨论:侧重易溶于水、比空气重、有毒三个方面。
教师小结:向上排空气法,用蓝色石蕊试纸检验,同时配上NaOH溶液尾气吸收。
刚才我们讨论的反应,化合价前后没有发生变化,请同学标出SO2中硫元素的化合价,分析可能具有什么样的性质?
教师板书:
教师引导:[录像]二氧化硫和氧气反应的实验。
请同学写出反应的化学方程式。
分析二氧化硫在此处作氧化剂还是还原剂?
学生活动:还原性2SO2 + O2 SO3
教师设问:如果2molSO2 与1molO2在上述条件下充分反应,能否得到2molSO3?
教师过渡:生成的SO3为无色固体,和SO2在性质上有明显不同,但它们都是酸性氧化物,都能溶与水生成相应的酸。
SO2作为氧化剂,又能发生什么样的反应?请同学推测SO2和H2S反应的生成物,尝试写出反应的化学方程式,并分析电子得失状况。
教师引导:我们刚刚讲过的O3,还有HClO、Na2O2等都是强氧化剂,具有漂白性;SO2氧化性较弱,能漂白吗?
演示实验:[实验6-2]
教师引导:能漂白,但不持久(而O3 、HClO、Na2O2的漂白具有永久性)看来它们的作用原理不同。
SO2不是氧化性漂白,仅仅是SO2与有色物质结合生成不稳定的无色物质,同时又容易分解,恢复原来有色物质的颜色。
教师板书:漂白性
教师引导:SO2在日常生活中有一定用处,但它的危害性也非同小可(出示云岗石窟明信片)。
山西是产煤大省,空气中SO2含量超标。
请同学利用所学知识,讨论如何回收SO2,防止大气污染?(先阅读160页有关内容,再进行讨论)
教师结课:望大家在未来的环保工作中大显身手。
布置作业:161页一题、二题、三题。
板书设计:。