二氧化硫化学性质
- 格式:ppt
- 大小:600.00 KB
- 文档页数:82


二氧化硫的性质教案设计一、教学目标1.知识目标:了解二氧化硫的基本性质,包括化学性质、物理性质和常见用途。
2.能力目标:能够描述二氧化硫的化学反应,并能够解释其常见用途的原理。
3.情感目标:培养学生对环境保护的意识,使其明白二氧化硫的排放对环境的危害。
二、教学内容1.二氧化硫的化学性质:酸性、氧化性、还原性、稳定性以及与水和碱的反应等。
2.二氧化硫的物理性质:无色无味的气体、可溶于水、冰点较低等。
3.二氧化硫的常见用途:工业用途、农业用途和生活用途。
三、教学过程设计1.导入(5分钟)引导学生回顾上一节课学习的相关知识,例如基本气体的性质和特点,以及化学反应中的酸碱反应和氧化还原反应。
2.概念讲解(15分钟)介绍二氧化硫的化学性质、物理性质和常见用途。
结合示意图或实验观察结果,向学生简单解释相关概念,例如二氧化硫的酸性反应、氧化反应和还原反应等。
3.实验演示(15分钟)展示一些与二氧化硫相关的实验,如二氧化硫与水和碱的反应、二氧化硫与金属的反应等。
通过实验演示,让学生亲眼观察到二氧化硫的性质和反应过程。
4.学生练习(20分钟)分发练习册,让学生完成相关的练习题。
练习题可以包括选择题、填空题和解答题等不同难度的题目,以检验学生对二氧化硫性质的理解和掌握程度。
5.拓展延伸(20分钟)让学生自主查阅资料,了解二氧化硫在工业、农业和生活中的具体应用。
学生可以以小组报告的形式展示他们所了解的相关知识。
同时,引导学生思考二氧化硫的排放对环境的影响,从而培养他们的环境保护意识。
6.归纳总结(10分钟)向学生提供一个归纳总结的机会,回顾本节课所学的知识点,并梳理二氧化硫的性质和应用。
7.课堂小结(5分钟)教师进行课堂小结,概括本节课的重点和难点,并预告下一节课的内容。
四、教学评价方法1.课堂表现评价:根据学生在课堂上的积极参与程度、回答问题的准确性和实验操作的规范性等指标进行评价。
2.练习题评价:根据学生在练习册上的答题情况,评估学生对二氧化硫性质的理解和掌握程度。

二氧化硫的性质及应用二氧化硫,化学式为SO2,是一种无色、有刺激性气味的气体。
它广泛存在于自然界中,并在许多工业和商业应用中发挥着关键作用。
然而,由于其具有某些有害特性,二氧化硫的排放也引起了环境和健康问题。
一、二氧化硫的性质二氧化硫是由硫和氧组成的化合物,化学式为SO2。
它是一种无色、有刺激性的气体,在常温下易溶于水。
二氧化硫的分子结构使其具有多种化学性质,包括氧化性、还原性和酸性。
二、二氧化硫的应用1、工业用途二氧化硫在工业中应用广泛。
首先,它被广泛用于纸浆和纸张的漂白。
其次,二氧化硫也是制造硫酸和其他化学物质的重要原料。
此外,二氧化硫还用于制造肥料、橡胶制品和食品加工。
2、食品添加剂在食品工业中,二氧化硫被用作防腐剂和抗氧化剂,以延长食品的保质期。
它还被用于制作一些特定的食品,如葡萄酒和啤酒,以保持其口感和质量。
3、生物医学应用在生物医学领域,二氧化硫也被用于多种应用。
例如,它被用于制作一些药物和生物试剂,以及用于治疗某些疾病。
此外,二氧化硫也被用于消毒和清洁医疗设备。
三、二氧化硫的排放和环境影响尽管二氧化硫在某些应用中具有重要作用,但其排放也带来了环境和健康问题。
二氧化硫的排放主要来自燃煤和石油燃烧,以及一些工业过程。
这些排放可能导致酸雨和其他环境问题。
因此,许多国家和地区都实施了严格的环保法规,以限制二氧化硫的排放。
四、结论二氧化硫是一种具有重要应用的有害气体。
尽管其应用广泛,但其排放也带来了环境和健康问题。
因此,我们需要继续研究和开发更环保的替代品和技术,以减少二氧化硫的排放和对环境的影响。
对于现有的二氧化硫应用,我们也需要采取适当的措施来减少其对环境和人类健康的影响。
“二氧化硫的性质”教学设计一、教材分析二氧化硫是高中化学硫及其化合物的性质一节中安排的重要内容之一,是高中化学重要的基本概念和理论的重要组成部分,也是高考必考的重要内容之一。
本节课不仅具有很强的基础性,而且其理论性和实用性都很强,对于强化学生的环境保护意识,加强对大气污染的防治有着重要的意义。

H2S(硫化氢)和SO2(二氧化硫)都是常见的气体,它们在化学性质和环境影响方面有所不同。
硫化氢(H2S):
- 是一种无色、有臭鸡蛋味的气体。
- 在水中溶解性高,可以形成酸性溶液。
- 是一种弱酸,其酸性弱于硫酸(H2SO4)和盐酸(HCl)。
- 在高温高压下可以转化为液态或固态。
- 是一种有毒气体,对人体和环境都有害。
高浓度的硫化氢对人体有致命危险,可以导致窒息和严重的健康问题。
二氧化硫(SO2):
- 是一种无味、有刺激性气味的气体,在较高浓度下有刺鼻的味道。
- 在水中溶解性较好,可以形成亚硫酸(H2SO3)。
- 是一种弱酸,其酸性弱于硫酸和盐酸。
- 在常温常压下以气态存在。
- 也是有毒气体,对人体和环境有害。
长期暴露于高浓度的二氧化硫可能导致呼吸问题和其他健康问题。
在环境污染方面,硫化氢和二氧化硫都是污染物,它们可以来自于工业过程,如石油和天然气的提取、加工,以及金属的提炼。
这两种气体都有严格的排放标准,以减少对环境和人类健康的危害。
在工业应用中,硫化氢常用作还原剂,而二氧化硫则用于脱硫过程,以减少燃烧过程中产生的酸性气体排放。
在处理这些气体时,需要采取适当的安全措施,以防止人员伤害和环境污染。

二氧化硫燃点二氧化硫是一种常见的气体,具有刺激性气味和剧毒性。
它在工业生产和日常生活中都有广泛的应用,但同时也带来了一些安全隐患。
本文将从不同角度介绍二氧化硫的燃点及相关内容。
一、二氧化硫的基本性质和应用二氧化硫(SO2)是一种无色、刺激性气味的气体,密度大于空气。
它具有较好的溶解性,在水中可以形成亚硫酸(H2SO3),具有一定的酸性。
二氧化硫是燃烧过程中产生的一种气体,也是工业生产中重要的原料之一。
它广泛应用于制造硫酸、漂白剂、杀菌剂等,并被用于食品、纸张、化工等行业。
二、二氧化硫的燃点及相关安全性问题二氧化硫的燃点是指其能够燃烧的最低温度。
由于二氧化硫是一种易燃气体,其燃点较低,只需达到315摄氏度即可引发燃烧。
二氧化硫的燃烧产生的火焰呈蓝色,燃烧时会产生大量的热量和有毒气体,对人体和环境都具有一定的危害。
三、二氧化硫燃烧的影响因素二氧化硫的燃烧受到多种因素的影响,包括温度、氧气浓度、燃烧物质等。
其中,温度是影响二氧化硫燃烧的最主要因素。
一般来说,温度越高,燃烧速率越快。
此外,燃烧物质的种类和浓度也会对燃烧产生影响,不同的物质在燃烧过程中会产生不同的反应。
四、二氧化硫燃烧的安全措施由于二氧化硫燃烧产生的热量和有毒气体对人体和环境都具有一定的危害,因此在使用和储存二氧化硫时需要采取一定的安全措施。
首先,要确保存储环境通风良好,避免二氧化硫积聚;其次,要避免二氧化硫与易燃物质接触,以防止燃烧事故的发生;同时,在生产过程中应加强安全培训,提高员工的安全意识。
五、二氧化硫燃烧事故的防范和应对在工业生产和日常生活中,燃烧事故是一种常见的安全隐患。
为了防范和应对二氧化硫燃烧事故,需要采取一系列的措施。
首先,要建立健全的安全管理制度,加强对二氧化硫的储存和使用的监管;其次,在生产过程中要进行严格的操作控制,确保操作人员的安全;同时,要加强事故应急演练,提高应急处理的能力。
六、二氧化硫燃烧对环境的影响二氧化硫燃烧产生的烟尘和有毒气体对环境会产生一定的影响。

so2和so3物理化学性质⼆氧化硫的物理和化学性质⼀、物理性质1、⼆氧化硫是⼀种具有强烈刺激性的⽆⾊⽓体⽆⾊⽓体。
其液化点(或沸点)在常压下为-10.1°C;临界温度为157。
2°C;临界压⼒为764.92×104Pa。
其他性质相见下表:项⽬单位数值(条件)分⼦量64.06⽐重 2.264(空⽓=1)密度g/L 2.9266(0°C)冰点°C -75.48沸点°C -10.02熔化点J/mol 7.3986蒸发热J/mol 24.9128分⼦容积ml 44(沸点)介电常数13.8(14.5°C)电导率S 4×10-8(-10°C)粘度Pa·s0.0399(0°C)溶解度g SO2/100gH2O(20°C)10.552、在不同温度下,⼆氧化硫的溶解度:22 g/100ml (0°C)15 g/100ml (10°C)11 g/100ml (20°C)9.4 g/100 ml (25 °C)8 g/100ml (30°C)6.5 g/100ml (40 °C)5 g/100ml (50°C)4 g/100ml (60°C)3.5 g/100ml (70 °C)3.4 g/100ml (80 °C)3.5 g/100ml (90 °C)3.7 g/100ml (100 °C)3、⼆氧化硫⽓体对⼈体是有害的。
吸⼊⼆氧化硫会刺激呼吸道、引起⿐咽腔发炎、⽓管炎、⽀⽓管炎。
⼆、化学性质1、SO2和H2的混合加热,则⽣成S、H2S和H2O。
SO2+ 3H2=2H2O+H2S+216.9KJH2S同SO2作⽤⽣成S。
2H2S + SO2=2H2O+3S2、⼆氧化硫可以在硫磺燃烧的条件下⽣成:S(s) +O2(g) = SO2(g)3、硫化氢可以燃烧⽣成⼆氧化硫2H2S(g) + 3O2(g) = 2H2O(g) + 2SO2(g)4、加热硫铁矿,闪锌矿,硫化汞,可以⽣成⼆氧化硫4FeS2(s) + 11O2(g) = 2Fe2O3(s) + 8SO2(g)2ZnS(s) + 3O2(g) = 2ZnO(s) + 2SO2(g)HgS(s) + O2(g) = Hg(g) + SO2(g)5、SO2和O2在完全⼲燥的状态下是很难以起反应的。
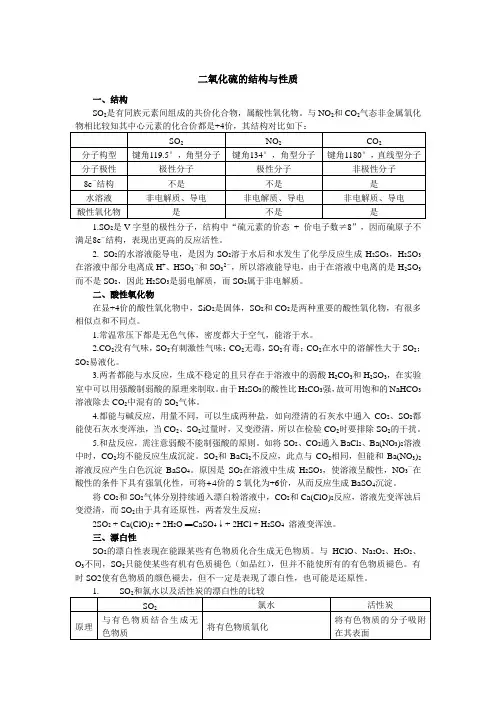
二氧化硫的结构与性质一、结构SO2是有同族元素间组成的共价化合物,属酸性氧化物。
与NO2和CO2气态非金属氧化物相比较知其中心元素的化合价都是+4价,其结构对比如下:SO2NO2CO2分子构型键角119.5°,角型分子键角134°,角型分子键角1180°,直线型分子分子极性极性分子极性分子非极性分子8e-结构不是不是是水溶液非电解质、导电非电解质、导电非电解质、导电酸性氧化物是不是是1.SO2是V字型的极性分子,结构中“硫元素的价态+ 价电子数≠8”,因而硫原子不满足8e-结构,表现出更高的反应活性。
2. SO2的水溶液能导电,是因为SO2溶于水后和水发生了化学反应生成H2SO3,H2SO3在溶液中部分电离成H+、HSO3-和SO32-,所以溶液能导电,由于在溶液中电离的是H2SO3而不是SO2,因此H2SO3是弱电解质,而SO2属于非电解质。
二、酸性氧化物在显+4价的酸性氧化物中,SiO2是固体,SO2和CO2是两种重要的酸性氧化物,有很多相似点和不同点。
1.常温常压下都是无色气体,密度都大于空气,能溶于水。
2.CO2没有气味,SO2有刺激性气味;CO2无毒,SO2有毒;CO2在水中的溶解性大于SO2;SO2易液化。
3.两者都能与水反应,生成不稳定的且只存在于溶液中的弱酸H2CO3和H2SO3,在实验室中可以用强酸制弱酸的原理来制取。
由于H2SO3的酸性比H2CO3强,故可用饱和的NaHCO3溶液除去CO2中混有的SO2气体。
4.都能与碱反应,用量不同,可以生成两种盐,如向澄清的石灰水中通入CO2、SO2都能使石灰水变浑浊,当CO2、SO2过量时,又变澄清,所以在检验CO2时要排除SO2的干扰。
5.和盐反应,需注意弱酸不能制强酸的原则。
如将SO2、CO2通入BaCl2、Ba(NO3)2溶液中时,CO2均不能反应生成沉淀。
SO2和BaCl2不反应,此点与CO2相同,但能和Ba(NO3)2溶液反应产生白色沉淀BaSO4。


二氧化硫(SO2)的基本性质【SO 2的物理性质】又名亚硫酐,为无色有强烈辛辣刺激味的不可燃性有毒气体。
分子量64.07,密度2.3g/L,溶点-72.7℃,沸点-10℃。
溶于水、甲醇、乙醇、硫酸、醋酸、氯仿和乙醚。
易与水混合,生成亚硫酸 (H 2SO 3),随后转化为硫酸。
在室温及392.266~490.3325kPa(4~5kg/cm 2)压强下为无色流动液体。
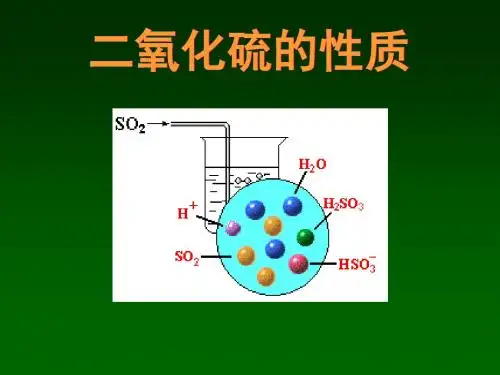
【SO 2的化学性质】1.与水反应二氧化硫与水发生了化学反应,生成了酸性物质。
二氧化硫为酸性氧化物。
SO 2 + H 2O = H 2SO 32.弱氧化性2H 2S + SO 2 = 3S + 2H 2O3.还原性2SO 2 3 5SO 2 24 = 2MnSO 4 + 2MnSO 4 + K 2SO 42SO 2 + Cl 2 = H 2SO 4 + 2HCl4.漂白性二氧化硫能使红色品红溶液褪色,当加热时,溶液又重新变成红色。
【职业接触】燃烧含硫燃料、熔炼硫化矿石、烧制硫磺、制造硫酸和亚硫酸、硫化橡胶、制冷、漂白、消毒、熏蒸杀虫、镁冶炼、石油精炼、某些有机合成等作业工人和有关人员皆有可能接触。
另外,它是常见的工业废气及大气污染的成分。
【二氧化硫对人体的危害】二氧化硫是大气中主要污染物之一,是衡量大气是否遭到污染的重要标志。
在我国的一些城镇,大气中二氧化硫的危害较为普遍而又严重。
二氧化硫进入呼吸道后,因其易溶于水,故大部分被阻滞在上呼吸道,在湿润的粘膜上生成具有腐蚀性的亚硫酸、硫酸和硫酸盐,使刺激作用增强。
上呼吸道的平滑肌因有末梢神经感受器,遇刺激就会产生窄缩反应,使气管和支气管的管腔缩小,气道阻力增加。
上呼吸道对二氧化硫的这种阻留作用,在一定程度上可减轻二氧化硫对肺部的刺激。
但进入血液的二氧化硫仍可通过血液循环抵达肺部产生刺激作用。
二氧化硫可被吸收进入血液,对全身产生毒副作用,它能破坏酶的活力,从而明显地影响碳水化合物及蛋白质的代谢,对肝脏有一定的损害。
二氧化硫1. 简介二氧化硫(SO2)是一种常见的无机化合物,由硫和氧原子组成。
它是一种可燃的气体,具有刺激性气味和有毒性。
二氧化硫广泛应用于工业生产、环境监测和医药领域。
2. 分子量二氧化硫(SO2)的分子量是64克/摩尔。
为了计算分子量,我们需要知道硫和氧的原子量。
硫的原子量是32,氧的原子量是16。
因此,分子量可以通过硫和氧的原子量相加来得出。
3. 物理性质二氧化硫是一种无色气体,在常温下具有刺鼻的味道。
它有低沸点和高溶解度。
二氧化硫可以溶于水中,形成二氧化硫溶液。
在高浓度下,二氧化硫能够直接液化为液体。
4. 化学性质二氧化硫是一种强还原剂,与氧气发生反应可以产生二氧化硫。
它可以与氢氧化物反应,形成硫酸盐。
二氧化硫还可以与许多其他元素和化合物反应,如金属、水和有机化合物。
5. 应用领域5.1 工业生产二氧化硫被广泛应用于工业生产过程中。
它可以用于制造硫酸、亚硫酸和二硫化硫。
二氧化硫也是一种重要的催化剂,在石油和化工行业中用于促进化学反应。
5.2 环境监测二氧化硫是大气污染物中的一种关键物质。
它是燃烧化石燃料和工业过程中产生的主要气体排放物之一。
因此,监测和控制二氧化硫的排放非常重要。
二氧化硫的浓度可以通过空气质量监测站和传感器进行监测。
5.3 医药领域二氧化硫在医药领域有多种应用。
它可以用作药物的防腐剂和增稠剂。
二氧化硫还在药物合成中起到重要的作用,可以用于氧化和硫化反应。
6. 健康影响6.1 对人体的影响高浓度的二氧化硫对人体健康有害。
长时间暴露于高浓度二氧化硫的环境中可能导致呼吸道问题,如气喘、呼吸困难和咳嗽。
另外,二氧化硫还可能对眼睛和皮肤造成刺激。
6.2 对环境的影响二氧化硫是大气污染物之一,对环境有害。
高浓度的二氧化硫可以导致酸雨的形成,对植物和动物造成伤害。
它还可以对水体产生不良影响,导致水体酸化,破坏水生生物的栖息地。
7. 环境保护和控制为了保护人类健康和环境,控制和减少二氧化硫的排放至关重要。
1.二氧化硫的性质(1)物理性质二氧化硫为无色、有刺激性气味的有毒气体,密度比空气大,易液化,易溶于水。
(2)化学性质①二氧化硫是酸性氧化物,具有酸性氧化物的一切通性:SO2+H2O H2SO3;SO2+CaO=CaSO3;SO2+2NaOH=Na2SO3+H2O;SO2+NaOH=NaHSO3;SO2+H2O+Na2S=Na2SO3+H2S (酸性:H2SO3>H2S);SO2+NaHCO3=NaHSO3+CO2 (酸性:H2SO3>H2CO3);SO2+2NaHCO3=Na2SO3+2CO2+H2O (SO2量不足时)。
②氧化性:SO2+2H2S=3S+2H2O (气体或溶液中均可进行)③还原性:能被Cl2、Br2、I2、Fe3+、KMnO4、HNO3等强氧化剂氧化生成SO42-。
例如:SO2+X2+2H2O=H2SO4+2HX (X=Cl、Br、I)④漂白性:SO2和Cl2虽都有漂白性,但漂白原理和现象有不同的特点。
氯气的漂白原理是由于氯气溶于水生成次氯酸具有强氧化性,将有色物质氧化成无色物质,褪色后不能恢复到原来的颜色。
而SO2是由于它溶于水生成的亚硫酸与有色物质直接结合,形成不稳定的无色化合物,褪色后在一定的条件下又能恢复原来的颜色。
如:另外,SO2能使溴水、氯水、KMnO4溶液等褪色,这是因为SO2具有还原性的缘故,如:SO2+Br2+2H2O=H2SO4+2HBr。
2.三氧化硫SO3为无色、易挥发的晶体,熔点16.8℃,沸点44.8℃,溶于水剧烈反应并放出大量热:SO3+H2O=H2SO4。
SO3的工业制法:2SO2+O 22SO3H2SO4的制法:SO3+H2O=H2SO4SO3是酸性氧化物,它跟碱性氧化物或碱都能反应生成硫酸盐。
SO3+2NaHSO3=Na2SO4+2SO2↑+H2O (除SO2中的SO3)SO3中硫元素处于最高价态,故三氧化硫具有较强的氧化性。
3.二氧化硫的污染(1)空气中硫的氧化物和氮的氧化物随雨水降下就成为酸雨,酸雨的pH<5.6。
二氧化硫褪色原理二氧化硫是一种常见的化学物质,它在许多工业和日常生活中都有着重要的用途。
然而,人们在使用二氧化硫的过程中常常会遇到一个问题,那就是它会褪色一些物质,比如纸张、织物等。
那么,二氧化硫褪色的原理是什么呢?首先,我们需要了解二氧化硫的化学性质。
二氧化硫是一种无色气体,它具有较强的还原性。
在空气中,二氧化硫可以与氧气发生反应,生成二氧化硫和水的化学方程式为,SO2 + O2 → SO3。
这个化学方程告诉我们,二氧化硫在一定条件下能够与氧气反应,产生二氧化硫三。
而二氧化硫三是一种强氧化剂,它可以氧化许多有机物质,使它们失去颜色。
其次,我们需要了解二氧化硫褪色的具体过程。
当含有二氧化硫的气体接触到某些有机物质时,二氧化硫三会与这些有机物质发生氧化反应。
这些有机物质中的色素分子会被氧化,从而失去了原本的颜色。
这就是二氧化硫褪色的基本原理。
另外,二氧化硫褪色的过程还受到许多因素的影响。
首先是温度,温度越高,二氧化硫的氧化作用就越强,褪色效果也就越明显。
其次是湿度,湿度越大,空气中的氧气含量就越高,二氧化硫的氧化作用也就越强。
此外,二氧化硫的浓度、接触时间等因素也会对褪色效果产生影响。
总的来说,二氧化硫褪色是一种化学反应,它是二氧化硫与有机物质发生氧化反应的结果。
这种褪色原理的了解,有助于我们在生产和生活中更好地利用二氧化硫,避免不必要的褪色现象的发生。
同时,也为我们提供了一种新的褪色方法,可以在染料工业、纸张工业等领域得到应用。
在实际应用中,我们可以根据二氧化硫褪色原理,采取一些措施来减少褪色现象的发生。
比如,在纸张工业中,可以在生产过程中控制二氧化硫的浓度和温度,以减少对纸张的影响。
在染料工业中,可以选择一些不容易受二氧化硫氧化的染料,来减少褪色现象的发生。
综上所述,二氧化硫褪色原理是一种化学反应,它是二氧化硫与有机物质发生氧化反应的结果。
了解这一原理有助于我们更好地利用二氧化硫,并采取措施减少褪色现象的发生。
二氧化硫1.复习重点1.二氧化硫的物理性质、化学性质。
2.重点是二氧化硫的氧化性、还原性、漂白性。
2.难点聚焦一、二氧化硫的物理性质无色、有刺激性气味的有毒气体;密度比空气大;易溶于水(1∶40);(可用于进行喷泉实验,如SO2、HCl、NH3)易液化(-10℃)二、二氧化硫的化学性质1、酸性氧化物能和碱反应生成盐和水:SO2+2NaOH===Na2SO3+H2O能与水反应生成相应的酸:SO2+H2O===H2SO3(二氧化硫的水溶液使紫色石蕊试液变红)二氧化硫溶于水形成的亚硫酸只能存在于溶液中,它很不稳定,容易分解成水和二氧化硫,故二氧化硫溶于水的反应是可逆反应。
SO2+H2O H2SO3SO 2与CO2性质的比较名称CO2SO2与H2O反应CO2+H2O H2CO3SO2+H2O H2SO3与碱反应CO2+2NaOH===Na2CO3+H2OCO2+NaOH===NaHCO3CO2+Ca(OH)2===CaCO3↓+H2OSO2+2NaOH===Na2SO3+H2OSO2+NaOH===NaHSO3SO2+Ca(OH)2===CaSO3↓+H2O与盐反应CO2+CaCO3+H2O===Ca(HCO3)2CaSO3+SO2+H2O===Ca(HSO3)22、氧化性:SO2气体通过氢硫酸,溶液变浑浊,有淡黄色不溶物出现。
SO2+2H 2S===3S↓+2H 2O 3、还原性:SO2使溴水和高锰酸钾溶液褪色SO2+Br2+2H 2O=== H2SO4+2HBr5SO2+2KMnO4+2H2O===K2SO4+2MnSO4+2H2SO42SO2+O2 2 SO3(SO3+H2O===H2SO4,SO3是无色固体SO3是一种无色固体,熔点是,沸点也只有℃,易溶于水,溶于水时放出大量的热。
)4、漂白性:SO2使品红溶液褪色SO2能使某些有色物质褪色,是由于二氧化硫可跟某些有色物质化合成无色物质,而化合成的无色物质却是不稳定的,易分解而恢复原来有色物质的颜色。