二氧化硫化学性质
- 格式:ppt
- 大小:642.50 KB
- 文档页数:15

二氧化硫的性质及应用二氧化硫,化学式为SO2,是一种无色、有刺激性气味的气体。
它广泛存在于自然界中,并在许多工业和商业应用中发挥着关键作用。
然而,由于其具有某些有害特性,二氧化硫的排放也引起了环境和健康问题。
一、二氧化硫的性质二氧化硫是由硫和氧组成的化合物,化学式为SO2。
它是一种无色、有刺激性的气体,在常温下易溶于水。
二氧化硫的分子结构使其具有多种化学性质,包括氧化性、还原性和酸性。
二、二氧化硫的应用1、工业用途二氧化硫在工业中应用广泛。
首先,它被广泛用于纸浆和纸张的漂白。
其次,二氧化硫也是制造硫酸和其他化学物质的重要原料。
此外,二氧化硫还用于制造肥料、橡胶制品和食品加工。
2、食品添加剂在食品工业中,二氧化硫被用作防腐剂和抗氧化剂,以延长食品的保质期。
它还被用于制作一些特定的食品,如葡萄酒和啤酒,以保持其口感和质量。
3、生物医学应用在生物医学领域,二氧化硫也被用于多种应用。
例如,它被用于制作一些药物和生物试剂,以及用于治疗某些疾病。
此外,二氧化硫也被用于消毒和清洁医疗设备。
三、二氧化硫的排放和环境影响尽管二氧化硫在某些应用中具有重要作用,但其排放也带来了环境和健康问题。
二氧化硫的排放主要来自燃煤和石油燃烧,以及一些工业过程。
这些排放可能导致酸雨和其他环境问题。
因此,许多国家和地区都实施了严格的环保法规,以限制二氧化硫的排放。
四、结论二氧化硫是一种具有重要应用的有害气体。
尽管其应用广泛,但其排放也带来了环境和健康问题。
因此,我们需要继续研究和开发更环保的替代品和技术,以减少二氧化硫的排放和对环境的影响。
对于现有的二氧化硫应用,我们也需要采取适当的措施来减少其对环境和人类健康的影响。
“二氧化硫的性质”教学设计一、教材分析二氧化硫是高中化学硫及其化合物的性质一节中安排的重要内容之一,是高中化学重要的基本概念和理论的重要组成部分,也是高考必考的重要内容之一。
本节课不仅具有很强的基础性,而且其理论性和实用性都很强,对于强化学生的环境保护意识,加强对大气污染的防治有着重要的意义。


二氧化硫百科名片中文名称:二氧化硫化学式:SO2 相对分子质量:64.06 化学品类别:酸性气体是否管制:否目录展开编辑本段化学品简介管制信息本品不受管制名称中文名称:二氧化硫中文别名:亚硫酸酐英文别名: Sulfur Dioxide编码信息技术说明书编码: 41CAS No.: 7446-09-5EINECS号: 231-195-2InChI: InChI=1/O2S/c1-3-2编辑本段结构SO2是一个弯曲的分子,其对称点群为C2v。
硫原子的氧化态为+4,形式电荷为0,被5个电子对包围着,因此可以描述为超价分子。
从分子轨道理论的观点来看,可以认为这些价电子大部分都参与形成S-O键。
二氧化硫的三种共振结构色态常温下为无色有刺激性气味的有毒气体熔点-72.4℃(200.75K)沸点-10℃(263K)物理性质无色,常温下为无色有刺激性气味的有毒气体,密度比空气大,易液化,易溶于水(约为1:40)化学性质二氧化硫可以在硫磺燃烧的条件下生成S(s) +O2(g) =点燃= SO2(g)硫化氢可以燃烧生成二氧化硫2H2S(g) + 3O2(g) ==点燃= 2H2O(g) + 2SO2(g)加热硫铁矿,闪锌矿,硫化汞,可以生成二氧化硫二氧化硫漂白品红溶液4FeS2(s) + 11O2(g) === 2Fe2O3(s) + 8SO2(g)2ZnS(s) + 3O2(g) === 2ZnO(s) + 2SO2(g)HgS(s) + O2(g) === Hg(g) + SO2(g)应用:用于生产硫以及作为杀虫剂、杀菌剂、漂白剂和还原剂。
在大气中,二氧化硫会氧化而成硫酸雾或硫酸盐气溶胶,是环境酸化的重要前驱物。
大气中二氧化硫浓度在0.5ppm以上对人体已有潜在影响;在1~3ppm 时多数人开始感到刺激;在400~500ppm时人会出现溃疡和肺水肿直至窒息死亡。
二氧化硫与大气实验步骤中的烟尘有协同作用。
当大气中二氧化硫浓度为0.21ppm,烟尘浓度大于0.3mg/lL,可使呼吸道疾病发病率增高,慢性病患者的病情迅速恶化。

二氧化硫(SO2)的基本性质【SO 2的物理性质】又名亚硫酐,为无色有强烈辛辣刺激味的不可燃性有毒气体。
分子量64.07,密度2.3g/L,溶点-72.7℃,沸点-10℃。
溶于水、甲醇、乙醇、硫酸、醋酸、氯仿和乙醚。
易与水混合,生成亚硫酸 (H 2SO 3),随后转化为硫酸。
在室温及392.266~490.3325kPa(4~5kg/cm 2)压强下为无色流动液体。
【SO 2的化学性质】1.与水反应二氧化硫与水发生了化学反应,生成了酸性物质。
二氧化硫为酸性氧化物。
SO 2 + H 2O = H 2SO 32.弱氧化性2H 2S + SO 2 = 3S + 2H 2O3.还原性2SO 2 3 5SO 2 24 = 2MnSO 4 + 2MnSO 4 + K 2SO 42SO 2 + Cl 2 = H 2SO 4 + 2HCl4.漂白性二氧化硫能使红色品红溶液褪色,当加热时,溶液又重新变成红色。
【职业接触】燃烧含硫燃料、熔炼硫化矿石、烧制硫磺、制造硫酸和亚硫酸、硫化橡胶、制冷、漂白、消毒、熏蒸杀虫、镁冶炼、石油精炼、某些有机合成等作业工人和有关人员皆有可能接触。
另外,它是常见的工业废气及大气污染的成分。
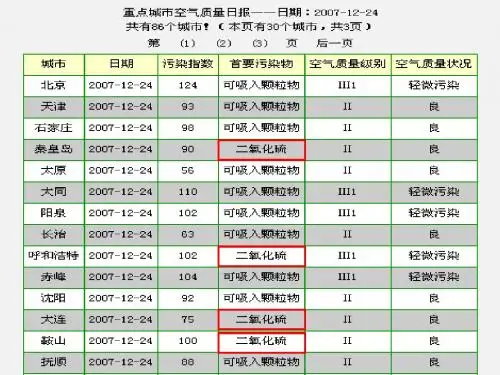
【二氧化硫对人体的危害】二氧化硫是大气中主要污染物之一,是衡量大气是否遭到污染的重要标志。
在我国的一些城镇,大气中二氧化硫的危害较为普遍而又严重。
二氧化硫进入呼吸道后,因其易溶于水,故大部分被阻滞在上呼吸道,在湿润的粘膜上生成具有腐蚀性的亚硫酸、硫酸和硫酸盐,使刺激作用增强。
上呼吸道的平滑肌因有末梢神经感受器,遇刺激就会产生窄缩反应,使气管和支气管的管腔缩小,气道阻力增加。
上呼吸道对二氧化硫的这种阻留作用,在一定程度上可减轻二氧化硫对肺部的刺激。
但进入血液的二氧化硫仍可通过血液循环抵达肺部产生刺激作用。
二氧化硫可被吸收进入血液,对全身产生毒副作用,它能破坏酶的活力,从而明显地影响碳水化合物及蛋白质的代谢,对肝脏有一定的损害。


二氧化硫的性质和作用一、二氧化硫的物理性质SO2是色、气味的有毒气体,溶于水。
二、二氧化硫的化学性质1. 氧化物(具有酸性氧化物的通性,与二氧化碳的性质相似)(1)与水的反应化学方程式:(2)SO2与生石灰反应的化学方程式(3)与碱的反应往NaOH溶液中通入少量SO2往NaOH溶液中通入少量SO2分析与澄清石灰水的反应现象:2.漂白性,有漂白作用。
漂白原理:与氯气漂白原理的区别:3.+4价的硫元素有一定的还原性...为主。
...和氧化性....,但以还原性二氧化硫或亚硫酸可以和氧气、氯气、溴、碘、Fe3+、H2O2、HNO3、酸性高锰酸钾等强氧化剂反应,但和浓硫酸不反应......。
【学生分析】书写部分化学方程式三、二氧化硫的作用1.酸雨:pH小于的降水(包括雨、雪、霜、雾、雹、霰等)形成过程:2.酸雨的危害。
[课堂练习]某校化学兴趣小组同学在某城市采集了酸雨样品,每隔一段时间用pH计测该雨水样品的pH,所得数据如下:为什么雨水的pH随时间而发生变化?根据表中的数据分析和你已有的知识经验判断二氧化硫是怎样影响雨水的pH的?3.防治方法:①用新型的能源(氢能、太阳能、核能);②对含硫燃料进行脱硫处理;③对释放出SO2废气进行处理回收利用;等等[课堂练习]1.你认为减少酸雨产生的途径可以采取的措施是()①少用煤做燃料;②把工厂的烟囱造高;③燃料脱硫;④在已经酸化的土壤中加石灰;⑤开发新能源。
A.①②③B.②③④⑤C.①③⑤D.①②④⑤2.湿润的氯气和二氧化硫皆可做漂白剂,若用两者(1:1) 一起漂白一种物质时,漂白效果会()A. 增强B. 不变C. 减弱D. 难确定3.下列气体中,溶于水后,生成物是一种强酸的是( )A.SO2B.SO3C.CO2D.Cl24.除去CO2中混有的少量SO2气体,最好选用的试剂是( )A.澄清石灰水B.品红溶液C.溴水D.饱和NaHCO3溶液课后练习1.下列实验用来证明SO2的存在,其中正确的是()A.能使品红褪色,加热后又出现红色B.能使湿润的蓝色石蕊试纸变红C .通入足量的NaOH 溶液中,再滴入BaCl 2溶液有白色沉淀生成,该沉淀溶于稀盐酸D .通入稀溴水中能使溴水褪色,得澄清溶液,再滴加Ba(NO 3)2溶液有白色沉淀,该沉淀不溶于硝酸。


二氧化硫(SO2)的基本性质【SO 2的物理性质】又名亚硫酐,为无色有强烈辛辣刺激味的不可燃性有毒气体。
分子量64.07,密度2.3g/L,溶点-72.7℃,沸点-10℃。
溶于水、甲醇、乙醇、硫酸、醋酸、氯仿和乙醚。
易与水混合,生成亚硫酸 (H 2SO 3),随后转化为硫酸。
在室温及392.266~490.3325kPa(4~5kg/cm 2)压强下为无色流动液体。
【SO 2的化学性质】1.与水反应二氧化硫与水发生了化学反应,生成了酸性物质。
二氧化硫为酸性氧化物。
SO 2 + H 2O = H 2SO 32.弱氧化性2H 2S + SO 2 = 3S + 2H 2O3.还原性2SO 2 3 5SO 2 24 = 2MnSO 4 + 2MnSO 4 + K 2SO 42SO 2 + Cl 2 = H 2SO 4 + 2HCl4.漂白性二氧化硫能使红色品红溶液褪色,当加热时,溶液又重新变成红色。
【职业接触】燃烧含硫燃料、熔炼硫化矿石、烧制硫磺、制造硫酸和亚硫酸、硫化橡胶、制冷、漂白、消毒、熏蒸杀虫、镁冶炼、石油精炼、某些有机合成等作业工人和有关人员皆有可能接触。
另外,它是常见的工业废气及大气污染的成分。
【二氧化硫对人体的危害】二氧化硫是大气中主要污染物之一,是衡量大气是否遭到污染的重要标志。
在我国的一些城镇,大气中二氧化硫的危害较为普遍而又严重。
二氧化硫进入呼吸道后,因其易溶于水,故大部分被阻滞在上呼吸道,在湿润的粘膜上生成具有腐蚀性的亚硫酸、硫酸和硫酸盐,使刺激作用增强。
上呼吸道的平滑肌因有末梢神经感受器,遇刺激就会产生窄缩反应,使气管和支气管的管腔缩小,气道阻力增加。
上呼吸道对二氧化硫的这种阻留作用,在一定程度上可减轻二氧化硫对肺部的刺激。
但进入血液的二氧化硫仍可通过血液循环抵达肺部产生刺激作用。
二氧化硫可被吸收进入血液,对全身产生毒副作用,它能破坏酶的活力,从而明显地影响碳水化合物及蛋白质的代谢,对肝脏有一定的损害。

1.二氧化硫的性质(1)物理性质二氧化硫为无色、有刺激性气味的有毒气体,密度比空气大,易液化,易溶于水。
(2)化学性质①二氧化硫是酸性氧化物,具有酸性氧化物的一切通性:SO2+H2O H2SO3;SO2+CaO=CaSO3;SO2+2NaOH=Na2SO3+H2O;SO2+NaOH=NaHSO3;SO2+H2O+Na2S=Na2SO3+H2S (酸性:H2SO3>H2S);SO2+NaHCO3=NaHSO3+CO2 (酸性:H2SO3>H2CO3);SO2+2NaHCO3=Na2SO3+2CO2+H2O (SO2量不足时)。
②氧化性:SO2+2H2S=3S+2H2O (气体或溶液中均可进行)③还原性:能被Cl2、Br2、I2、Fe3+、KMnO4、HNO3等强氧化剂氧化生成SO42-。
例如:SO2+X2+2H2O=H2SO4+2HX (X=Cl、Br、I)④漂白性:SO2和Cl2虽都有漂白性,但漂白原理和现象有不同的特点。
氯气的漂白原理是由于氯气溶于水生成次氯酸具有强氧化性,将有色物质氧化成无色物质,褪色后不能恢复到原来的颜色。
而SO2是由于它溶于水生成的亚硫酸与有色物质直接结合,形成不稳定的无色化合物,褪色后在一定的条件下又能恢复原来的颜色。
如:另外,SO2能使溴水、氯水、KMnO4溶液等褪色,这是因为SO2具有还原性的缘故,如:SO2+Br2+2H2O=H2SO4+2HBr。
2.三氧化硫SO3为无色、易挥发的晶体,熔点16.8℃,沸点44.8℃,溶于水剧烈反应并放出大量热:SO3+H2O=H2SO4。
SO3的工业制法:2SO2+O 22SO3H2SO4的制法:SO3+H2O=H2SO4SO3是酸性氧化物,它跟碱性氧化物或碱都能反应生成硫酸盐。
SO3+2NaHSO3=Na2SO4+2SO2↑+H2O (除SO2中的SO3)SO3中硫元素处于最高价态,故三氧化硫具有较强的氧化性。
3.二氧化硫的污染(1)空气中硫的氧化物和氮的氧化物随雨水降下就成为酸雨,酸雨的pH<5.6。
H2S(硫化氢)和SO2(二氧化硫)都是常见的气体,它们在化学性质和环境影响方面有所不同。
硫化氢(H2S):
- 是一种无色、有臭鸡蛋味的气体。
- 在水中溶解性高,可以形成酸性溶液。
- 是一种弱酸,其酸性弱于硫酸(H2SO4)和盐酸(HCl)。
- 在高温高压下可以转化为液态或固态。
- 是一种有毒气体,对人体和环境都有害。
高浓度的硫化氢对人体有致命危险,可以导致窒息和严重的健康问题。
二氧化硫(SO2):
- 是一种无味、有刺激性气味的气体,在较高浓度下有刺鼻的味道。
- 在水中溶解性较好,可以形成亚硫酸(H2SO3)。
- 是一种弱酸,其酸性弱于硫酸和盐酸。
- 在常温常压下以气态存在。
- 也是有毒气体,对人体和环境有害。
长期暴露于高浓度的二氧化硫可能导致呼吸问题和其他健康问题。
在环境污染方面,硫化氢和二氧化硫都是污染物,它们可以来自于工业过程,如石油和天然气的提取、加工,以及金属的提炼。
这两种气体都有严格的排放标准,以减少对环境和人类健康的危害。
在工业应用中,硫化氢常用作还原剂,而二氧化硫则用于脱硫过程,以减少燃烧过程中产生的酸性气体排放。
在处理这些气体时,需要采取适当的安全措施,以防止人员伤害和环境污染。
二氧化硫燃点二氧化硫是一种常见的气体,具有刺激性气味和剧毒性。
它在工业生产和日常生活中都有广泛的应用,但同时也带来了一些安全隐患。
本文将从不同角度介绍二氧化硫的燃点及相关内容。
一、二氧化硫的基本性质和应用二氧化硫(SO2)是一种无色、刺激性气味的气体,密度大于空气。
它具有较好的溶解性,在水中可以形成亚硫酸(H2SO3),具有一定的酸性。
二氧化硫是燃烧过程中产生的一种气体,也是工业生产中重要的原料之一。
它广泛应用于制造硫酸、漂白剂、杀菌剂等,并被用于食品、纸张、化工等行业。
二、二氧化硫的燃点及相关安全性问题二氧化硫的燃点是指其能够燃烧的最低温度。
由于二氧化硫是一种易燃气体,其燃点较低,只需达到315摄氏度即可引发燃烧。
二氧化硫的燃烧产生的火焰呈蓝色,燃烧时会产生大量的热量和有毒气体,对人体和环境都具有一定的危害。
三、二氧化硫燃烧的影响因素二氧化硫的燃烧受到多种因素的影响,包括温度、氧气浓度、燃烧物质等。
其中,温度是影响二氧化硫燃烧的最主要因素。
一般来说,温度越高,燃烧速率越快。
此外,燃烧物质的种类和浓度也会对燃烧产生影响,不同的物质在燃烧过程中会产生不同的反应。
四、二氧化硫燃烧的安全措施由于二氧化硫燃烧产生的热量和有毒气体对人体和环境都具有一定的危害,因此在使用和储存二氧化硫时需要采取一定的安全措施。
首先,要确保存储环境通风良好,避免二氧化硫积聚;其次,要避免二氧化硫与易燃物质接触,以防止燃烧事故的发生;同时,在生产过程中应加强安全培训,提高员工的安全意识。
五、二氧化硫燃烧事故的防范和应对在工业生产和日常生活中,燃烧事故是一种常见的安全隐患。
为了防范和应对二氧化硫燃烧事故,需要采取一系列的措施。
首先,要建立健全的安全管理制度,加强对二氧化硫的储存和使用的监管;其次,在生产过程中要进行严格的操作控制,确保操作人员的安全;同时,要加强事故应急演练,提高应急处理的能力。
六、二氧化硫燃烧对环境的影响二氧化硫燃烧产生的烟尘和有毒气体对环境会产生一定的影响。
二氧化硫(SO2)是一种无色、有强烈刺激性气味的有毒气体,密度比空气大,易液化。
其熔点为-72.7℃,沸点为-10℃。
这意味着在常温常压下,二氧化硫是一种气态物质。
二氧化硫的分子量为64.07,相对密度为2.264(0℃)。
在338.32kPa 下,二氧化硫在水中的溶解度大约为8.5%(25℃),这表示在每100毫升的水中,可以溶解约8.5毫升的二氧化硫。
此外,二氧化硫还易溶于甲醇和乙醇,也可以溶于硫酸、乙酸、氯仿和乙醚等有机溶剂。
二氧化硫的熔点之所以较低,是因为其分子间的相互作用力较弱。
在固态时,二氧化硫分子之间的排列比较松散,分子间的相互作用力不足以使它们紧密地结合在一起,因此熔点较低。
而当二氧化硫转变为液态或气态时,分子间的距离增大,相互作用力减弱,因此熔点和沸点也相对较低。
二氧化硫在工业上有着广泛的应用,主要用于制造硫酸、亚硫酸盐、硫代硫酸盐等化学品。
此外,二氧化硫也被用作漂白剂、还原剂和防腐剂等。
然而,二氧化硫也是一种空气污染物,大量排放会对环境和人类健康造成负面影响。
总的来说,二氧化硫的熔点是其物理性质之一,与其分子结构和相互作用力密切相关。
了解二氧化硫的物理和化学性质,有助于我们更好地理解和应用这种重要的化合物。