判断几何构型
- 格式:doc
- 大小:31.50 KB
- 文档页数:1

几何构型的判断方法一、引言几何构型是指由几何图形或形状组成的特定模式或结构。
在几何学中,判断几何构型的方法多种多样。
本文将介绍几种常见的几何构型判断方法,包括对称性、相似性、共线性、垂直性和平行性等。
二、对称性判断方法对称性是指物体或图形在某个轴线或平面上具有镜像对称的特性。
判断对称性的方法主要有以下几种:1. 轴对称法:通过寻找轴线来判断图形是否具有对称性。
如果图形可以沿某条直线折叠后两部分完全重合,则该图形是轴对称的。
2. 中心对称法:通过寻找中心点来判断图形是否具有对称性。
如果图形的每个点关于中心点对称,则该图形是中心对称的。
3. 线对称法:通过寻找线段来判断图形是否具有对称性。
如果图形的每个点关于一条线段对称,则该图形是线对称的。
三、相似性判断方法相似性是指两个图形在形状上具有相似比例关系的特性。
判断相似性的方法主要有以下几种:1. 角度相等法:如果两个图形的对应角度相等,则它们是相似的。
2. 边长比例法:如果两个图形的对应边长之比相等,则它们是相似的。
3. 直角边比例法:如果两个直角三角形的斜边比相等,则它们是相似的。
四、共线性判断方法共线性是指三个或更多个点在同一条直线上的特性。
判断共线性的方法主要有以下几种:1. 三点共线法:如果三个点在同一条直线上,则它们是共线的。
2. 共线向量法:如果两个向量共线,则它们所表示的点也是共线的。
3. 斜率相等法:如果两条直线的斜率相等,则它们是共线的。
五、垂直性判断方法垂直性是指两条直线或线段之间的相互垂直关系。
判断垂直性的方法主要有以下几种:1. 斜率互为负倒数法:如果两条直线的斜率互为负倒数,则它们是垂直的。
2. 两条直线的乘积为-1法:如果两条直线的斜率的乘积为-1,则它们是垂直的。
3. 两条线段的内积为0法:如果两个线段的向量的内积为0,则它们是垂直的。
六、平行性判断方法平行性是指两条直线或线段之间的相互平行关系。
判断平行性的方法主要有以下几种:1. 斜率相等法:如果两条直线的斜率相等,则它们是平行的。




结构化学题库与答案(9)《结构化学》第五章习题5001 NF 3和NH 3分⼦中,键⾓∠FNF ⽐∠HNH 要(a ),这是因为(b )。
5002 写出下列分⼦的结构式(标明单键和多重键等键型)和⽴体构型:(1) Al 2Cl 6 ,(2) HN 3 ,(3) Fe(CO)3(η4- C 4H 4) ,(4) XeOF 4 ,(5) XeF 4 5003 NH 3和PH 3分⼦键⾓值⼤者为___________________分⼦。
5004 ⽤价电⼦对互斥理论推断: PF 4+的构型为_________________,中⼼原⼦采⽤的杂化轨道为_____________________: XeF 4的构型为___________________,中⼼原⼦采⽤的杂化轨道为________________________。
5005 写出下述分⼦中中⼼原⼦的杂化⽅式及分⼦的⼏何构型:HgCl 2_________________: Co(CO)4-__________________:BF 3___________________: Ni(CN)42-__________________。
5006 sp 2(s ,p x ,p y )等性杂化轨道中,若1ψ和x 轴平⾏,2ψ和y 轴成30°,1ψ,2ψ,3ψ互成120°。
请写出满⾜正交归⼀化条件的三个杂化轨道表达式:1ψ______________________________:2ψ______________________________:3ψ______________________________。
5007 O 3的键⾓为116.8°,若⽤杂化轨道ψ=c 1s 2ψ+c 2p 2ψ描述中⼼O 原⼦的成键轨道,试按键⾓与轨道成分关系式cos θ=-c 12/c 22,计算:(1) 成键杂化轨道中c 1和c 2值;(2) ψ2s 和ψ2p 轨道在杂化轨道ψ中所占的⽐重。
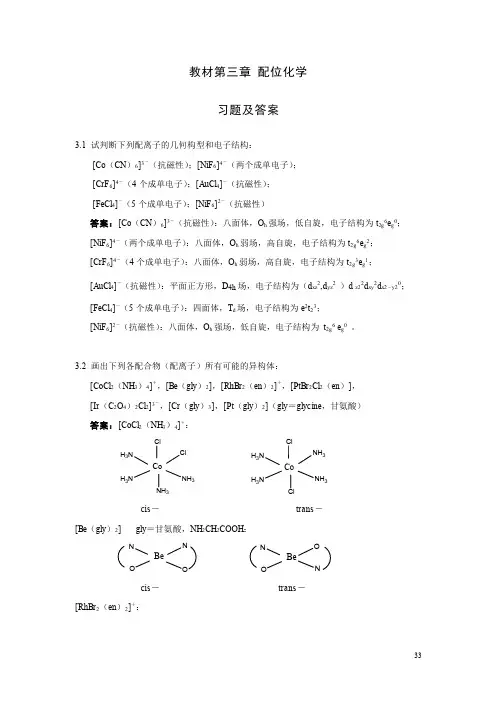
教材第三章 配位化学习题及答案3.1 试判断下列配离子的几何构型和电子结构:[Co (CN )6]3-(抗磁性);[NiF 6]4-(两个成单电子); [CrF 6]4-(4个成单电子);[AuCl 4]-(抗磁性); [FeCl 4]-(5个成单电子);[NiF 6]2-(抗磁性)答案:[Co (CN )6]3-(抗磁性):八面体,O h 强场,低自旋,电子结构为t 2g 6e g 0; [NiF 6]4-(两个成单电子):八面体,O h 弱场,高自旋,电子结构为t 2g 6e g 2; [CrF 6]4-(4个成单电子):八面体,O h 弱场,高自旋,电子结构为t 2g 3e g 1; [AuCl 4]-(抗磁性):平面正方形,D 4h 场,电子结构为(d xz 2,d yz 2 )d z22d xy 2d x2-y20; [FeCl 4]-(5个成单电子):四面体,T d 场,电子结构为e 2t 23; [NiF 6]2-(抗磁性):八面体,O h 强场,低自旋,电子结构为 t 2g 6 e g 0 。
3.2 画出下列各配合物(配离子)所有可能的异构体:[CoCl 2(NH 3)4]+,[Be (gly )2],[RhBr 2(en )2]+,[PtBr 2Cl 2(en )], [Ir (C 2O 4)2Cl 2]3-,[Cr (gly )3],[Pt (gly )2](gly =glycine ,甘氨酸) 答案:[CoCl 2(NH 3)4]+:ClNH 3H 3NH 3NCoClNH 3NH 3NH 3H 3NH 3NCoClClcis - trans -[Be (gly )2] gly =甘氨酸,NH 2CH 2COOH :NONOBeONN O Becis - trans - [RhBr 2(en )2]+:NNNNRhBrBrNBrNNRhNBrNNNBrRhNBrtrans - cis - cis - [PtBr 2Cl 2(en )]:BrBrNNPtClClClClNNPtBrBrBrClNNPtBrClBrClNNPtBrCl[Ir (C 2O 4)2Cl 2]3-:OOOIrClClOClOOIrOClOClOOIrOCltrans - cis - cis - [Cr (gly )3]:NOONCrNONOONCrNON ON OCrNON ON OCrNOmer - mer - fac - fac - [Pt (gly )2]:NNOPtONNO Ptcis - trans -3.3 (a )已知配合物[M (A -B )2]和[M (A -B )2X 2]型的配合物都是旋光活性的,请分别画出它们的几何结构。

第一课时形形色色的分子价层电子对互斥理论学习目标:1. 认识共价分子结构的多样性和复杂性。
2.能根据有关理论判断简单分子或离子的构型。
3.能说明简单配合物的成键情况。
[知识回顾]1.键能:气态基态原子形成1_mol化学键释放的最低能量。
键能越大,化学键越稳定。
2.键长:形成共价键的两个原子之间的核间距。
键长越短,键能越大,共价键越稳定。
3.键角:在原子数超过2的分子中,两个共价键的夹角。
键角是描述分子立体结构的重要参数。
4.等电子体是指原子总数相等、价电子总数相同的微粒,其电子总数不一定相同。
[要点梳理]1.形形色色的分子(1)三原子分子(AB2型)(2)四原子分子(AB3型)(3)五原子分子(AB4型)最常见的为正四面体形,如CH4、CCl4等,键角为109°28′。
价层电子对互斥理论(1)内容价层电子对互斥理论认为,分子的立体结构是“价层电子对”相互排斥的结果。
价层电子对是指分子中的中心原子上的电子对,包括σ键电子对和中心原子上的孤电子对。
(2)价层电子对数的确定σ键电子对数可由分子式确定。
而中心原子上的孤电子对数,确定方法如下:中心原子上的孤电子对数=12(a-xb);a为中心原子的价电子数;x为与中心原子结合的原子数;b为与中心原子结合的原子最多能接受的电子数。
(3)VSEPR模型和分子的立体结构H2O的中心原子上有2对孤电子对,与中心原子上的σ键电子对相加等于4,它们相互排斥形成四面体形VSEPR模型。
略去VSEPR模型中的中心原子上的孤电子对,因而H2O的立体结构为V形。
知识点一常见分子的立体构型1.分子的键角和空间结构[问题探究]1.四原子分子都为平面三角形或三角锥形吗?[答案]不是。
H2O2分子的构型类似于一本打开的书,两个氧原子在两页书的交接处,两个H原子分别在翻开的书的两页上,如图1所示:再如白磷(P4)分子为正四面体形,如图2所示。
2.五原子分子都是正四面体结构吗?[答案]不是,如CH3Cl、CH2Cl2、CHCl3等,虽为四面体结构,但由于碳原子所连的四个原子不相同,四个原子电子云的排斥力不同,使四个键的键角不全相等,所以并不是正四面体结构。



几何构型的判断方法引言:几何构型是指在几何学中,由一组点、线、面等几何元素构成的特定形状或结构。
判断几何构型的方法可以帮助我们理解和解决与几何有关的问题。
本文将介绍几种常见的判断几何构型的方法,帮助读者更好地理解和应用几何知识。
一、几何构型的分类几何构型可以分为点、线、面和立体四种基本形式。
其中,点是最简单的几何构型,它没有长度、宽度和高度;线由无数个点连接而成,具有长度但没有宽度和高度;面由无数个线连接而成,具有长度和宽度但没有高度;立体则是由无数个面连接而成,具有长度、宽度和高度。
二、判断点的位置1. 垂直距离:给定两个点A和B,可以通过计算其在坐标系中的垂直距离来判断它们是否重合。
如果垂直距离为0,则表示两点重合。
2. 坐标关系:给定一个点P(x, y),可以根据其坐标在坐标系中的位置判断它所在的象限或坐标轴上。
三、判断线的性质1. 线段长度:给定两个点A和B,可以通过计算线段AB的长度来判断线段的长短。
2. 平行关系:给定两条线段AB和CD,可以通过计算它们的斜率来判断它们是否平行。
如果两条线段的斜率相等,则表示它们平行。
3. 垂直关系:给定两条线段AB和CD,可以通过计算它们的斜率来判断它们是否垂直。
如果两条线段的斜率互为倒数,则表示它们垂直。
四、判断面的性质1. 面积:给定一个多边形,可以通过计算其面积来判断其大小。
常见的计算面积的方法有海伦公式和分割成三角形计算各个三角形面积再求和的方法。
2. 边长关系:给定一个多边形,可以通过计算其各条边的长度来判断各个边的关系。
如果各边的长度相等,则表示该多边形为正多边形。
五、判断立体的性质1. 体积:给定一个立体体积,可以通过计算其体积来判断其大小。
常见的计算体积的方法有计算棱柱、棱锥和球等立体的体积公式。
2. 表面积:给定一个立体体积,可以通过计算其表面积来判断其大小。
常见的计算表面积的方法有计算棱柱、棱锥和球等立体的表面积公式。
六、结论几何构型的判断方法可以帮助我们理解和解决与几何有关的问题。

判断分子空间几何构型的简单方法以下用G表示电子对数目,V表示分子中所有原子最外层电子数的与,n表示配位原子中除了氢原子以外的其它原子的个数,m表示孤电子对数目,r表示配位原子中氢原子的个数。
当配位原子中没有氢原子且V≥16时:V=8n+2m,G=m+n 例:CO2分子构型的判断V=4+6×2=8n+2m,这里n=2,∴m=0,∴G=m+n=0+2=2,所以CO2的分子构型为直线型BF3分子构型的判断V=3+7×3=8n+2m,这里n=3,∴m=0,∴G=m+n=0+3=3,所以BF3的分子构型为三角形PCl5分子构型的判断V=5+7×5=8n+2m,这里n=5,∴m=0,∴G=m+n=0+5=5,所以PCl5的分子构型为三角双锥SF4分子构型的判断V=6+7×4=8n+2m,这里n=4,∴m=1,∴G=m+n=1+4=5,所以SF4的分子构型为变形四面体BrF3分子构型的判断V=7+7×3=8n+2m,这里n=3,∴m=2,∴G=m+n=2+3=5,所以BrF3的分子构型为T型SF6分子构型的判断V=6+7×6=8n+2m,这里n=6,∴m=0,∴G=m+n=0+6=6,所以SF6的分子构型为八面体XeF4分子构型的判断V=8+7×4=8n+2m,这里n=4,∴m=2,∴G=m+n=2+4=6,所以XeF4的分子构型为正方形当配位原子中有氢原子且V<16时:V=2r+8n+2m, G=m+n+r。
例:CH4分子构型的判断V=4+1×4=2r+8n+2m,这里r=4,n=0,∴m=0, ∴G=m+n+r=0+0+4=4,所以CH4的分子构型为四面体NH3分子构型的判断V=5+1×3=2r+8n+2m,这里r=3,n=0,∴m=1,∴G=m+n+r=1+0+3=4,所以NH3的分子构型为三角锥 H2O分子构型的判断V=6+1×2=2r+8n+2m,这里r=2,n=0,∴m=2,∴G=m+n+r=2+0+2=4,所以H2O的分子构型为V型HClO分子构型的判断V=1+7+6=2r+8n+2m,这里r=1,n=1,∴m=2,∴G=m+n+r=2+1+1=4,所以HClO的分子构型为V型HNO分子构型的判断V=1+5+6=2r+8n+2m,这里r=1,n=1,∴m=1,∴G=m+n+r=1+1+1=3,所以HNO的分子构型为V型HCN分子构型的判断V=1+4+5=2r+8n+2m,这里r=1,n=1,∴m=0,∴G=m+n+r=0+1+1=2,所以HCN的分子构型为直线型注:以上所介绍的方法只有当V为偶数时才适用,当V为奇数时,只需将V与G瞧成比它们大1的偶数即可!。
2020届高三化学选修三物质结构与性质常考题型——立体结构和杂化类型判断.DOC【方法和规律】1、立体构型的判断方法——价层电子对互斥理论(1) 中心原子价层电子对数===σ键电子对数+孤电子对数中心原子的价电子数配位原子的化合价的总和(2)中心原子的价层电子对数2中心原子的最外层电子数配位原子的化合价的总和中心原子的价层电子对数2【微点拨】① 配位原子是指中心原子以外的其它原子(即与中心原子结合的原子)② 若是离子,则应加上或减去与离子所带的电荷数(阴加阳减)③氧、硫原子若为配位原子,则其化合价规定为" 零”,若为中心原子,则价电子数为6 (3)价层电子对互斥理论判断分子空间构型的具体方法PO43—H3O+2、中心原子的杂化类型判断规律:杂化轨道数==价层电子对数==σ键电子对数+孤电子对数价层电子对数杂化方式4sp3杂化3sp2杂化2sp 杂化用中心原子的价层电子对数中心原子的价电子数配位原子的化合价的总和,2来迅速判断(见上表)技巧2:若有多个中心原子时,则根据:“ 杂化轨道数==价层电子对数==σ键电子对数+孤电子对数”来判断如:三聚氰胺分子的结构简式如图所示,分析氮原子、碳原子的杂化类型杂化类型价层电子对数σ键电子对数孤电子对数孤电子对数确定方法环外氮原子sp3431氮原子最外层有5 个电子,形成了3环上氮原子sp2321对共用电子对,则有一对孤对电子环上碳原子sp2330碳原子最外层4 个电子,形成了4 对共用电子对,所以碳上无孤对电子技巧3:根据杂化轨道的空间分布构型判断①若杂化轨道在空间的分布为正四面体形或三角锥形,则分子的中心原子发生sp3杂化②若杂化轨道在空间的分布呈平面三角形,则分子的中心原子发生sp2杂化③若杂化轨道在空间的分布呈直线形,则分子的中心原子发生sp 杂化技巧4:根据杂化轨道之间的夹角判断①若杂化轨道之间的夹角为109°28,′则分子的中心原子发生sp3杂化②若杂化轨道之间的夹角为120°,则分子的中心原子发生sp2杂化③若杂化轨道之间的夹角为180°,则分子的中心原子发生sp 杂化技巧5:根据等电子原理进行判断CO 2是直线形分子,CNS -、N3-与CO 2是等电子体,所以分子构型均为直线形,中心原子均采用sp 杂化技巧6:根据分子或离子中有无π键及π键数目判断没有π键为sp3杂化,含一个π键为sp2杂化,含两个π键为sp 杂化【真题感悟】1、[2019·全国卷Ⅰ ·节选]乙二胺(H 2NCH 2CH 2NH 2)是一种有机化合物,分子中氮、碳的杂化类型分别是 _______________2、[2019 ·全国卷Ⅱ ·节选]元素As与N 同族。
判断分子空间几何构型的简单方法以下用G表示电子对数目,V表示分子中所有原子最外层电子数的和,n表示配位原子中除了氢原子以外的其它原子的个数,m表示孤电子对数目,r表示配位原子中氢原子的个数。
当配位原子中没有氢原子且V≥16时:V=8n+2m,G=m+n 例:CO2分子构型的判断V=4+6×2=8n+2m,这里n=2,∴m=0,∴G=m+n=0+2=2,所以CO2的分子构型为直线型BF3分子构型的判断V=3+7×3=8n+2m,这里n=3,∴m=0,∴G=m+n=0+3=3,所以BF3的分子构型为三角形PCl5分子构型的判断V=5+7×5=8n+2m,这里n=5,∴m=0,∴G=m+n=0+5=5,所以PCl5的分子构型为三角双锥SF4分子构型的判断V=6+7×4=8n+2m,这里n=4,∴m=1,∴G=m+n=1+4=5,所以SF4的分子构型为变形四面体BrF3分子构型的判断V=7+7×3=8n+2m,这里n=3,∴m=2,∴G=m+n=2+3=5,所以BrF3的分子构型为T型SF6分子构型的判断V=6+7×6=8n+2m,这里n=6,∴m=0,∴G=m+n=0+6=6,所以SF6的分子构型为八面体XeF4分子构型的判断V=8+7×4=8n+2m,这里n=4,∴m=2,∴G=m+n=2+4=6,所以XeF4的分子构型为正方形当配位原子中有氢原子且V<16时:V=2r+8n+2m, G=m+n+r。
例:CH4分子构型的判断V=4+1×4=2r+8n+2m,这里r=4,n=0,∴m=0,∴G=m+n+r=0+0+4=4,所以CH4的分子构型为四面体NH3分子构型的判断V=5+1×3=2r+8n+2m,这里r=3,n=0,∴m=1,∴G=m+n+r=1+0+3=4,所以NH3的分子构型为三角锥 H2O分子构型的判断V=6+1×2=2r+8n+2m,这里r=2,n=0,∴m=2,∴G=m+n+r=2+0+2=4,所以H2O的分子构型为V型HClO分子构型的判断V=1+7+6=2r+8n+2m,这里r=1,n=1,∴m=2,∴G=m+n+r=2+1+1=4,所以HClO的分子构型为V型HNO分子构型的判断V=1+5+6=2r+8n+2m,这里r=1,n=1,∴m=1,∴G=m+n+r=1+1+1=3,所以HNO的分子构型为V型HCN分子构型的判断V=1+4+5=2r+8n+2m,这里r=1,n=1,∴m=0,∴G=m+n+r=0+1+1=2,所以HCN的分子构型为直线型注:以上所介绍的方法只有当V为偶数时才适用,当V 为奇数时,只需将V和G看成比它们大1的偶数即可!。
判断分子空间几何构型的简单方法
分子空间几何的构型是研究分子的化学性质和关联性质的重要参考,由此可以知道物质的密度、电荷密度分布特征和电子激发态的迁移以及分子的位移和变形,从而能够更好的预测分子的后续反应特性。
在实际的研究过程中,如何判断分子空间几何构型,是一个关于分子结构与功能之间关系的重要步骤。
最常用的方法是通过实验观察,采用X射线衍射或NMR技术,对分子中的原子进行测看和定位,获取分子空间几何构型的具体信息,从而判断该物质的构型模式。
但是,随着科技的发展,计算机模拟技术也在不断完善,它将实验所需的大量重复工作,转化为电脑的模拟运算,从而使得对分子构型的判断非常简单。
另一种常用的方法是对分子的构型进行理论推演,根据分子中所包含的原子及其电子表象力、共价键角以及化学键长等特征,以某种特定斥力场下的极限决定方程来预测分子的几何构型、结构和性质,从而进行判断。
而这种方法的优势在于可以较为直观的得到分子的轨道构型,而对于复杂的分子构型来说也是一种很直接的判断方法。
综上所述,判断分子空间几何构型的简单方法有实验观察和计算理论推演两种。
实验观察可以采用X射线衍射或NMR技术,而理论推演则是根据分子中所包含的原子及其相关特征,利用某种特定斥力场下的极限决定方程来判断分子的构型。
虽然这两种方法都能够较快得到预期结果,但在实际中,如何根据判断出来的结果应用到研究中还需要仔细结合该分子特性深入思考。