四川大学材料学院材料腐蚀与防护复习提纲X页.doc
- 格式:doc
- 大小:55.00 KB
- 文档页数:6

《材料腐蚀与防护》习题与思考题第一章绪论1.何谓腐蚀?为何提出几种不同的腐蚀定义?2.表示均匀腐蚀速度的方法有哪些?它们之间有何联系?3.镁在海水中的腐蚀速度为 1.45g/m2.d, 问每年腐蚀多厚?若铅以这个速度腐蚀,其ϖ深(mm/a)多大?4.已知铁在介质中的腐蚀电流密度为0.1mA/cm2,求其腐蚀速度ϖ失和ϖ深。
问铁在此介质中是否耐蚀?第二章电化学腐蚀热力学1.如何根据热力学数据判断金属腐蚀的倾向?如何使用电极电势判断金属腐蚀的倾向?2.何谓电势-pH图?举例说明它在腐蚀研究中的用途及其局限性。
3.何谓腐蚀电池?有哪些类型?举例说明可能引起的腐蚀种类。
4.金属化学腐蚀与电化学腐蚀的基本区别是什么?5.a)计算Zn在0.3mol/LZnSO4溶液中的电解电势(相对于SHE)。
b) 将你的答案换成相对于SCE的电势值。
6.当银浸在pH=9的充空气的KCN溶液中,CN-的活度为1.0和Ag(CN)2-的活度为0.001时,银是否会发生析氢腐蚀?7.Zn浸在CuCl2溶液中将发生什么反应?当Zn2+/Cu2+的活度比是多少时此反应将停止?第三章电化学腐蚀反应动力学1.从腐蚀电池出发,分析影响电化学腐蚀速度的主要因素。
2.在活化极化控制下决定腐蚀速度的主要因素是什么?3.浓差极化控制下决定腐蚀速度的主要因素是什么?4.混合电位理论的基本假说是什么?它在哪方面补充、取代或发展了经典微电池腐蚀理论?5.何谓腐蚀极化图?举例说明其应用。
6.试用腐蚀极化图说明电化学腐蚀的几种控制因素以及控制程度的计算方法。
7.何谓腐蚀电势?试用混合电位理论说明氧化剂对腐蚀电位和腐蚀速度的影响。
8.铁电极在pH=4.0的电解液中以0.001A/cm2的电流密度阴极化到电势-0.916V(相对1mol/L甘汞电极)时的氢过电势是多少?9.Cu2+离子从0.2mol/LCuSO4溶液中沉积到Cu电极上的电势为-0.180V(相对1mol/L甘汞电极),计算该电极的极化值。
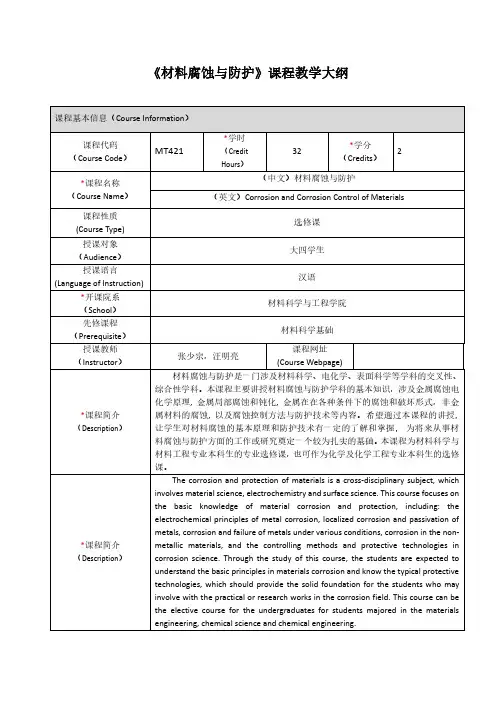

腐蚀与防护复习资料汇总1.材料腐蚀的概念:材料与环境介质接触的表⾯发⽣作⽤(物理、化学或电化学),⽽引起的破坏或变质(性能退化)。
2.根据反应类型划分腐蚀种类:化学腐蚀、电化学腐蚀、物理溶解腐蚀。
3.腐蚀过程的本质是什么?⾦属从⼀个热⼒学不稳定状态向稳定状态转变的,是⼀种⾃然趋势,可以从冶炼⾦属(或合⾦)时所消耗能量的多少或者难易程度来⼤致判断其腐蚀倾向⼤⼩。
4.材料的损坏或失效类型:腐蚀、磨损和断裂,决定了材料的寿命。
5. (计算题)⾦属腐蚀速度的表⽰⽅法:失重法(增重法)、深度法和电流密度。
1)失重法:v 式中:W-为腐蚀速度(g/m2.h );m0为试样腐蚀前的重量;m1为试样清除腐蚀产物后的质量(g );S 为试样表⾯积(m2);t 为腐蚀时间(h)。
2)深度法: 式中: D 为腐蚀深度,单位为mm/a 。
V 为腐蚀速度(g/m2.h ),ρ为⾦属的密度,g/cm3。
3)由失重指标转换为电流密度指标:其中icorr ,A/cm2,V 失,g/(m2·h)三级标准6.腐蚀原电池:阴极,阳极,内电路:离⼦导通的回路;外电路:⾦属本⾝.腐蚀原电池特征:短路的原电池;材料表⾯分为阳极和阴极,阴极和阳极具有不同电位,位于不同位置;阳极和阴极之间要有两个电性连接:电⼦导体通道和离⼦导体通道;离⼦导体为腐蚀环境。
7.盐⽔滴试验:实验说明:⾦属表⾯结构或组织不均匀性,或腐蚀介质不均匀性,都可以导致腐蚀电池的形成;失电⼦的阳极反应和得电⼦的阴极还原反应是在两个相对独⽴的区域进⾏的,但彼此⼜不可分割同时完成;⾦属的电化学腐蚀过程随着电流的发⽣,该电流表征⾦属腐蚀速度;发⽣局部腐蚀情况下,通常阳极区⾯积⽐阴极区⾯积⼩得多,阳极区腐蚀强烈。
8.宏观电池、微观电池:宏:⾦属材料和介质的差异;微:电化学不均匀性宏观腐蚀电池(宏电池):阳极和阴极电极尺⼨相对较⼤,宏观上单独的电极⾁眼可见(可分辩)。
微观腐蚀电池(微电池):阳极和阴极尺⼨微⼩,宏观上单独的电极不可见,⾁眼不可分辩。

材料的设计、制备及表征,是材料研究的三部曲1光谱的分类有多种,从产生机制上,可分为三大类:发射光谱、吸收光谱、散射光谱。
从谱线的形态上,可分为三大类:线状光谱、带状光谱与连续光谱。
从样品类型上,可分为两大类:原子光谱、分子光谱。
2分子、原子、原子核及核外电子,均处于不停地运动中,它们具有一定的能量,即处于一定的能级。
从量子力学的观点来看,它们具有的能级是不连续的,当其吸收了外界供给的能量,便由低能级E1跃迁到高能级En,这个过程称为激发3处于激发态的原子将会很快地、自发地直接或经中间能级后返回到低能级E1,同时把受激时所吸收的能量△E(= En- E1)以电磁波的形式释放出来,这个过程称为退激。
4由激发态直接跃迁到基态而发射的谱线称为共振线线光谱是元素的固有特征,每种元素各有其特有的、不变的线光谱。
确认谱线波长的方法,有标准试样光谱比较法、铁光谱比较法与谱线波长测定法。
5铁光谱比较法;将铁与试样并列摄谱于同一光谱感光板上,然后将摄取的试样光谱和铁光谱同标准铁光谱图相对照,在标准铁光谱中,按波长标明有各元素的灵敏线,定性分析时,以铁光谱线作为波长的标尺,逐个检查试样中拟检查元素的灵敏线,即可确定试样中是否含有某一元素。
如果试样中未知元素的谱线与标准Fe光谱图中标明的某一元素谱线出现的波长位置相重合,则表明存在该元素。
6黑度:在光谱分析时,光强越强,曝光时间越长,在感光板上记录的谱线就越黑,各个谱线变黑的程度用黑度表示测定方法;设以一定强度的入射光投射到感光板的未曝光部分时,其透过光的强度为I1;投射到谱线上时,其透过光的强度为I2,则谱线的黑度S定义为:S = lg I1/ I2。
显然,如果谱线越黑,则I2愈小,S就愈大。
7原子吸收分光光度法;光源:光源的功能是发射被测元素基态原子所吸收的特征共振辐射。
对光源的基本要求是:发射的辐射其波长半宽度要明显小于吸收线的半宽度、辐射强度足够大、稳定性好、使用寿命长。

题型:填空,名词解释,简答题,分析题第1章金属电化学腐蚀基本理论1.掌握腐蚀的定义与分类。
腐蚀—指材料由于环境作用引起的破坏或变质。
金属腐蚀—指金属表面与周围介质发生化学或电化学作用而遭受破坏的现象。
按腐蚀机理金属腐蚀可分为化学腐蚀、电化学腐蚀、物理溶解三大类。
按破坏的特征金属腐蚀可分为全面腐蚀、局部腐蚀。
2.化学腐蚀:金属与电介质直接发生化学作用而引起的破坏。
腐蚀介质直接与金属表面的原子相互作用而产生腐蚀,没有电流产生,为单纯的氧化还原反应。
电化学腐蚀:金属表面与电解质水溶液或熔盐所形成局部电池所产生的腐蚀。
表现为阳极失去电子,阴极得到电子以及产生电流。
3.熟练掌握常见的局部腐蚀类型。
应力腐蚀破坏:拉应力与腐蚀介质联合作用发生开裂破坏。
腐蚀疲劳:腐蚀介质与交变应力或脉冲应力作用下产生的腐蚀。
磨损腐蚀:摩擦副在腐蚀介质中产生的腐蚀。
孔腐蚀:腐蚀集中在某些活性点上,蚀孔直径等于或小于蚀孔深度。
晶间腐蚀:腐蚀沿晶间进行,使晶粒间失去结合力,金属强度急剧降低。
缝隙腐蚀:发生在铆接、螺纹连接、焊接接头、密封垫片等缝隙处的腐蚀。
电偶腐蚀:在电解液中,异种金属接触时,电位较正金属促使电位较负的金属加速其腐蚀。
4.掌握金属腐蚀的历程。
金属腐蚀的本质就是金属与周围介质作用变成化合物的过程,即氧化还原反应。
根据氧化还原反应发生的条件不同,将金属的腐蚀历程分为两种类型:化学腐蚀(Chemical corrosion),其特点是氧化剂直接与金属表面的原子碰撞,化合而形成腐蚀产物,即氧化还原在反应粒子相碰撞的瞬间直接于碰撞的反应点上完成。
例如高温气体中活泼金属的初期氧气过程。
电化学腐蚀(Electrochemical corrosion),其特点是金属的腐蚀存在两个同时进行却相互独立的氧化还原过程,即阳极反应(anode reaction)和阴极反应(cathode reaction)。
例如锌在含氧中性水溶液中的腐蚀。


《材料腐蚀与防护》课程笔记第一章绪论一、材料腐蚀的基本概念1. 定义:材料腐蚀是指材料在特定环境下,由于化学或电化学反应而遭受破坏的过程。
这个过程涉及到材料与周围环境的相互作用,导致材料的性能下降,甚至失效。
2. 类型:材料腐蚀可以分为金属腐蚀和非金属腐蚀两大类。
金属腐蚀包括全面腐蚀和局部腐蚀,非金属腐蚀包括高分子材料的腐蚀和无机非金属材料的腐蚀。
二、金属腐蚀的危害1. 经济损失:金属腐蚀会导致设备、建筑物等损坏,从而造成巨大的经济损失。
腐蚀会缩短设备的使用寿命,增加维修和更换的成本。
2. 资源浪费:金属腐蚀会消耗大量的金属材料,造成资源浪费。
腐蚀产物的堆积会降低材料的利用率,增加材料的消耗。
3. 安全隐患:金属腐蚀会降低设备的性能和寿命,可能导致事故的发生。
例如,腐蚀会导致管道泄漏、断裂等,从而引发安全事故。
4. 环境污染:金属腐蚀产生的废物和污染物会对环境造成严重影响。
腐蚀产物可能会释放有毒物质,污染土壤、水源和空气。
三、腐蚀控制及其重要性1. 腐蚀控制的定义:腐蚀控制是指采取各种措施,降低或消除材料腐蚀的过程。
这包括改变材料的腐蚀环境、使用防腐涂层、采用阴极保护等方法。
2. 腐蚀控制的重要性:腐蚀控制可以延长材料的使用寿命,节约资源和成本,保障设备的安全运行,减少环境污染。
通过有效的腐蚀控制,可以提高设备的可靠性和稳定性,减少维修和更换的频率,降低事故的风险。
四、腐蚀科学与防护技术的研究进展1. 腐蚀科学的发展:腐蚀科学从最初的观察和经验总结,逐渐发展到现代的腐蚀机理研究、腐蚀测试技术和腐蚀预测。
研究者通过实验和理论分析,揭示了腐蚀过程的本质和规律,为腐蚀控制提供了科学依据。
2. 防护技术的发展:防护技术包括涂层保护、阴极保护、阳极保护、缓蚀剂保护等。
近年来还出现了许多新型防护技术,如纳米涂层、自修复涂层等。
这些技术的发展为腐蚀控制提供了更多的选择和可能性。
五、金属腐蚀的分类1. 全面腐蚀:全面腐蚀是指金属表面均匀地遭受腐蚀,如铁的生锈。
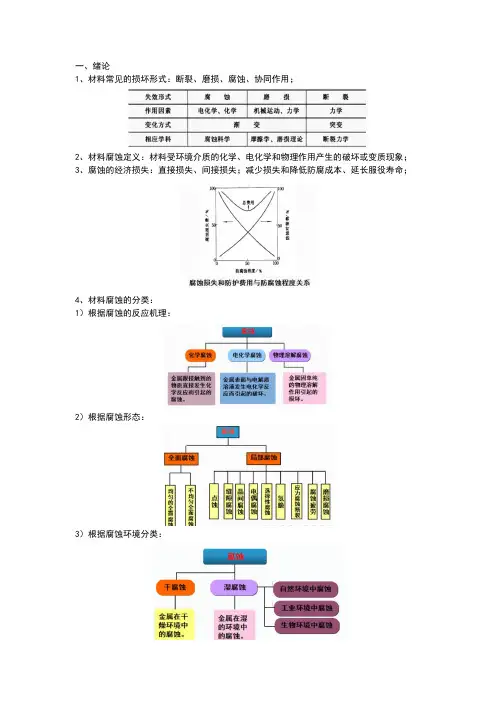
一、绪论1、材料常见的损坏形式:断裂、磨损、腐蚀、协同作用;2、材料腐蚀定义:材料受环境介质的化学、电化学和物理作用产生的破坏或变质现象;3、腐蚀的经济损失:直接损失、间接损失;减少损失和降低防腐成本、延长服役寿命;4、材料腐蚀的分类:1)根据腐蚀的反应机理:2)根据腐蚀形态:3)根据腐蚀环境分类:4)根据腐蚀温度分类:5、材料的腐蚀控制(防护得基本途径)1)正确选材和合理设计;2)提高材料本身的耐蚀性:热力学稳定性和控制动力学;3)电化学保护:阴极保护阳极保护;4)将材料与腐蚀介质隔开:衬里、防锈油、防锈纸等;5)采用涂镀层和表面改性:涂镀层和表面改性;6)改变环境:温度和流速、介质处理、应力、缓蚀剂等;6、材料腐蚀速度的表示方法:1)由质量变化来表示腐蚀速度:2)由腐蚀深度来表示腐蚀速度:3)由电流密度来表示腐蚀速度:二、电化学理论基础1、金属腐蚀原电池:1)阳极过程(锌):金属溶解,以离子形式迁移到溶液中同时留下当量电子在金属上;2)电流通路:电子从阳极流向阴极,溶液中的阳(阴)离子从阳极区移向阴(阳)极区,形成回路;3)阴极过程(铜):从阳极迁移的电子被电解质溶液中能吸收电子的物质中和掉;4)次生过程:金属离子和pH不同区域(OH );2、根据构成腐蚀电池电极大小分类为:(1)宏观腐蚀电池:①肉眼可分辨出电极极性;②且阴极区和阳极区长时间保持稳定;③产生明显的局部腐蚀。
1)异种金属浸入不同电解质溶液:如丹尼尔电池2)异种金属浸入同种电解质溶液:如钢船壳与青铜螺旋桨等3)浓差电池:如氧浓差电池4)温差电池:如换热器、冷却器、反应器等(2)微观腐蚀电池:①肉眼难于辨出电极的极性;②但确实存在氧化还原过程的原电池;产生:1)金属表面化学成分不均匀性:钢板弯曲处、铆钉头部区域容易优先腐蚀;2)金属组织不均匀性:晶粒-晶界腐蚀微电池,晶界作为腐蚀电池的阳极而优先发生腐蚀;3)金属表面物理状态不均匀性:4)金属表面膜不完整性:3、判断电极反应能否发生:1)根据热力学原理,可用Gibbs自由能来判断;(▲G)T,P= -nEF (电化学与热力学之间的桥梁)2)利用电极电位或标准电极电位判断:4、双电层:①许多负电性金属如Fe、Zn、Cd、Mg等浸入水溶液中就形成金属表面积累负电荷的双电层;②许多负电性金属如Fe、Zn、Cd、Mg等浸入水溶液中就形成金属表面积累负电荷的双电层;5、离子双电层结构模型:1)紧密双电层模型:1879年,赫姆荷尔茨和佩林提出。

材料腐蚀与防护复习题适用于材料成型与控制专业一、名词解释1、腐蚀:材料与所处环境介质之间发生作用而引起材料的变质和破坏。
2、腐蚀原电池:只能导致金属材料破坏而不能对外界作功的短路原电池;特点:1. 阳极反应都是金属的氧化反应,造成金属材料的破坏 2. 反应最大限度的不可逆3. 阴、阳极短路,不对外做功3.腐蚀电池的工作环节:1.阳极反应通式:Me→Men++ne 可溶性离子,如 Fe-2e=Fe2+ ;2.阴极反应通式:D+me=[D.me] 2H++2e=H2 析氢腐蚀或氢去极化腐蚀;3.电流回路金属部分:电子由阳极流向阴极溶液部分:正离子由阳极向阴极迁移4. 形成腐蚀电池的原因:金属方面:成分不均匀;表面状态不均匀;组织结构不均匀;应力和形变不均匀;“亚微观”不均匀;环境方面:金属离子浓度差异;氧浓度的差异;温度差异5.交换电流密度:当电极反应处于平衡时,电极反应的两个方向进行的速度相等,此时按两个反应方向进行的阳极反应和阴极反应的电流密度绝对值叫做交换电流密度。
6.电动序:将各种金属的标准电位 E0 的数值从小到大排列起来,就得到“电动序”。
7.腐蚀电位:金属在给定腐蚀体系中的电极电位。
电偶序:在某给定环境中,以实测的金属和合金的自然腐蚀电位高低,依次排列的顺序8.电化学腐蚀倾向的判断:自由焓准则当△G<0,则腐蚀反应能自发进行。
|Δ G|愈大则腐蚀倾向愈大。
当△G= 0,腐蚀反应达到平衡。
当△G> 0,腐蚀反应不能自发进行。
9. 电极:金属浸于电解质溶液中所组成的系统。
10. 电位:金属和溶液两相之间的电位差叫做电极系统的绝对电极电位,简称电位,记为E。
11.电极电位:电极系统中金属与溶液之间的电位差称为该电极的电极电位。
11、平衡电位:当电极反应达到平衡时,电极系统的电位称为平衡电位,记为 Ee 意义:当电极系统处于平衡电位时,电极反应的正逆方向速度相等,净反应速度为零。
在两相c、a 之间物质的迁移和电荷的迁移都是平衡的。

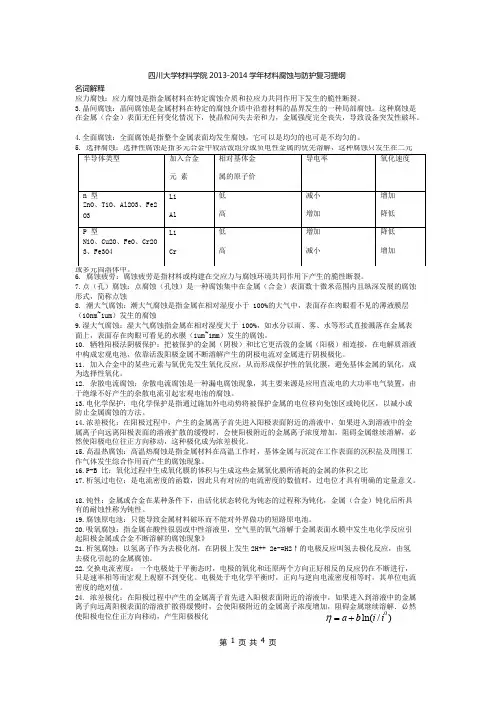
这种途径适用于可能钝化的金属体系(合金与腐蚀环境)。
金属或合金中加入阴极性合金元素,可促使合金进入钝化状态,从而形成耐蚀合金。
阴极过程的极化曲线为Ec-C1如加入的阴极性合金元素的活性不足(量不足),体系不稳定。
阴极极化曲线由Ec-C1变为Ec-C2;加入阴极化极性合金元素(适量),产生强烈的阴极去极化作用。
此时电位已达到致钝电位,最大电流超过了钝化临界电流密度流密度,合金进入钝态。
极化曲线变为Ec-C3如加入过量的阴极性元素,使阴极活性过强,产生强烈的过钝化溶解或点蚀。
极化曲线变为Ec-C46、金属高温氧化产物有几种形态,简要说明固态氧化膜生长机制及氧化膜具有保护作用的充分与必要条件。
解:3种,固液气。
固态氧化膜生长机制:①气体在金属表面上吸附②氧溶解在金属中,进而在金属表面形成氧化物薄膜或独立的氧化物核③连续的氧化膜覆盖在金属表面上时,氧化膜就将金属与气体分离开来,必须通过中性原子或电子离子在氧化膜中的迁移来实现氧化膜生长。
充分必要条件:充分:①膜要致密,连续,无孔洞、晶体缺陷②稳定性好,蒸汽压低,熔点高③膜与基体附着力强,不易脱落④生长内应力小⑤与金属基体具有相近的热膨胀系数⑥膜的自愈能力强必要:PBR>1,但PBR不能﹥﹥17、铅试样浸入PH=2,温度为40℃,已除氧的酸溶液中,计算Pb2+能达到的最大浓度。
解:阴极反应2H++2e=H2Eec=-0.059×(313/298)PH=-0.248V阳极反应:Pb=Pb+2+eEea=E0+0.02955×(313/298)lgC PB2+=-0.126+0.031lgC Pb2+当Eea=Eec时,C Pb2+达到最大,所以:-0.248=-0.126+0.031lgC Pb2+计算得:C Pb2+=1.16×10^-4mol/L8、根据极化图说明阴极保护原理,并说明阴极保护的主要参数,应如何选择这些参数原理:由外电路向金属通入电子,以供去极化剂还原反应所需,从而使金属氧化反应受到抑制。
材料的腐蚀与防护知识点复习用1.常见的三种失效形式:腐蚀、断裂、磨损。
2.材料腐蚀:材料受环境介质的化学作用或者电化学作用而变质和破坏的现象。
3.控制腐蚀的可用方法:(1)合理的结构设计。
(2)正确选材和发展新型耐腐蚀材料。
(3)采用合理的表面工程技术。
(4)改善环境和合理使用缓蚀剂。
(5)电化学保护。
4.腐蚀分类:(1)按腐蚀机理分类:化学腐蚀、电化学腐蚀。
(2)腐蚀形态分类:普遍性腐蚀、局部腐蚀、应力作用下的腐蚀断裂。
5.电化学腐蚀是指金属材料和电解质接触时,由于腐蚀电池作用而引起的金属材料服腐蚀破坏。
6.电极:电极电位较低的电极为负极,电极电位较高的电极为正极;发生氧化反应的为阳极,发生还原反应的为阴极。
7.电化学腐蚀与化学腐蚀的比较:项目化学腐蚀电化学腐蚀介质干燥气体或非电解质溶液电解质溶液反应式∑viMi=0 ∑viMin+±ne=0过程规律化学反应动力学电极过程动力学能量转换化学能与热化学能与电能电子传递直接的,不具方向性,测不出电流间接,有一定方向性,可测出电流反应区在碰撞点上瞬时完成在相对独立的阴、阳极区同时完成产物在碰撞点直接形成一次产物在电极上形成,二次产物在一次产物相遇处形成温度主要高温下室温或高温下8.由于电池负极进行的是氧化反应,其负极是阳极,正极上进行的是还原反应,其正极是阴极。
9.金属腐蚀的电化学历程:阴极过程: 金属以离子形式溶解进入溶液,等电量的电子留在金属表面,并通过电子导体向阴极移动。
即,阳极发生氧化反应M→Mn+ + ne阳极过程: 电解质溶液中能够接受电子的物质从金属阴极表面捕获电子而生成新的物质。
即,阴极发生还原反应:D+ne→[D ? ne]电荷传递: 电荷的传递在金属中依靠电子从阳极流向阴极;在溶液中是依靠离子的电迁移。
10.电极电位由下述三种情况之一产生:(1)金属浸入电解质溶液之后,金属表面的正离子由于极性水分子的作用,将发生水化。
若水化时产生的水化能足以克服金属晶格中正离子与电子之间的引力,则金属表面一部分正离子就会脱离金属进入溶液中形成水化离子。
资料腐化与防备复习题合用于资料成型与控制专业一、名词解说1、腐化 : 资料与所处环境介质之间发生作用而惹起资料的变质和损坏。
2、腐化原电池:只好致使金属资料损坏而不可以对外界作功的短路原电池;特色: 1. 阳极反响都是金属的氧化反响,造成金属资料的损坏 2. 反响最大限度的不行逆3. 阴、阳极短路,不对外做功3.腐化电池的工作环节:1.阳极反响通式:Me→ Men++ne可溶性离子,如Fe-2e =Fe2+;2.阴极反响通式:D+me=[D.me]2H++2e = H2 析氢腐化或氢去极化腐化;3.电流回路金属部分:电子由阳极流向阴极溶液部分:正离子由阳极向阴极迁徙4.形成腐化电池的原由:金属方面:成分不平均;表面状态不平均;组织构造不平均;应力和形变不平均;“亚微观”不平均;环境方面:金属离子浓度差异;氧浓度的差异;温度差异5.互换电流密度:当电极反响处于均衡时,电极反响的两个方向进行的速度相等,此时按两个反响方向进行的阳极反响和阴极反响的电流密度绝对值叫做互换电流密度。
6.电动序:将各样金属的标准电位E0的数值从小到大摆列起来,就获得“电动序”。
7. 腐化电位:金属在给定腐化系统中的电极电位。
电偶序:在某给定环境中,以实测的金属和合金的自然腐化电位高低,挨次摆列的次序8.电化学腐化偏向的判断:自由焓准则当△ G<0 ,则腐化反响能自觉进行。
| G|愈大则腐化偏向愈大。
当△G=0,腐化反响达到均衡。
当△ G> 0,腐化反响不可以自发进行。
9. 电极:金属浸于电解质溶液中所构成的系统。
10.电位 :金属和溶液两相之间的电位差叫做电极系统的绝对电极电位,简称电位,记为E。
11.电极电位:电极系统中金属与溶液之间的电位差称为该电极的电极电位。
11 、均衡电位:当电极反响达到均衡时,电极系统的电位称为均衡电位,记为 Ee 意义:当电极系统处于均衡电位时,电极反响的正逆方向速度相等,净反响速度为零。
西川大学材料学院2013-2014学年材料腐袖与防护复习提纲名词解释1.哈菲价法则2.应力腐蚀:应力腐蚀是指金属材料在特定腐蚀介质和拉应力共同作用下发生的脆性断裂。
3.晶间腐蚀:晶间腐蚀是金属材料在特定的腐蚀介质中沿着材料的晶界发生的一种局部腐蚀。
这种腐蚀是在金属(合金)表面无任何变化情况下,使晶粒间失去亲和力,金属强度完全丧失,导致设备突发性破坏。
4.全面腐蚀:全面腐蚀是指整个金属表面均发生腐蚀,它可以是均匀的也可是不均匀的。
5.选择腐蚀:选择性腐蚀是指多元合金中较活泼组分或负电性金属的优先溶解, 这种腐蚀只发生在二元或多元固溶体中。
6.腐蚀疲劳:腐蚀疲劳是指材料或构建在交应力与腐蚀环境共同作用下产生的脆性断裂。
7•点(孔)腐蚀:点腐蚀(孔蚀)是一种腐蚀集中在金属(合金)表面数十微米范围内且纵深发展的腐蚀形式,简称点蚀8.潮大气腐蚀:潮大气腐蚀是指金属在相对•湿度小于100%的大气中,表面存在肉眼看不见的薄液膜层(lOnm'um)发生的腐蚀9.湿大气腐蚀:湿大气腐蚀指金属在相对湿度大于100%,如水分以雨、雾、水等形式直接溅落在金属表面上,表面存在肉眼可看见的水膜(lunTlmm)发生的腐蚀。
10.牺牲阳极法阴极保护:把被保护的金属(阴极)和比它更活泼的金属(阳极)相连接,在电解质溶液中构成宏观电池,依靠活泼阳极金属不断溶解产生的阴极电流对金属进行阴极极化。
11.加入合金中的某些元素与氧优先发生氧化反应,从而形成保护性的氧化膜,避免基体金属的氧化,成为选择性氧化。
12.杂散电流腐蚀:杂散电流腐蚀是一种漏电腐蚀现象,其主要来源是应用直流电的大功率电气装置,由于绝缘不好产生的杂散电流引起宏观电池的腐蚀。
13.电化学保护:电化学保护是指通过施加外电动势将被保护金属的电位移向免蚀区或钝化区,以减小或防止金属腐蚀的方法。
14.浓差极化:在阳极过程中,产生的金属离子首先进入阳极表面附近的溶液中, 如果进入到溶液中的金属高子向远高阳极表面的溶液扩散的缓慢时,会使阳极附近的金属离子浓度增加,阻碍金属继续溶解,必然使阳极电位往正方向移动,这种极化成为浓差极化。
15.高温热腐蚀:高温热腐蚀是指金属材料在高温工作时,基体金属与沉淀在工作表面的沉积盐及周围工作气体发生综合作用而产生的腐蚀现象。
16.P-B比:氧化过程中生成氧化膜的体积与生成这些金属氧化膜所消耗的金属的体积之比17.析氢过电位:是电流密度的函数,因此只有对应的电流密度的数值时,过电位才具有明确的定量意义。
18.钝性:金属或合金在某种条件下,由活化状态转化为钝态的过程称为钝化,金属(合金)钝化后所具有的耐蚀性称为钝性。
19.腐蚀原电池:只能导致金属材料破坏而不能对•外界做功的短路原电池。
20.吸氧腐蚀:指金属在酸性很弱或中性溶液里,空气里的氧气溶解于金属表面水膜中发生电化学反应引起阳极金属或合金不断溶解的腐蚀现象》21 .析氢腐蚀:以氢离子作为去极化剂,在阴极上发生2H++2e-=H2f的电极反应叫氢去极化反应,由氢去极化引起的金属腐蚀。
22.交换电流密度:一•个电极处于平衡态时,电极的氧化和还原两个方向正好相反的反应仍在不断进行,只是速率相等而宏观上观察不到变化。
电极处于电化学平衡时,正向与逆向电流密度相等时,其单位电流密度的绝对值。
23.塔菲关系:析氢过电位与电流密度之间呈现半对•数关歹—°24.浓差极化:在阳极过程中产生的金属离子首先进入阳屋”四"液中,如果进入到溶液中的金属离子向远离阳极表面的溶液扩散得缓慢时•,会使阳极附近的金属离子浓度增加,阻碍金属继续溶解.必然使阳极电位住正方向移动,产生阳极极化25.活化极化:是指由于电极反应速度缓馒所引起的极化,或者说电极反应是受电化学反应速度控制,因此活化极化也称电化学极化。
涂层材料一般包括金属材料和陶瓷材料两大类。
1、说出几种恒温氧化的动力学规律,并说明其意义。
解:①直线规律:y=kt + c, y-氧化膜厚度,t-时间,k-氧化线性速度常数。
意义:表面氧化膜多孔,不完整,不具有保护性,对金属进一步氧化没有抑制作用。
%1抛物线规律:y2二kt+c,表明氧化膜具有保护性,氧化反应的只要控制因素是离子在固态膜中的扩散。
%1立方规律:y3二kt+c,扩散阻滞作用比膜增厚所产生的阻滞更为严重。
%1对数与反对数规律:y=klg (t+tO) +A,说明氧化过程扩散阻滞作用远比抛物线规律大。
2、指出高温氧化理论(wagner)要点,结合金属氧化的等效电池模型推导出高温氧化速度常数K的表达式,并讨论式中各参数的意义.W: wagner理论假定:⑴氧化物是单相,且密实、完整,与基体间有良好的吸附性;(2)氧化膜内离子、电子、离子空位、电子空位的迁移都是由浓度梯度和电位梯度提供驱动力,而且晶格扩散是整个氧化反应的速度控制因素;(3)氧化膜内保持电中性;(4)电子、离子穿透氧化膜运动彼此独立迁移;(5)氧化反应机制遵循抛物线规律;(6) K值与氧压无关。
阳极反应:Me - Me"+2e阴极反应:1/2 02+2e -> 02电池总反应式:l/202+Me MeO参数意义:na、nc、ne分别为阴、阳离子、电子迁移数,g为氧化膜比导电,F 为法拉第常数,E为金属氧化膜的电动势(宜回二-2FE) , D为扩散系数,J 为氧化物当量3、以不锈钢在充气的溶液中孔蚀为例,简述小孔腐蚀的机理。
蚀孔一旦形成,孔内金属如图处于活化状态(电位较负),蚀孔外的金属表面仍处于钝态(电位较正),于是蚀孔内外构成了膜孔电池。
孔内阳极反应:Fe Fe2++2e;孔外阴极反应:l/202+H20+2e -> 20H-孔口PH升高,产生二次反应:(亚铁离子先与氢氧根生成氢氧化钠亚铁再氧化成氢氧化铁,方程式略)Fe(OII)3沉积在孔口形成多孔的蘑菇状壳层。
使孔内外物质交换困难,孔内介质相对孔外介质呈滞流状态。
孔内浓度继续下降,孔外富氧,形成氧浓差电池。
其作用加速了孔内不断离子化,孔内F/.浓度不断增加,为保持电中性,孔外C1 向孔内迁移,并与孔内形成可溶性盐FeC124孔内氯化物浓缩、水解等使PH值下降,PH值可达2~3。
点蚀以自催化过程不断发展下去。
孔底,由于孔内的酸化,汁去极化的发生及孔外氧去极化的综合作用,加速了孔底金属的溶解速度。
4、简述人体环境中金属植入材料可能发生哪些腐蚀,其特点和危害如何?均匀腐蚀:在人体环境中,问题是均匀腐蚀产物的生物相容性。
严重影响生物的相容性,增加病人痛苦甚至危及生命。
点腐蚀:钛合金及钻铭钥合金点蚀倾向小,不锈钢点蚀倾向大。
电偶腐蚀:选用材料不同就容易长生电偶腐蚀缝隙腐蚀:多零件植入装置,会遭受缝隙腐蚀,不锈钢植入器件磨损腐蚀:是由于植入器件之间反复的,相对的华东所造成的表面磨损与腐蚀环境的综合作用结果晶间腐蚀:是不锈钢最易发生的一•种腐蚀形式,危害是相当严重的。
腐蚀疲劳:耐腐蚀疲劳性能很重要。
5、结合阴极性元素对可钝化体系腐蚀规律影响的示意图,说明阳极曲线中主要的特征参数及每一部分的含义。
并描述加入阴极性合金元素促进阳极钝化的过程和特点。
参数:E R:自腐蚀电位;Eb:临界钝化点位;Ep:钝化点位;Eop:过钝化点位; ip:维钝电流密度;ib:致钝电流密度A-B区活性溶解区。
金属的自腐蚀电位ER到临界钝化电位Eb之间为活性溶解区, 即A-B区。
金属电极的阳极电流密度随电位升高而增大。
金属处于活性溶解状态, 以低价形式溶解。
B-C区活化-钝化过渡区。
半电极电位达到临界钝化电位Eb态时,金属表面发生突变,电位继续增加,电流急剧下降,金属由活化态进入钝化态。
此时,金属表面上生成过渡氧化物。
对应B点的Eb和ib分别称为致钝电位和致钝电流密度。
B点标志着金属钝化的开始,具有特殊的意义。
C-D区,钝化区或稳定钝化区。
在这个区金属处于钝态并以ip (维钝电流密度)的速度溶解着。
ip基本上与电极电位无关,即随着电位增加,在一•个相当宽的电位范围内。
金属阳极溶解速度几乎保持不变。
此时金属表面上可能生成-•层耐蚀性好的高价氧化物膜。
D-E区,过钝化区。
过钝化区的特征是阳极电流密度再次随电位的升高而增加。
当电位超过Eop时,金属溶解速度急剧增加。
可能是由于氧化膜进一步氧化生成更高价的可溶性的氧化物的缘故。
加入阴极性合金元素促进阳极钝化的过程和特点这种途径适用于可能钝化的金属体系(合金与腐蚀环境)。
金属或合金中加入阴极性合金元素,可促使合金进入钝化状态,从而形成耐蚀合金。
阴极过程的极化曲线为Ec-Cl如加入的阴极性合金元素的活性不足(量不足),体系不稳定。
阴极极化曲线由Ec-Cl 变为Ec-C2;加入阴极化极性合金元素(适量),产生强烈的阴极去极化作用o此时电位已达到致钝电位,最大电流超过了钝化临界电流密度流密度,合金进入钝态。
极化曲线变为Ec-C3如加入过量的阴极性元素,使阴极活性过强,产生强烈的过钝化溶解或点蚀。
极化曲线变为Ec-C46、金属高温氧化产物有儿种形态,简要说明固态氧化膜生长机制及氧化膜具有保护作用的充分与必要条件。
解:3种,固液气。
固态氧化膜生长机制:①气体在金属表面上吸附②氧溶解在金属中,进而在金属表面形成氧化物薄膜或独立的氧化物核③连续的氧化膜覆盖在金属表面上时,氧化膜就将金属与气体分离开来,必须通过中性原子或电子离子在氧化膜中的迁移来实现氧化膜生长。
充分必要条件:充分:①膜要致密,连续,无孔洞、晶体缺陷②稳定性好,蒸汽压低,熔点高③ 膜与基体附着力强,不易脱落④生长内应力小⑤与金属基体具有相近的热膨胀系数⑥膜的自愈能力强必要:PBR>1,但PBR不能〉> 17、铅试样浸入PH=2,温度为40°C,已除氧的酸溶液中,计算Pb”能达到的最大浓度。
解:阴极反应2H'+2e=H2 Eec=-0. 059 X (313/298 ) PH= -0.248V阳极反应:Pb=Pb*2+eEea=E°+0. 02955 X (313/298) lgCp B2*= ~0. 126+0. 0311gC Pb2.当Eea=Eec 时,C阪达到最大,所以:-0. 248=-0. 126+0. 0311gC Pb2.计算得:Ci>b2+=1. 16X 10 -4mol/L8、根据极化图说明阴极保护原理,并说明阴极保护的主要参数,应如何选择这些参数原理:由外电路向金属通入电子,以供去极化剂还原反应所需,从而使金属氧化反应受到抑制。
当金属氧化反应速度降低到零时,金属表面只发生去极化剂阴极反应。
保护参数保护电位Epr:阴极保护中所取的极化电位。
要使金属的腐蚀速度降低到零,达到“完全保护"(n=100%),必须取阳极反应平衡电位作为保护电位(Epr= Eea)。