无机化学 键级
- 格式:docx
- 大小:13.80 KB
- 文档页数:1



键级计算例题讲解
在无机化学中,键级是用来描述分子中单键和双键相对稳定程度的参数,又称键序。
以下是一个键级计算的例题讲解:
题目:计算下列分子或离子的键级:
1. N2 (氮气)
2. CO (一氧化碳)
3. [Fe(CO)5] (五羰基合铁)
解:
1. 对于N2,每个氮原子与另外两个氮原子形成2个单键,所以每个氮原子的键级为:
$2 + \frac{1}{2} \times 2 = 3$
因此,N2的键级为3。
2. 对于CO,碳原子与氧原子之间形成一个单键,同时碳原子还有一个未成键的π电子,所以碳原子的键级为:
$1 + \frac{1}{2} \times 1 = $
氧原子的键级为:
$0 + \frac{1}{2} \times 2 = 1$
因此,CO的键级为:
$ + 1 = $
3. 对于[Fe(CO)5],首先确定铁原子的价电子组态为$3d^{6}4s^{2}$,与5个氧原子形成5个单键。
由于铁原子在形成这5个单键的同时,还与一个氧原子形成配位键,所以铁原子的键级为:
$5 + \frac{1}{2} \times 1 = $
而氧原子的键级为:
$0 + \frac{1}{2} \times 2 = 1$
因此,[Fe(CO)5]的键级为:
$ + 1 = $
综上所述,我们得到了各个分子或离子的键级:N2的键级为3,CO的键级为,[Fe(CO)5]的键级为。

无机化学知识点整理无机化学是化学的一个分支,与研究机体化学性质的有机化学不同,无机化学主要是研究无机物质,如金属、非金属化合物、盐类和氧化物等。
学习无机化学需要掌握一些重要的知识点,本文将对无机化学的重要知识点进行整理。
一、化学键化学键是分子或离子的原子之间的连接,它决定了物质的化学性质。
根据价电子的共享情况可以将化学键分为共价键和离子键两种。
1. 共价键共价键指两个原子之间通过共享电子建立的化学键。
共价键的特征是结合原子之间的电荷分布呈现相互穿插的状态。
共价键的结构形式有单键、双键和三键。
单键是最常见的共价键类型,例如氢气,每个氢原子与另一个氢原子共享一个电子。
双键和三键包括多个共享的电子对,例如氮分子中有三个共价键,其中有一个双键和两个单键。
2. 离子键离子键指两个离子之间的化学键,其中一个离子通常是金属离子,另一个通常是非金属离子。
离子键的形成通常是由于离子之间电荷分布的相互吸引而建立的。
以氯化钠为例,钠离子和氯离子电荷相互吸引形成氯化钠分子,其中钠离子的电子数比氯离子少1个,在化学式中以+和-来表示。
二、化合物命名在学习无机化学时,孩子们还需要学习如何为每种化合物命名。
通常,化合物由正离子和负离子组成。
正离子通常是金属离子,负离子则是非金属离子。
命名化合物的过程取决于化合物的类型:1. 离子化合物命名离子化合物是由正离子和负离子组成的,通常是由金属和非金属元素组成的,如氯化钠。
虽然正离子的名称不变,但负离子的名称通常要以“-ide”作为结尾。
例如,氯离子的化学式为Cl--,则把这个离子与钠的离子Na+相结合,形成NaCl(氯化钠)。
2. 共价键化合物命名共价键化合物是由非金属元素共享电子而形成的,如二氧化碳(CO2)。
当命名这种化合物时,使用墨菲亚法则是一种有用的技术。
这种法则规定,一个离子的名字(例如,氧)被保留,然后在前面加上一个前缀来指示它的数量(例如二氧化碳)。
三、反应类型在无机化学中,反应类型通常涉及化学键的断裂和可能的新键的形成。



第十二章 答案1. (1) O 3 + 2H ++ 2I -2 + H 2O + O 2 (2) 3O3 + S + H 2O2SO 4 + 3O 2(3) 6[Fe(CN)6]4- + O 3 + 3H 2O 6]3- + 6OH -2. 虽然O + 2e -−→ O 2-过程是吸热的,但O 2-离子与金属离子形成离子晶体所放出的热量足以补偿前面的吸热过程。
3. O 2分子中,除了有一个σ单键外,还存在两个三电子π键,键级为2;O 3分子中除了σ键外,还有43∏的离域π键,键级小于2,大于1;H 2O 2分子中,O -O 间只存在σ单键,键级为1;根据键级越大,键长越短,从O 2、O 3到H 2O 2,O -O 间的键长越来越长。
4. 许多过氧化物之所以有颜色,是因为过氧化物吸收可见光后,会发生(π)4(π*)2→(π)3(π*)3的电子跃迁,∴过氧化物显示出吸收光的互补色。
5. 用乙基蒽醌法生产H 2O 2的好处是原料可以循环使用。
OHOHC 2H 5O 2OC 2H 5+ H 2O 2H 2PdOHOHC 2H56.222H O /H O ϕ=1.776 V ,222O /H O ϕ=0.6824 V ,MnO 4-只能作氧化剂,且2+4MnO /Mn ϕ--222O /H O ϕ=0.8086 V>0,Cl 2作氧化剂时,2Cl /Cl ϕ--222O /H O ϕ=0.6756 V>0,∴H 2O 2遇到强氧化剂KMnO 4、Cl 2等,显还原性:2MnO 4-+ 5H 2O 2 + 6H+2↑ + 2Mn 2+ + 8H 2OCl 2 + H 2O 2-+ O 2↑ + 2H +7. (1) 4FeS 2 + 11O 22O 3 + 8SO 2O 2 + SO 23 SO 3 + 2KOH2SO 4 + H 2OK 2SO 4 + H 2SO 4电解K 2S 2O 8 + H 2 K 2S 2O 8 + 2H 2O2SO 4 + H 2SO 4 + H 2O 2(2) SO 2I −−→()NaHSO 3II −−→()Na 2S 2O 3III −−−→()Na 2S 4O 6↓(IV) (I) SO 2 + NaOH3 + H 2OS VI ←−−−()Na 2SO3 V−−→() SO 2 (II) NaHSO 3 + NaOH2SO 3 + H 2O ↓(VII)(VIII) Na2SO 3 + S煮沸Na 2S 2O 3 SO 42-S 2O 42-(III) 2Na 2S 2O 3 + I 22S 4O 6(IV) NaHSO 3 + NaOHNa 2SO 3 + H 2O(V) Na2SO3+ 2HCl2O + SO2↑(VI) Na2SO3+ 2Na2S + 6HCl2O(VII) 5Na2SO3+ 2KMnO4 + 3H2SO42SO4 + K2SO4 + 2MnSO4 + 3H2O (VIII) Na2SO3+ SO2 + H2O32NaHSO3 + Zn2S2O4 + Zn(OH)2 8. S + H2H2S 2S +C 2 S +FeS +O2 2 2S +Cl22Cl2S +Cl2(过量)2S + 2HNO32SO4 + 2NO9. H2S + 2Fe3+2+ + 2H+5H2S + 2MnO4-+ 6H+2+ + 5S↓ + 8H2O H2S + 4Br2 + 4H2O2SO4 + 8HBr 3H2S + Cr2O72-+ 8H+3++ 7H2O 10.硫作氧化剂:S + H22S S +Fe2S +C2硫作还原剂:S + O2 2 S +Cl2(过量)2(l) S + 2HNO32SO4 + 2NO 11. (1) 5H2O2 + 2KMnO4 + 6H+2↑ + 2Mn2+ + 8H2O(2) CaS5 + 2HCl2 + H2S5 H2S5H2S + 4S(3) SO2(OH)Cl + H2O42-+ Cl-+ 3H+ (4) PCl5 + SO22 + POCl3(5) S2O2Cl2 + 4KHS + 2H2O2SO4 + 4H2S↑ + 2KCl(6) 2Na2S2O3 + I22S4O6(7) Na2SO3 + I2 + H2O2SO4(8) 3S2O32-(过量) + 4IO3-+ 3H2O42-+ 4I-+ 6H+12. 因为亚硫酸盐可以被空气氧化为硫酸盐,SO32-遇到H+离子时会放出SO2,∴亚硫酸盐不稳定,不能在自然界中以矿物存在。

9.2 课后习题详解1. 写出下列化合物分子的Lewis 结构式,并指出其中何者是σ键,何者是π键,何者是配位键。
(1)膦PH 3 (2)联氨N 2H 4(N-N 单键);(3)乙烯; (4)甲醛;(5)甲酸;(6)四氧化二氮(有双键)。
解:其结构式与化学键类型如表9.1所示:表 9.12. 根据下列分子或离子的几何构型,试用杂化轨道理论加以说明。
(1)HgCl 2(直线形);(2) SiF 4(正四面体);(3)BCl 3(平面三角形);(4)NF 3(三角锥形,102°);(5)(V 形,115.4°);(6)(八面体)。
2NO -26SiF -解:分子或离子的几何构型及其杂化理论解释如表9.2所示:表 9.23. 试用价层电子对互斥理论推断下列各分子的几何构型,并用杂化轨道理论加以说明。
解:用价层电子对互斥理论推断分子的几何构型应先计算中心原子的价电子对数,然后确定其空间分布,再根据是否有孤电子对来判断分子构型。
如果价层电子对数等于配位数,则分子的空间构型与电子空间排列相同,否则会存在孤对电子,分子的空间构型与电子空间排列不相同。
中心原子的杂化轨道类型与中心原子的价层电子对数有关,中心原子的价层电子对数等于其参与杂化的原子轨道数。
则可推知题中的分子构型如表9.3所示:表 9.34. 试用VSEPR 理论判断下列离子的几何构型。
解:推断结果如表9.4所示:表 9.45. 下列离子中,何者几何构型为T 形?何者构型为平面四方形?解:根据理论,几何构型为形的分子或离子,其中心原子的价层电子对数VSEPR T 为5,配位原子数为3。
所以在配位原子数为3的离子中的几何构型为形。
几何3XeF +T 构型为平面正方形的分子或离子,其中心原子的价电子对数为6,配位原子数为4。
所以的几何构型为平面正方形。
4ICl -6. 下列各对分子或离子中,何者具有相同的几何构型?解:中心原子价层电子对数相同,配位原子数也相同的分子或离子,一定具有相同的几何构型。

第12 章S 区元素(第一套)一、单选题1. 重晶石的化学式是(A) BaCO3 , (B) BaSO4 , (C) Na2SO4 , (D) Na2CO32. 下列碳酸盐,溶解度最小的是(A) NaHCO3 , (B) Na2CO3 , (C) Li2CO3 , (D) K2CO33. NaN03受热分解的产物是(A) Na2O,NO2,O2;(B)NaNO2,O2;(C)NaN02,N02,02;(D)Na20,N0,02。
4. 下列哪对元素的化学性质最相似(A) Be 和Mg (B) Mg 和Al (C) Li 和Be (D) Be 和Al5. 下列元素中第一电离能最小的是(A) Li (B) Be (C) Na (D) Mg6. 下列最稳定的氮化物是(A) Li3N (B) Na3N (C) K3N (D) Ba3N27. 下列水合离子生成时放出热量最少的是(A) Li+ (B) Na+ (C) K+ (D) Mg2+8. 下列最稳定的过氧化物是(A) Li202 (B) Na202 (C) K202 (D) Rb2029. 下列化合物中键的离子性最小的是(A) LiCl (B) NaCl (C) KCl (D) BaCl210. 下列碳酸盐中热稳定性最差的是(A) BaC03 (B) CaC03 (C) K2C03 (D) Na2C0311. 下列化合物中具有磁性的是(A) Na202 (B) Sr0 (C) K02 (D) Ba0212. 关于s 区元素的性质下列叙述中不正确的是(A) 由于s 区元素的电负性小,所以都形成典型的离子型化合物(B) 在s 区元素中,Be、Mg 因表面形成致密的氧化物保护膜而对水较稳定(C) s 区元素的单质都有很强的还原性(D) 除Be、Mg 外,其他s 区元素的硝酸盐或氯酸盐都可做焰火材料13. 关于Mg , Ca , Sr , Ba及其化合物的性质下列叙述中不正确的是(A) 单质都可以在氮气中燃烧生成氮化物M3N2(B) 单质都易与水水蒸气反应得到氢气(C) M(HCO3)2在水中的溶解度大MC03的溶解度(D) 这些元素几乎总是生成+2 价离子二、是非题(判断下列各项叙述是否正确对的在括号中填“/ 错的填“X”)1. 因为氢可以形成H+所以可以把它划分为碱金属2. 铍和其同组元素相比离子半径小极化作用强所以形成键具有较多共价性3. 在周期表中,处于对角线位置的元素性质相似,这称为对角线规则。

无机化学常见分子价键结构研究苏金昌【摘要】针对无机化学中用价键理论给出的有些物质分子结构不能反映与性质的关系问题,基于现有数据与相关研究,采用杂化轨道理论关于参与杂化的轨道“能量相近”的思想方法,通过代表性实例的分析与比较,给出了有关分子能反映其性质的结构,得出了有些多原子分子的中心原子按照np与(n+1)s轨道杂化后再成键的价键理论新观点.【期刊名称】《高师理科学刊》【年(卷),期】2017(037)009【总页数】8页(P40-47)【关键词】价键理论;分子结构;中心原子;原子轨道;杂化轨道【作者】苏金昌【作者单位】大庆高新研究院化学所,黑龙江大庆163311【正文语种】中文【中图分类】O611.2长期以来,“结构决定性质,性质反映结构”的观点一直是化学学科的重要思想方法.但是,在无机化学中,用价键理论给出的有些物质分子的结构却不能表现与性质的关系.如硫酸有很强的氧化性,但是不能从结构上做出合理的解释.有关结构不能解释性质的现象,以无机化学里含有氮、硫和氯原子的化合物分子比较明显.杂化轨道理论是以碳氢化合物分子为模型所创建的,用来阐述碳氢化合物分子的价键结构很有效.对于非碳氢化合物分子,当中心原子外层占有电子的np轨道能量比ns轨道能量大很多时,由于不符合参与杂化的轨道“能量相近”的原则,如果机械地按照碳氢化合物分子里碳原子那样发生ns与np轨道的杂化,给出有关分子的价键结构就没有了合理性.本文通过列举和分析无机化学常见分子的价键结构,说明价键理论新观点的有效性和适用性.成键方式:观察迈耶尔曲线现代形式图[1]53可以看到,从碳到氮,原子体积突变,氮原子的体积明显比碳大出很多.由于氮原子基态2s与2p轨道能(E2s为-25.6 eV,E2p为-12.9 eV)相差1倍,2s与2p轨道之间很难发生轨道杂化(不符合能量相近的轨道才能杂化的基本条件),2s轨道电子很难有效参与成键.在分析以氮原子为中心的多原子分子的价键结构时,一般不要将氮原子2s轨道电子看成是价电子,要按照氮原子2p与3s轨道杂化后再成键.一般认为,“硝酸分子里的氮原子(2s22p3→2s12pz2py1px1)发生等性sp2杂化(等性杂化是指参与杂化的各轨道的电子数相等),形成1个π34键,其分子的价键结构见图1a”.按照这种观点,由于1个π34键里有2个电子来自氮原子,电子离域(π键电子云密度平均化)后使氮原子的电子云密度比成键前低,氮原子对N-Oσ键电子排斥作用减小,非羟基N-Oσ键的键角O-N-O要小于等性sp2杂化的120°夹角,与实测键角为130°[1]533不符,说明氮原子没有发生等性sp2杂化.笔者认为,“按照硝酸分子里的氮原子(2p33s0→2pz0py1px13s1)发生等性p2s杂化,价键结构见图1b”.氮原子以未参与杂化的2pz空轨道与2个非羟基氧原子各占有1个电子的2p轨道重叠,形成1个π32键(非羟基N-Oσ键键级为1+2/3).由于π32键里的2个电子来自氧原子,氮原子的电子云密度要比成键前高,氮原子对N-Oσ键电子排斥作用增大,非羟基N-Oσ键的键角O-N-O要大于等性p2s杂化的120°夹角,与实测键角为130°相对应(注:羟基里的氢原子与中心原子N不是直接键合关系,它对非羟基键角O-N-O的影响是次要的).由于π32是缺电子型π键,具有很强的得电子倾向,与硝酸有很强的氧化性吻合.分析中心原子与配位原子形成的σ键之间键角的大小,按照中心原子电子云密度的高低进行判断是一种非常简单、有效的方法.本文涉及到中心原子σ键键角的问题都是按照此方法进行分析的.一般认为,“硝酸根离子里的氮原子(2s22p4→2s23pz0px2py2)发生等性sp2杂化,形成3个N→Oσ键,1个π46键,价键结构见图2a”.按照这种观点,N-O键键级为1.5,比硝酸分子里非羟基N-O键的键级(1+2/3)还低,与硝酸盐比硝酸稳定的性质不符,说明氮原子没有发生等性sp2杂化.笔者认为,“按照硝酸根离子里的氮原子(2p43s0→2pz1py1px13s1)发生等性p2s杂化,形成3个N-Oσ键,1个π44键,价键结构见图2b”.由于N-O键键级为2,比硝酸分子里非羟基N-O键的键级(1+2/3)高,与硝酸盐比硝酸稳定的性质吻合.一般认为,“亚硝酸分子里的氮原子(2s22p3→2s12pz1py2px1)发生不等性sp2杂化,形成1个π22键,价键结构见图3a”.按照这种观点,不能合理解释“无法从水溶液里分离出纯亚硝酸”的实验事实.笔者认为,“按照亚硝酸分子里的氮原子(2p33s0→2pz1py1px13s0)发生不等性p2s杂化,形成1个π22键,价键结构见图3b”.由于氮原子不等性p2s杂化有1个空轨道,氮原子电子云密度要比等性p2s杂化低,对N-Oσ键电子排斥作用减小,N-Oσ键角O-N-O要小于等性p2s杂化的120°夹角,与实测键角为111°[2]476相对应.由于亚硝酸分子里的氮原子有1个p2s杂化的非键空轨道,能与水分子里氧原子占有2个电子的非键轨道重叠,形成O→Nσ键,生成一水合亚硝酸分子,与无法从水溶液里分离出纯亚硝酸的实验事实吻合.一般认为,“亚硝酸根离子里的氮原子(2s22p4→2s22pz2py1px1)发生不等性sp2杂化,形成1个π34键,价键结构见图4a”.按照这种观点,N-Oσ键键级为1+2/3,不能从结构上合理解释亚硝酸盐有很高的热稳定性.笔者认为,“按照亚硝酸根离子里氮原子(2p43s0→2pz2py1px13s0)发生不等性p2s杂化,形成1个π34键,价键结构见图4b”.由于氮原子上有1个不等性p2s杂化的非键空轨道,能与金属离子(M)外层占有成对电子的轨道重叠,形成M→Nσ键,生成M→NO2-配离子,与亚硝酸盐有很高的热稳定性吻合.一般认为,“二氧化氮分子里的氮原子(2s22p3→2s12pz2py1px1)发生等性sp2杂化,形成1个π34键,价键结构见图5a”.按照这种观点,不能合理解释N-Oσ键键角O-N-O大于120°夹角.笔者认为,“按照二氧化氮分子里的氮原子(2p33s0→2pz0py1px13s1)发生等性p2s杂化,形成1个π32键,价键结构见图5b”.由于π32是缺电子型π键,具有很强的得电子倾向,与二氧化氮有很强的氧化性吻合.氮原子上有1个非键单电子,易形成二聚分子(四氧化二氮),与二氧化氮极易液化的性质吻合.由于1个π32键里的2个电子来自2个氧原子,氮原子的电子云密度要比成键前高,对N-Oσ键电子的排斥作用增大,N-Oσ键键角O-N-O要大于等性p2s杂化轨道的120°夹角,与实测键角为134°[1]526相对应.有机化学里的硝基与二氧化氮分子结构是一致的,硝基苯中的硝基和苯基共轭能形成1个π98键,使苯环电子云密度降低,钝化苯环.可见,硝基有吸电子的共轭效应,而不是通常认为的硝基有供电子的共轭效应.同理,四氧化二氮分子里氮原子(2p33s0→2pz0py1px13s1)发生等性p2s杂化,每个氮原子以1个未参与杂化的2px空轨道与每个氧原子各占有1个电子的2p轨道重叠,再加上2个氮原子2px空轨道之间的重叠,形成1个π64键.π64键的4个电子全部来自4个氧原子,是缺电子型π键.1.6.1 氨分子一般认为,“氨分子里的氮原子(2s22p3→2s22pz1py1px1)发生不等性sp3杂化,价键结构见图6a”.按照这种观点,由于不等性sp3杂化有1个杂化轨道占有2个电子,氮原子电子云密度要比等性sp3杂化高,对N-Hσ键电子排斥作用增大,N-Hσ键的键角H-N-H要大于等性sp3杂化的109.5°夹角,与实测键角为106.7°[1]74不符,说明氮原子没有发生不等性sp3杂化.笔者认为,“按照氨分子里的氮原子(2p33s0→2pz1py1px13s0)发生不等性p3s杂化,价键结构见图6b”.由于氮原子不等性p3s杂化有1个空轨道,氮原子电子云密度要比等性p3s杂化低,对N-Hσ键电子排斥作用减小,N-Hσ键的键角H-N-H要小于等性p3s杂化的109.5°夹角,与实测键角为106.7°相对应.碱金属或碱土金属能被液氨溶解产生的所谓“氨包电子”现象[1]520佐证了氨分子的氮原子价层里有空轨道,氨分子的氮原子作为电子的接受体,电子进入了空轨道.液氨与活泼金属的反应,如与钠的反应可以表示为:Na+NH3=Na++NH3-.在这个反应里,由于N的电负性较大,吸引电子能力强,Na的电负性较小,极易失去电子,NH3里N的空轨道接受了Na的3s轨道上的1个电子,使Na变成Na+,NH3变成了NH3-(称氨负离子).由于NH3–里氮原子的单电子处于非键轨道里,易发生电子跃迁,使溶液显现颜色,有顺磁性、导电性.NH3-(属于自由基型离子)不稳定,易发生分解反应:2NH3-=2NH2-+H2↑.用分子轨道理论分析氨分子价键结构时,由于氮原子(2s22p3)2s与2p轨道能相差1倍,2s轨道不能与2p轨道发生线性组合,否则不符合组成分子轨道的原子轨道必须“能量相近”的原则,必然得出不合理的结果.按照中心氮原子(2p 33s0)用3个2p轨道,1个3s轨道与3个配位氢原子(1s1)的3个1s轨道组成7个分子轨道(3个成键轨道,1个非键轨道,3个反键轨道),则1个氨分子价层里的6个电子,将分别以成对电子方式分别处于3个成键轨道里.可见,氨分子价层里没有未成键的孤对电子.在常温下,1体积水能溶解700体积的氨.长期以来,人们一直认为是氨与水分子之间的氢键导致氨极易溶解于水.如果按照氨分子图6b的结构,水分子里氧原子的孤对电子占据氨分子里氮原子的空轨道是氨极易溶解于水的重要因素,非氢键所致.还要指出的是,氨分子里氮原子没有孤对电子,氨分子之间不能形成氢键,不能用分子间氢键解释氨沸点异常.氨分子之间的作用力主要是取向力,由于分子间取向力与范德华半径的6次方成反比,氮原子的范德华半径(155 pm)比P (180 pm)、As(185 pm)小很多,导致NH3分子间的取向力比PH3、AsH3大,NH3的沸点比PH3、AsH3高.可见,氢键理论是有待商榷的.1.6.2 一水合氨分子一般认为,“NH3分子与H2O分子相遇形成NH3·H2O 分子”.按照这种观点,将NH3分子与H2O分子之间用“·”连接,使人无法理解NH3·H2O分子的价键关系.提出这种写法,可能是不清楚NH3分子与H2O 分子结合成分子的价键关系,只能用NH3·H2O代替.笔者认为,“NH3分子与H2O分子相遇时,NH3分子中N原子上的空轨道与H2O分子中O原子占有2个电子的非键轨道重叠,形成O→Nσ键,生成配合物分子(H2O→NH3)”.这种价键关系清楚的分子,其化学式不需要在NH3与H2O之间用“·”连接,应该直接写成NH3H2O(或写成H2ONH3),称其为一水合氨(俗称氨水).NH3H2O分子对称性不好,不稳定,易分解生成NH3和H2O.氨水中存在的平衡反应为:NH3+H2O⇌NH3H2O⇌NH+4+OH-.1.6.3 四氨合铜(Ⅱ)离子一般认为,“四氨合铜(Ⅱ)离子里的铜离子(3s23p63d9)发生dsp2杂化,形成4个N→Cu2+,价键结构见图7a”.按照这种结构,有2个错误观点:一是氨分子里氮原子没有占有成对电子的非键轨道,无法形成4个N→Cu2+σ键;二是将1个3d轨道单电子激发到没有参与杂化的能级比较高的1个4p轨道里,这个单电子无法稳定存在,铜(Ⅱ)离子将变成铜(Ⅲ))离子,与铜(Ⅱ)离子很稳定的性质不符.所以,四氨合铜(Ⅱ)离子的价键结构不可能为图7a.笔者认为,“按照四氨合铜(Ⅱ)离子里的铜离子(3s23p63d9)提供4个占有成对电子的3d轨道,并且分别与4个氨分子里每个氮原子提供的1个空轨道重叠,形成4个Cu2+→Nσ键,价键结构见图7b”.在这种结构里,铜离子的1个单电子还是在1个3d非键轨道里,处于相对稳定的状态.同样,对于配离子1.6.4 水合铜(Ⅱ)离子一般认为,“在五水硫酸铜晶体里,有1个水分子与1个四水合铜(Ⅱ)离子、1个硫酸根离子之间通过氢键结合成五水硫酸铜[1]708”.按照这种观点,在加热五水硫酸铜晶体时,首先失去的应该是结合力最弱(以氢键结合)的那1个水分子,但是与实验事实(加热五水硫酸铜晶体,首先失去2个水分子,再失去2个水分子,最后失去1个水分子)不符,说明对水合铜(Ⅱ)离子价键结构的认识是错误的.由于铜(Ⅱ)离子(3s23p63d9)不可能发生等性dsp2杂化(否则会出现有1个3d轨道电子被激发后处于1个能级比较高的4p轨道里,不符合铜(Ⅱ)离子比较稳定的性质),在水溶液里不可能形成四水合铜(Ⅱ)离子.笔者认为,“水合铜(Ⅱ)离子里的铜离子(3d94s04p04d0)用1个占有单电子的3d轨道与1个4s空轨道、3个4p空轨道、1个4d空轨道发生dsp3d杂化.铜离子用6个dsp3d杂化轨道中的5个空轨道分别与5个水分子里氧原子各占有2个电子的非键轨道重叠,形成5个O→Cu2+σ键,生成了五水合铜(Ⅱ)离子”.由于有1个占有单电子的dsp3d杂化轨道没有参与成键,五水合铜(Ⅱ)离子空间构型为四角锥形.由于五水合铜(Ⅱ)离子里的单电子处于dsp3d杂化的1个非键轨道里,而四氨合铜(Ⅱ)离子里的单电子处于1个3d非键轨道里,2个单电子的能量不同,发生电子跃迁时释放(或吸收)光子的波长不同,与五水合铜(Ⅱ)离子和四氨合铜(Ⅱ)离子的颜色不同相吻合.可见,不用有关d轨道分裂的晶体场理论(注:该理论现已不被国外大学化学教材采用)亦能对铜离子的颜色做出合理解释.在五水硫酸晶体里,每个五水合铜(Ⅱ)离子里的铜离子用1个占有2个电子的3d轨道与1个硫酸根离子里硫原子的1个3d空轨道重叠,形成Cu2+→Sσ键,空间构型为变形八面体形.变形八面体之间通过再形成Cu2+→Sσ键将彼此连接起来构成五水硫酸铜晶体.需要说明的是NH4+的价键结构:由于NH+4带1个单位正电荷,相当于氮原子失去1个电子,NH4+里氮原子(2s22p2)的3个2p轨道里就剩2个电子,2p 轨道能降低,与2s轨道能相近,氮原子(2s22p2→2s12pz1py1px1)发生等性sp3杂化,4个各占有1个电子的等性sp3杂化轨道分别与4个氢原子各占有1个电子的1s轨道重叠,形成4个N-Hσ键,键角H-N-H与等性sp3杂化的109.5°夹角一致,NH4+空间构型为正四面体形.可见,对于带有正电荷的离子,在分析价键结构时,要考虑中心原子失去电子后价层轨道能量的变化.一般认为,“羟氨分子里的氮原子(2s22p3→2s22pz1py1px1)发生不等性sp3杂化,价键结构见图8a”.按照这种观点,不能合理解释键角(H-N-H、H-N-O)小于109.5°.笔者认为,“按照羟氨分子里的氮原子(2p33s0→2pz1py1px13s0)发生不等性p3s杂化,价键结构见图8b”.由于不等性p3s杂化有1个空轨道,氮原子电子云密度比等性p3s杂化低,对σ键电子排斥作用减小,氮原子各σ键之间的的键角要小于等性p3s杂化的109.5°夹角,与实测σ键之间的键角(H-N-H为107°、H-N-O为105°)[1]523小于109.5°相对应.由于羟氨分子里氮原子有空轨道,可以做配离子的成配体.如羟氨分子里氮原子的空轨道接受锌离子3d轨道的成对电子,生成[Zn(NH2OH)2]2+.成键方式:一般不要将硫原子的3s轨道电子看成是价电子,要按照硫原子3p与4s轨道杂化后再成键.一般认为,“二氧化硫分子里的硫原子(3s23p4→3s23pz2py1px1)发生不等性sp2杂化,形成1个π34键,价键结构见图9a”.按照这种观点,S-Oσ键键级为1+2/3,不能从结构上合理解释二氧化硫有非常高的热稳定性.如汽车与高炉尾气的高温都不能使尾气里的二氧化硫分解.笔者认为,“按照二氧化硫分子里的硫原子(3p44s03d0→3pz2py1px14s03d0)发生不等性p2s杂化,硫原子用1个未参与杂化的3p轨道,1个3d空轨道分别与每个氧原子的2p轨道重叠,形成2个π34键,价键结构见图9b”.由于S-O 键是叁重键,键级为2+1/3,与实测二氧化硫分子的S-O键键长(143.1 pm)比S=O键键长[2]528(145.6 pm)短吻合,与二氧化硫气体有非常高的热稳定性吻合.由于二氧化硫分子里的硫原子有1个不等性p2s杂化的空轨道没有参与成键,能接受金属原子(M)外层轨道的成对电子,形成M→Sσ键,与二氧化硫分子易与金属原子配位的性质吻合.二氧化硫气体溶于水后,二氧化硫分子里硫原子价层里的1个空轨道与1个水分子里氧原子占有2个电子的非键轨道重叠,形成O→Sσ键,生成一水合二氧化硫分子(H2O→SO2,化学式写成H2OSO2或SO2H2O),与“二氧化硫水溶液里检测不到亚硫酸分子(H2SO3)”[1]501的实验结果吻合.一水合二氧化硫分子的对称性不好,不稳定、易分解.H2OSO2在溶液中存在的平衡反应为:H2O +SO2⇌H2OSO2⇌[HOSO2]-+H+.一般认为,“亚硫酸氢根离子里的硫原子(3s23p5→3s23pz1py2px2)发生不等性sp3杂化,形成2个S→Oσ键,1个S-Oσ键,价键结构见图10a”.按照这种观点,不能从结构上合理解释所有酸式亚硫酸盐都易溶解于水的性质.笔者认为,“按照亚硫酸氢根离子里的硫原子(3p54s03d0→3pz1py1px14s03d2)发生不等性p3s杂化,硫原子用1个3d轨道与每个非羟基氧原子的1个2p轨道重叠,形成1个π34键,价键结构见图10b”.由于硫原子有1个p3s杂化的空轨道没有参与成键,能与水分子里氧原子占有2个电子的非键轨道重叠,形成O→Sσ键,生成一水合亚硫酸氢根离子,与酸式亚硫酸盐易溶解于水的性质吻合.一般认为,“亚硫酸根离子里的硫原子(3s23p6→3s23pz2py2px2)发生等性sp3杂化,价键结构见图11a”.按照这种观点,不能合理解释亚硫酸亚铜比较稳定的性质.笔者认为,“按照亚硫酸根离子里的硫原子(3p64s03d0→3pz1py1px14s13d2)发生等性p3s杂化,硫原子用1个3d轨道与每个氧原子的1个2p轨道重叠,形成1个π45键,价键结构见图11b”.由于亚硫酸根离子里硫原子有1个占有1个电子的p3s杂化轨道没有参与成键,能与亚铜离子(3d94s1)占有1个电子的4s轨道重叠,形成S-Cu+σ键,与亚硫酸亚铜比较稳定的性质吻合.一般认为,“三氧化硫气体分子里的硫原子(3s23p4→3s23pz0py2px2)发生等性sp2杂化,形成3个S→Oσ键,1个π46键,价键结构见图12a”.按照这种观点,S-O键级为1.5,与三氧化硫气体有非常高的热稳定性不符,说明硫原子没有发生等性sp2杂化.笔者认为,“按照三氧化硫气体分子里硫原子(3p44s03d0→3pz1py1px14s13d0)发生等性p2s杂化,硫原子用1个未参与杂化的3p轨道,1个3d空轨道分别与每个氧原子的2p轨道重叠,形成3个S-Oσ键,1个π44键,1个π64键,价键结构见图12b”.由于S-O键是叁重键,键级为2.5,与实测三氧化硫气体分子里S-O键键长(142 pm)比S=O键键长(145.6 pm)短吻合,与三氧化硫气体很难分解的性质吻合.一般认为,“硫酸分子里硫原子(3s23p4→3s13pz1py2px2)发生不等性sp3杂化,价键结构见图13a”.按照这种观点,不能从结构上合理解释硫酸有非常高的热稳定性,更不能合理解释硫酸有很强的氧化性.笔者认为,“按照硫酸分子里的硫原子(3p44s03d0→3p34s13d0)发生等性p3s杂化,硫原子用2个3d空轨道分别与每个非羟基氧原子的2p轨道重叠,形成1个π32键、1个π43键,价键结构见图13b”.硫酸分子里的非羟基S-O 键是叁重键,键级是2+1/3,与实测硫酸分子里S-O键键长(142.6 pm)比S=O键键长(145.6 pm)短吻合,与硫酸有非常高的热稳定吻合.π32是缺电子型π键,有很强的得电子倾向,与硫酸有很强的氧化性吻合.一般认为,“硫酸氢根离子里的硫原子(3s23p5→3s13p z2py2px2))发生不等性sp3杂化,价键结构见图14a”.按照这种观点,不能从结构上合理解释硫酸氢根离子氧化性没有硫酸分子强.笔者认为,“按照硫酸氢根离子里的硫原子(3p54s03d0→3p34s13d1)发生等性p3s杂化,硫原子用1个3d轨道与每个非羟基氧原子的1个2p轨道重叠,形成1个π44键,价键结构见图14b”.由于1个π44是等电子型π键,没有硫酸分子里的1个π32缺电子型π键那么强的得电子倾向,其氧化性没有硫酸分子强.由于每个非羟基S-O键键级为2,与硫酸氢盐有很高的热稳定性吻合.一般认为,“硫酸根离子里的硫原子(3s23p6→3s23pz2py2px2)发生等性sp3杂化,价键结构见图15a”.按照这种观点,不能从结构上合理解释根据S-O键键长判断S-O键有接近双键的特征.笔者认为,“按照硫酸根离子里的硫原子(3p64s03d0→3p34s13d2)发生等性p3s杂化,硫原子用1个3d轨道与每个氧原子的1个2p轨道重叠,形成1个π56键,价键结构见图15b”.由于每个S-O键键级为1.8(与实测硫酸根离子里S-O键键长(149 pm)比1个S=O键键长(145.6 pm)长吻合),接近2级,而且硫酸根离子正四面体构型有很高的对称性,说明硫酸根离子有很高的稳定性(提示:在硫酸根离子里,硫原子不可能以4个3d空轨道分别与4个氧原子各占有2个电子的2p轨道重叠,形成4个O→Sπ22键,因为每个3d空轨道空间伸展方向各不同,与氧原子的2p轨道即使重叠,键长将不相同,将导致成键后的硫酸根离子不可能是正四面体形,与硫酸根离子空间构型是正四面体形不符).成键方式:一般不要将氯原子3s轨道电子看成是价电子,要按照氯原子3p与4s 轨道杂化后再成键.一般认为,“二氧化氯分子里的氯原子(3s23p5→3s23pz1py2px2)发生等性sp2杂化,形成1个π53键,价键结构见图16a”.按照这种观点,不能合理解释二氧化氯气体极易液化的性质.笔者认为,“按照二氧化氯分子里的氯原子(3p54s0→3pz2py1px14s1)发生等性p2s杂化,形成1个π43键,价键结构见图16b”.由于氯原子价层里还有1个非键单电子,易聚合成2聚分子,与二氧化氯气体极易液化的性质吻合.一般认为,“氯酸分子里的氯原子(3s23p5→3s23pz1py2px2)发生不等性sp3杂化,其价键结构见图17a.按照这种观点,不能从结构上合理解释氯酸有氧化性.笔者认为,“按照氯酸分子里的氯原子(3p54s03d0→3pz1py1px14s03d2)发生不等性p3s杂化,氯原子用1个3d轨道与每个非羟基氧原子的1个2p轨道重叠,形成1个π34键(Cl-O键键级为1+2/3),价键结构见图17b”.由于π34键有得电子倾向,与氯酸有氧化性吻合.由于氯原子有1个p3s杂化的非键空轨道,能与水分子里氧原子占有2个电子的非键轨道重叠,形成O→Clσ键,生成一水合氯酸分子,导致无法从水溶液里分离出纯氯酸.一般认为,“亚氯酸分子里的氯原子(3s23p5→3s23pz1py2px2)发生不等性sp3杂化,其价键结构见图18a”.按照这种观点,不能合理解释亚氯酸有很强的氧化性.笔者认为,“按照亚氯酸分子里的氯原子(3p54s03d0→3pz1py1px14s03d2)发生不等性p3s杂化,氯原子用1个3d轨道与1个非羟基氧原子的1个2p轨道重叠,形成1个π23键(非羟基Cl-O键键级为1.5),价键结构见图18b”.由于氯原子p3s杂化后有1个非键电子,有很强的得电子的倾向,其氧化性比有π34键的氯酸分子强.由于非羟基Cl-O键键级为1.5,比氯酸分子非羟基Cl-O键键级(1+2/3)低,亚氯酸稳定性不如氯酸.由于氯原子有1个p3s杂化的非键空轨道,能与水分子里氧原子占有2个电子的非键轨道重叠,形成O→Clσ键,生成一水合亚氯酸分子,导致不能从水溶液里分离出纯亚氯酸.一般认为,“高氯酸分子里的氯原子(3s23p5→3s23pz1py2px2)发生不等性sp3杂化,价键结构见图19a”.按照这种观点,不能从结构上合理解释高氯酸是唯一能从水溶液中分离出来的氯的含氧酸,有比较高的稳定性.笔者认为,“按照高氯酸分子里的氯原子(3p54s03d0→→3p z1py1px14s13d1)发生等性p3s杂化,氯原子用1个3d轨道与每个非羟基氧原子的1个2p轨道重叠,形成1个π44键,价键结构见图19b”.由于每个非羟基Cl-O键键级为2,说明高氯酸比其他氯的含氧酸稳定.由于高氯酸分子里的氯原子没有非键空轨道,不能与水分子形成配分子,能从水溶液里分离出高氯酸.一般认为,“高氯酸根离子里氯原子(3s23p6→3s23pz2py2px2)发生等性sp3杂化,价键结构见图20a”.按照这种观点,不能从结构上合理解释高氯酸盐比较稳定.笔者认为,“按照高氯酸根离子里的氯原子(3p64s03d0→3pz1py1px14s13d2)发生等性p3s杂化,氯原子用1个3d轨道与每个氧原子的1个2p轨道重叠,形成1个π56键,价键结构见图20b”.由于每个Cl-O键键级为1.8(1+4/5),有接近双键的特征,而且其正四面体形的空间结构有非常高的对称性,说明高氯酸盐比较稳定.一般认为,“氯酸根离子里的氯原子(3s23p6→3s23pz2py2px2)发生等性sp3杂化,其价键结构见图21a”.按照这种观点,不能合理解释氯酸根离子有很强的氧化性.笔者认为,“按照氯酸根离子里的氯原子(3p64s03d0→3pz1py1px14s13d2)发生等性p3s杂化,氯原子用1个3d轨道与每个氧原子的1个2p轨道重叠,形成1个π45键,价键结构见图21b”.由于氯酸根离子每个Cl-O键键级为1+3/4,比氯酸分子的非羟基Cl-O键键级(1+2/3)高,与氯酸根离子比氯酸分子稳定的性质吻合.由于氯原子p3s杂化后有1个单电子没有参与成键,有很高的化学活性,有很强的得电子倾向,与氯酸根离子有很强氧化性吻合.一般认为,“亚氯酸根离子里的氯原子(3s23p6→3s23pz2py2px2)发生等性sp3杂化,其价键结构见图22a”.按照这种观点,不能从结构上合理解释亚氯酸盐常温下比较稳定.如亚氯酸钠碱性溶液放置1年也不分解,无水亚氯酸钠加热到350°时尚不分解.笔者认为,“按照亚氯酸根离子里的氯原子(3p64s03d0→3pz2py1px14s13d1)发生不等性p3s杂化,氯原子用1个3d轨道与每个氧原子的1个2p轨道重叠,形成1个π33键,价键结构见图22b”.由于亚氯酸根离子每个Cl-O键键级为2,说明亚氯酸根离子比亚氯酸分子(非羟基Cl-O键键级为1.5)稳定,与亚氯酸盐有比较高的稳定性吻合.由于氯原子价层里有1个单电子没有参与成键,有很强的得电子倾向,与亚氯酸根离子有很强的氧化性吻合.一般认为,“次氯酸根离子里的氯原子(3s23p6→3s23pz2py2px2)发生等性sp3杂化,价键结构见图23a”.按照这种观点,不能合理解释次氯酸根离子有很强的氧化性.笔者认为,“按照次氯酸根离子里的氯原子(3p64s03d0→3pz2py2px14s13d0)发生不等性p3s杂化,氯原子用1个3d空轨道与氧原子的1个2p轨道重叠,形成1个π21键,价键结构见图23b”.由于Cl-O键键级为1.5,说明次氯酸根离子比亚氯酸根离子(Cl-O键键级为1+2/3)还不稳定.由于氯原子上未成键的单电子和Cl-Oπ21都有很强的得电子倾向,与次氯酸离子有很强的氧化性吻合.。

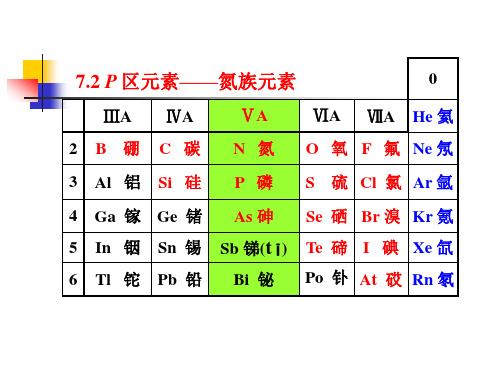
武汉大学版无机化学课后习题答案--14氮族元素第十四章 氮族元素1. 用MO 理论讨论N 2和NO 分子中的成键情况,并指出两者键级是多少? 答:N 2 :2222222*222pp p s s KK σππσσ 键级3 NO :1*22222222*222pp p p s s KK πσππσσ 键级2.5。
2.解释下列问题:(1)虽然氮的电负性比磷高,但是磷的化学性质比氮活泼?(2)为什么Bi(V)的氧化能力比同族其他元素强?答:(1) 氮的电负性比P 高,但氮不如P 活泼,这是由俩者单质的结构不同决定的。
N 的半径很小,但N 原子间形成三重键,叁键的键能很高,难以断开,因而N 2很不活泼。
P 原子半径很大,而使P 原子间的p 轨道重叠很小,不能形成多重键。
P-P 单键键能很小,很容易断开。
特别白磷的P-P-P 键角小张力大,更活泼。
(2) Bi(v)的氧化能力比同族其他元素强的多,出现了充满4f、5d,而4f、5d对电子的屏蔽作用较小,而6s具有较大的穿透能力,所以6s电子能级显著降低,不易失去,有“惰性电子对效应”。
失去2 个6s电子的Bi(v 更倾向于得到2个电子形成更稳定的Bi3+。
3.试从分子结构上比较NH3、HN3、N2H4和NH2OH等的酸碱性。
答:NH3结构见书648HN3结构见书658N2H4结构见书655NH2OH结构见书658得出酸性HN3> NH2OH > N2H4> NH3碱性相反。
4.试比较下列化合物的性质:(1)NO-3和NO-2的氧化性;(2)NO2、NO和N2O在空气中和O2反应的情况;(3)N2H4和NH2OH的还原性。
答:(1) 氧化性NO2->NO3-;(2) NO2不与空气反应;NO与空气在常温下即可反应,产生红棕色烟雾。
N2O也不与空气反应。
(3)还原性:N2H4 >NH2OH5.硝酸铵可以有下列两种热分解方式:NH4NO3(s)=NH3(g)+HNO3(g)ΔHθ=171kJ·mol-1NH4NO3(s)= N2O(g)+2 H2O(g) ΔHθ=-23 kJ·mol-1根据热力学的观点,硝酸铵固体按照哪一种方式分解的可能性较大。

无机化学知识点总结大一下无机化学知识点总结作为化学的一个分支,无机化学研究的是无机物的性质、合成和应用。
无机化学是化学科学的基石之一,是理解和应用其他化学学科的基础。
本文将对大一下学期学习的无机化学知识点进行总结,帮助读者更好地理解和掌握相关知识。
一、键的类型和性质在无机化学中,化学键的类型和性质是非常重要的基础知识。
最常见的键类型是共价键和离子键。
1. 共价键:共价键是由两个非金属原子通过共享电子而形成的化学键。
共价键的性质包括极性与非极性的区分,电子云的重叠程度决定了键的强弱。
2. 离子键:离子键是由金属与非金属之间的电荷转移而形成的化学键。
离子键的性质包括结晶的架构和强烈的电荷排斥效应。
除了共价键和离子键,还有其他一些特殊的键类型,例如金属键、氢键和范德华力等,它们在不同的情况下发挥着重要的作用。
二、配位化学配位化学研究的是过渡金属离子或原子团与配位体之间的相互作用。
在配位化学中,需要了解一些重要的概念和原理。
1. 配位数:指一个中心金属离子或原子团周围可以与其形成化学键的配位体的个数。
配位数对于配合物的性质具有重要影响。
2. 配位键型:根据配位体与中心金属之间的化学键类型,可将配合物分为配位键性质相同的不同配位键型。
3. 含氮杂环配体:常见的含氮杂环配体包括吡啶、咪唑、咪唑啉等,它们在配位化学中具有重要的应用。
三、卤素化合物卤素化合物是含有卤素(氟、氯、溴、碘)的化合物。
在无机化学中,卤素化合物的制备和性质研究是一个重要的课题。
1. 卤化钠和卤化银:卤化钠和卤化银是常见的卤素化合物。
它们可以用作制备其他卤素化合物的原料。
2. 卤素的氧化还原性:卤素具有氧化性和还原性,可以通过氧化和还原反应生成不同的卤素化合物。
3. 卤素的应用:卤素化合物在生活和工业中有广泛的应用,如卤素灯、消毒剂、光敏剂等。
四、配合物的颜色在无机化学中,配合物的颜色常常引人注目,同时也是研究配合物结构和性质的重要依据。


无机化学化学键与分子结构无机化学是研究无机物质的元素组成、化学键与分子结构的科学分支。
无机化学中的化学键是指相邻的两个原子之间通过共享、转移或互相吸引电子而形成的连接。
化学键的强度和性质决定了无机化合物的化学和物理性质。
而分子结构则是指无机化合物中原子的排列方式和空间结构。
本文将探讨无机化学中的化学键和分子结构,并举例说明它们对无机化合物性质的影响。
无机化学中常见的化学键包括离子键、共价键和金属键。
离子键是由正负离子之间的电荷吸引力形成的,通常发生在金属与非金属之间。
离子键通常具有高熔点和良好的导电性,因为它们包含着大量的离子。
共价键是由非金属原子之间共享电子而形成的,包括极性共价键和非极性共价键。
极性共价键中,共享电子并不平均分配,导致分子中有正负电荷的部分,如水分子中的氧原子和氢原子。
非极性共价键中,电子平均分配,如氧气分子中的两个氧原子。
金属键是由金属原子之间的电子云形成的,它们具有高导电性和高热导性。
化学键的性质决定了无机化合物的化学和物理性质。
离子键的存在使离子化合物具有高熔点和良好的导电性,因为需要大量的能量来克服离子间的电荷吸引力。
共价键通常导致分子化合物的形成,这些化合物的熔点较低,不导电。
金属键的存在使金属具有高导电性和高热导性,因为电子在金属之间自由移动。
分子结构也对无机化合物的性质产生重要影响。
分子结构决定了化合物的形状和空间排列,影响了化合物的化学反应性和物理性质。
例如,正四面体型分子结构的四氯化碳会导致分子间的分散力增强,因此其熔点较高。
而二氧化硅的分子结构是由硅和氧原子的网状排列构成的,使其形成了三维结构,这导致了其高熔点和硬度。
分子结构还可以影响化合物的光学性质。
例如,金刚石的分子结构使它具有高折射率和高抛光度,因此被用作宝石。
另一个例子是氯化铜的分子结构,它通过吸收可见光的一些波长而呈现出独特的蓝色。
需要指出的是,无机化学中的化学键和分子结构往往比有机化学更为复杂,因为无机化合物通常具有更多、更大和更多样化的原子。

无机化学特殊键型编号13 特殊键型附重要化合物结构(课堂笔记)(π键缺电子键多重金属键“有张力”的键磷氢键氧桥键过氧键)2010级化学一班李海波一、π键π键代表分子(自己补充)d-pπ反馈键K[Pt(C2H4)Cl3]、K[Pt(C2H2)Cl3]、M x(CO)y[V(CO)6、Fe(CO)5、Co2(CO)8]、H3PO4(p→dπ键)、SiO4d-dπ键p-pπ键CO学习要求:准确知道相关原子之间用的轨道,相关原子提供的电子以及相关原子成键的类型(σ,π,σ、π、δ多重键)......................................................。
.1、[Pt(C2H4)Cl3]-具有平面正方形结构,Pt2+价电子结构5d8,Pt2+先dsp2杂化,杂化轨道分别与3个Cl-和一个CH2=CH2成键。
乙烯的π电子。
3个Cl-的孤对电子和乙烯的π电子进入Pd2+的空轨道,形成σ配键。
另外,Pd2+的未参加杂化的d轨道中的电子可以部分地反馈到乙烯的π*反键轨道,形成d-p反馈π键。
这种结构使乙烯分子活化。
2、在金属羰合物中,配体CO分子以碳原子上的孤对电子向金属原子空的杂化轨道进行端基配位,形成σ键。
同时,为了不使金属原子的负电荷过度集中,金属原子d轨道上的电子可部分地反馈到配体的能级相近的且对称性匹配的π*轨道上,形成d-pπ反馈键,增强了该化合物的稳定性。
类似的配体还有:N2、CN-、NO+、C2H2、C2H4、CP、C6H6。
3、H3PO4中,非羟基氧3个2p轨道上的4个电子被压在2个轨道中,两两成对,空出一个2p 轨道,可以接受磷原子sp3杂化轨道上的孤对电子,形成σ配位键。
与此同时,氧原子上的两对孤对电子可与磷原子空的3d轨道重叠形成2个p→dπ配位键,但是这里的2个p→dπ配位键有效性不强,所以P-O之间虽然是三重键,但实际上测得的键长接近双键。
格氏盐、H2SO4、HClO4等含有非羟基氧的分子中都有p→dπ键。

键级
又称键序。
描述分子中相邻原子之间的成键强度的物理量。
表示键的相对强度。
键级最初为衡量化学键强度的参量被引出。
指键合两原子形成化学键的重数,经典有机化学理论把键级只取做整数。
特点:键级高,键强;反之;键弱;即:对于键级小于 4 的大多数分子而言,键级越大,分子越稳定。
对于定域共价键,键级=1/2(成键电子数-反键电子数)。
例如,H2的键级为1,O2为2,N2为3,少数的过渡金属可产生键级为4(四重键)、5(五重键)、6(六重键)的化合物,但相当少见。
对于离域π键,相邻原子i和j之间的π键键级为:其中nk是第k个分子轨道中的π电子数,Cki和Ckj分别是第k个分子轨道中i和j的原子轨道的组合系数。
例如,烯丙基阳离子的2个π电了占据ψ1,。
键级=(稳定结构的电子总数-价电子总数)/2(更方便计算)
键级=(成键轨道电子数-反键轨道电子数)/2。