中级无机化学复习题及参考答案
- 格式:pdf
- 大小:257.27 KB
- 文档页数:1

中级无机化学选论课后练习题含答案1. 硝酸铜在水溶液中的电离方程式是什么?硝酸铜在水溶液中的电离方程式如下所示:Cu(NO3)2 → Cu2+ (aq) + 2 NO3- (aq)2. 硝酸铜水溶液的颜色是什么?硝酸铜水溶液的颜色为蓝色。
3. 制备硝酸铜的方法是什么?制备硝酸铜的方法是将铜与硝酸反应,得到硝酸铜:Cu + 4 HNO3 → Cu(NO3)2 + 2 NO2 + 2 H2O4. 铁在盐酸中溶解的方程式是什么?铁在盐酸中溶解的方程式如下所示:Fe + 2 HCl → FeCl2 + H25. 氯化铜加入氢氧化钠水溶液的反应结果是什么?氯化铜加入氢氧化钠水溶液会产生蓝色沉淀,化学方程式如下所示:CuCl2 + 2 NaOH → Cu(OH)2 ↓ + 2 NaCl6. 碘化钠加入水中的反应结果是什么?碘化钠加入水会使水变黄,化学方程式如下所示:N + H2O → Na+ (aq) + I- (aq) + H2O7. 氧气在室温下可以被什么元素直接氧化?在室温下,氧气可以被铜直接氧化。
8. 恒量的氧气和碳单质的化学反应生成什么?恒量的氧气和碳单质的化学反应会生成二氧化碳。
C + O2 → CO29. 氯气和钠的反应式是什么?氯气和钠的反应式如下所示:Cl2 + 2 Na → 2 NaCl10. 氟气和钾的反应式是什么?氟气和钾的反应式如下所示:2 K + F2 → 2 KF11. 氢氧化镁的化学式是什么?氢氧化镁的化学式是 Mg(OH)2。
12. 硝酸铵的化学式是什么?硝酸铵的化学式是 NH4NO3。
13. 过氧化钠的化学式是什么?过氧化钠的化学式是 Na2O2。
答案:1.Cu(NO3)2 → Cu2+ (aq) + 2 NO3- (aq)2.蓝色3.Cu + 4 HNO3 → Cu(NO3)2 + 2 NO2 + 2 H2O4.Fe + 2 HCl → FeCl2 + H25.CuCl2 + 2 NaOH → Cu(OH)2 ↓ + 2 NaCl6.N + H2O → Na+ (aq) + I- (aq) + H2O7.铜8.C + O2 → CO29.Cl2 + 2 Na → 2 NaCl10. 2 K + F2 → 2 KF11.Mg(OH)212.NH4NO313.Na2O2。

第一章、酸碱理论1.下列化合物中,哪些是路易斯酸,哪些是路易斯碱?BH4-,PH3,BeCl2,CO2,CO,Hg(NO3)2,SnCl2解答:路易斯酸BeCl2,CO2,CO,Hg(NO3)2,SnCl2路易斯碱PH3,CO,SnCl22.写出下列物种的共轭酸和共轭碱:NH2,NH2,H2O,HI,HSO4-解答:共轭酸共轭碱NH3:NH4+ NH2-NH2-:NH3NH2-H2O:H3O+OH-HI:I-HSO4-:H2SO4SO42-3.下列各对中哪一个酸性较强?并说明理由。
(a) [Fe(H2O)6]3+和[Fe(H2O)6]2+ (b) [Al(H2O)6]3+和[Ga(H2O)6]3+(c) Si(OH)4 和Ge(OH)4 (d) HClO3和HClO4(e) H2CrO4 和HMnO4 (f) H3PO4和H2SO4解答:(a) [Fe(H2O)6]3+和[Fe(H2O)6]2+路易斯酸性:前者,中心离子电荷高,吸引电子能力大质子酸性:前者,中心离子电荷高,对O的极化能力大,H+易离解;(b)[Al(H2O)6]3+和[Ga(H2O)6]3+路易斯酸性:前者,中心离子半径小,d轨道能量低质子酸性:前者,中心离子半径小,对O的极化能力大,H+易离解;(c) Si(OH)4 和Ge(OH)4路易斯酸性:前者,中心离子半径小,d轨道能量低质子酸性:前者,中心离子半径小,对O的极化能力大,H+易离解;(d) HClO3和HClO4 (e) H2CrO4 和HMnO4 (f) H3PO4和H2SO4均为后者,非羟基氧原子多,酸性越强。
4.应用Pauling规则,(1) 判断H3PO4(pKa=2.12)、H3PO3(pKa=1.80)和H3PO2(pKa=2.0)的结构;(2) 粗略估计H3PO4、H2PO4-和HPO42-的pKa值。
解答:(1)根据pKa值判断,应有相同非羟基氧原子。
(2)H3PO4:一个非羟基氧原子,pKa值约为2;H2PO4-pKa值增加5,约为7;HPO42-pKa约为12。

济南大学继续教育学院中级无机化学复习题一、单项选择题1.相同温度下,与质量分数1%的尿素水溶液具有相同渗透压的葡萄糖溶液的质量分数约为A. 1%B. 2%C. 3%D. 4%2.从天然铀分离235U的方法是A. 气体扩散B.电解C. 电离D. 水解3.将NH4NO3固体溶于水,溶液变冷。
则该过程的△G、△H和△S的符号依次为A. + --B. + + -C. - + -D. - + +4.将pH=1的盐酸与pH=12的NaOH溶液等体积充分混合,则混合溶液的pHA. 介于1~2B. 介于6~7C. 介于7~8D. 介于12~135.下列反应在较高温度下才可能自发进行的是A. N2(g) + O2(g) = 2NO(g), △H= +163 kJ·mol-1B. 2Ag(s) + Cl2(g) =2AgCl(s), △H= -254 kJ·mol-1C. 2HgO(s) = 2Hg(l) + O2(g), △H= +183 kJ·mol-1D. 2H2O2(l) =2H2O(l) + O2(g), △H= -196 kJ·mol-16.下图是酸性溶液中Mn元素的电势图。
则酸性溶液中稳定存在的微粒是A. MnO4-B. MnO42-C. Mn3+D. Mn2+7. 在1273 K、98.66 kPa下,硫蒸气的密度是0.5977 g·dm-3,则其分子式为A.SB.S2C.S4D.S88. 298 K、100 kPa时,下列几种气体组成的混合气体中分压最小的是A. 0.5 g 氢气B. 1.0 g 氦气C. 5.0 g氮气D. 10.0 g二氧化碳气体9. 下列氧化还原电对中,E 值最大的是A. Ag+/AgB. AgCl/AgC. AgBr/AgD. AgI/Ag10.电极电势与pH无关的电对是A. H2O2/H2OB. MnO4-/MnO42-C. MnO2/Mn2+D. IO3-/I-11.下列分子或离子中,中心原子采取等性sp3杂化的是A. NCl3B. SF4C. CHCl3D. H2O12. 下列有关物质的性质对比判断正确的是A. 分解温度Na2CO3 > CuCO3B. 熔点KCl > NaClC. 溶解度AgCl > AgFD. 分子间作用力HCl > HI13. M2+离子原子核外第三电子层中有15个电子,则M的元素符号是A. NiB. CoC. FeD. Mn14.下列各组元素第一电离能按递减顺序排列的是A.Mg Al SiB.B C NC.P As SbD.S Cl Br15.下列化合物属于“含非极性共价键的离子化合物”的是A. H2O2B. CH4C. NaOHD. Na2O216.下列化合物中,氧呈现+2氧化态的是A. Cl2O5B.BrO2 C. HClO2 D. F2O17.在甲醛(HCHO)及甲酰氯(HCOCl)中,碳的氧化态分别是A. +4,+4B. +4,+2C. 0,0D. 0,+218.在Cr2O72-/Cr3+半电池中,如果Cr2O72-、Cr3+的浓度均为1mol·dm-3,H+的浓度2mol·dm-3,则电极电势比标准电极电势A. 大B. 小C. 不变D. 不能判断19.在NO3--NO的半电池中,降低溶液的酸度,NO3-的氧化能力A. 增大B. 减小C. 不变D. 无法判断20.下列反应:4Al+3O2+6H2O→4Al(OH)3的△r G m =-zFE ,式中z等于A. 12B. 6C. 4D. 321.相同温度下,与质量分数3%的葡萄糖水溶液具有相同渗透压的尿素溶液的质量分数约为A. 1%B. 2%C. 3%D. 4%22.氢气和氧气的扩散速率比为A. 16B.4C. 1/4D. 1/1623.浓硫酸溶于水的过程中下列热力学函数变量△G、△H和△S的符号依次为A. - + -B. + + +C. - - +D. - + +第 1 页共14 页。

无机化学习题参考答案第一章1.4.解:〔1〕H 2O 22C〔2〕S 2O 32- 3v C 〔3〕N 2O (N -N -O 方式) v C ∞〔4〕Hg 2Cl 2h D ∞〔5〕H 2C=C=CH 2 2d D 〔6〕UOF 4 C 5v 〔7〕BF 4-d T 〔8〕SClF 54v C〔9〕反-Pt(NH 3)2Cl 22h D〔10〕PtCl 3(C 2H 4)- 2v C1.B(CH 3)3和BCl 3相比,哪一个的Lewis 酸性强,为什么?一般来说,CH 3为推电子基团,Cl 为吸电子基团,因此的Lewis 酸性强。
〔BCl 3易水解;B(CH 3)3不溶于水,在空气中易燃〕2.BH 3和BF 3都可和(CH 3)2NPF 2生成加合物,在一种加合物中,B 原子和N 相连,另一种则和P 相连,绘出两种结构式,并说明形成两种结构的原因。
PFFH 3CH 3PF F H 3CH 3B BH 3F 3(该题可参考史启桢等翻译的"无机化学",作者Shriver 等,由高教社出版, 其中关于热力学酸度参数的部分,p.190-191; 或者该书的英文原版第5章的相关内容)3. 无水AlCl 3可作为傅-克烷基化反应的催化剂, 而吸水后则失效, 原因何在? 配位饱和〔6配位〕,失去Lewis 酸性4. 吸水后失效 的AlCl 3有什么方法可以脱水?因为Al 3+是典型的硬酸,与氧的亲合力很强,因此实验室不能在HCl ,NH 4Cl ,SOCl 2等气氛下加热脱水。
〔只能加强热生成 Al 2O 3后,用高温下用加C 和Cl 2用复原氯化法制备,这就不是脱水方法了〕。
第二章2.1 解:Ni 2+ d 8组态Pt 2+ d 8组态 第四周期〔分裂能小〕第六周期〔分裂能大〕P Ni ClP ClClCl P Ptrans cis四面体构型 平面四方形构型〔两种构型〕 只有一种结构 〔P 代表PPh 3〕2.2 解 〔1〕MA 2B 4〔2〕MA 3B 3M A ABB M ABA BM ABAB M A AA Btrans cis fac(面式) mer(经式) D 4h C 2v C 3v C 2v μ=0 μ≠0 μ≠0 μ≠0μfac >μmer2.3 Co(en)2Cl 2+D 2hC 2 光活异构体 C 2Co(en)2(NH 3)Cl 2+33Htrans cisCo(en)(NH3)2Cl2+3Cl333NHNH33trans(1) trans(2)cis2.4 Co(en)33+Ru(bipy)32+手性分子D3D3PtCl(dien)+dienHNCH2CH2CH2NH2NH2CH2基本上为平面分子,无手性2.5 (1) 分别用BaCl2溶液滴入,有白色沉液出现的为[Co(NH3)5Br]SO4,或分别加入AgNO3溶液,产生浅黄色沉淀的为[Co(NH3)5SO4]Br。
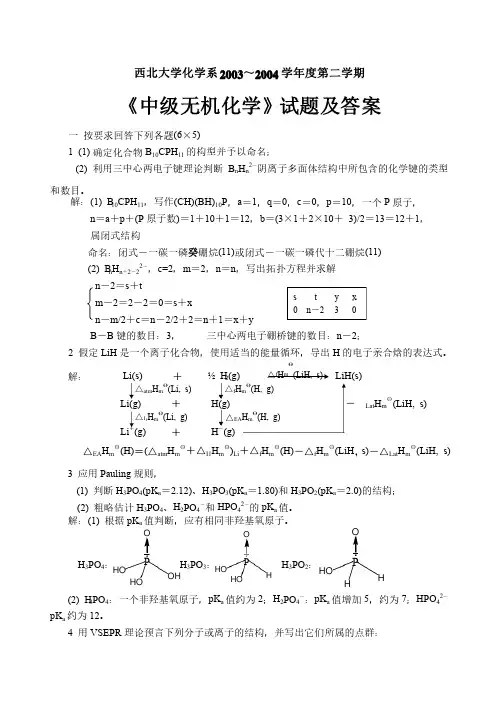
西北大学化学系2003~2004学年度第二学期《中级无机化学》试题及答案一 按要求回答下列各题(6×5)1 (1) 确定化合物B 10CPH 11的构型并予以命名;的构型并予以命名;(2) 利用三中心两电子键理论判断B n H n 2-阴离子多面体结构中所包含的化学键的类型和数目。
和数目。
解:(1) B 10CPH 11,写作(CH)(BH)10P ,a =1,q =0,c =0,p =10,一个P 原子,原子,n =a +p +(P 原子数)=1+10+1=12,b =(3×1+2×10+ 3)/2=13=12+1,属闭式结构属闭式结构命名:闭式-一碳一磷癸硼烷(11)或闭式-一碳一磷代十二硼烷(11)(2) B n H n +2-22-,c=2,m =2,n =n ,写出拓扑方程并求解,写出拓扑方程并求解n -2=s +tm -2=2-2=0=s +xn -m/2+c =n -2/2+2=n +1=x +y B -B 键的数目:3, 三中心两电子硼桥键的数目:n -2;2 假定LiH 是一个离子化合物,使用适当的能量循环,导出H 的电子亲合焓的表达式。
解:解: Li(s) + ½ H 2(g)LiH(s) Li(g)+ H(g) -△Lat H m θ(LiH, s)Li +(g) + H -(g) △EA H m θ(H)=(△atm H m θ+△I 1H m θ)Li +△f H m θ(H)-△f H m θ(LiH ,s)-△Lat H m θ(LiH, s) 3 应用Pauling 规则,规则,(1) 判断H 3PO 4(pK a =2.12)、H 3PO 3(pK a =1.80)和H 3PO 2(pK a =2.0)的结构;的结构;(2) 粗略估计H 3PO 4、H 2PO 4-和HPO 42-的pK a 值。
值。
解:(1) 根据pK a 值判断,应有相同非羟基氧原子。

中级无机化学试题及答案一、选择题(每题2分,共20分)1. 下列元素中,哪一个是过渡金属?A. 铁B. 碳C. 氧D. 钠答案:A2. 以下化合物中,哪一个是共价化合物?A. NaClB. HClC. MgOD. Fe答案:B3. 哪种类型的晶体结构具有最紧密的堆积?A. 简单立方B. 体心立方C. 面心立方D. 六角密堆积答案:D4. 哪个元素的原子序数是26?A. 铁B. 钴C. 镍D. 锌答案:C5. 以下哪个元素是碱土金属?A. 锂B. 铍C. 钙D. 钡答案:C6. 哪种类型的键是离子键?A. NaCl中的键B. HCl中的键C. O2中的键D. C2H4中的键答案:A7. 以下哪个化合物是超酸?A. HClB. H2SO4C. H3PO4D. H2S答案:B8. 哪个元素属于卤素?A. 氟B. 氯C. 溴D. 碘答案:B答案:A, B, C, D9. 以下哪种化合物是金属有机化合物?A. 四氯化碳B. 四氯化钛C. 四氯化锆D. 四氯化铌答案:B10. 哪种类型的晶体结构具有最紧密的堆积?A. 简单立方B. 体心立方C. 面心立方D. 六角密堆积答案:D二、填空题(每题2分,共20分)11. 过渡金属元素通常位于周期表的________区和________区。
答案:d区和f区12. 根据八隅体规则,碳原子最多可以形成________个共价键。
答案:413. 金属键是由________和________之间的相互作用形成的。
答案:金属离子和自由电子14. 元素周期表中,第________周期是最长的周期。
答案:六15. 元素的电负性越大,其非金属性越________。
答案:强16. 金属晶体的堆积方式主要有简单立方堆积、体心立方堆积和________堆积。
答案:面心立方17. 碱金属元素位于周期表的________族。
答案:一18. 元素的原子半径随着原子序数的增加而________(增大/减小)。

《无机化学》试题使用教材:中等职业学校规划教材《无机化学》试题范围:全册出版社:化学工业出版社版次:第四版学校名称:平凉信息工程学校(需要的相对原子质量为:Al:27,H:1,Cl:35.5,Ca:40,N:14,O:16)一、填空题(每空1分,共20分)1. 0.5 mol铝的质量为g,能与mol盐酸完全反应,产生mol氢气。
2.煅烧石灰石的化学方程式为。
3.碱土金属原子最外层有个电子,次外层有个电子(Be除外)。
4、MgO和CaO分子中都含有键,他们是化合物。
5.原电池是把能转化为电能的装置,负极发生反应。
6.化学反应2SO2 + O2 = 2SO3的平衡常数表达式为。
7.水溶液中[H+] >[OH-]时,溶液呈性;pH值7。
8.K2Cr2O7中Cr的氧化值为。
9、减少硬水中Ca2+、Mg2+的含量的过程叫水的,软化永久硬水的方法主要有和。
10.4020Ca中,质子数为,中子数为,电子数为。
二、单项选择题(每题2分,共20分)1.关于摩尔的理解,正确的是()。
A.摩尔是表示物质的质量的单位B.摩尔是表示物质的量的单位C.摩尔是表示物质的重量的单位D.摩尔是表示物质的体积的单位2.热化学方程式要注明物质的()。
A.聚集状态B.质量C.分子数D.体积3.原子的质量数A,原子序数Z,原子内中子数N之间的关系为()。
A.A = Z+ N B.Z = A+ N C.N = A+ Z D A+ Z+ N=04.原子序数为22的Ti4+离子,质量数是48,它的核内质子数、中子数及核外电子数分别为()。
A.48,22,18 B.22,24,18C.22,26,18 D.18,26,225、下列物质属于两性氧化物的是()A、CO2B、Na2O2C、Al2O3D、CaO6.下列元素中金属性最强的是()A.Be B.B C.Al D.Si7.下列物质属强电解质的有()。
A.HF B.HAc水溶液C.氨水D.HCl8.氧化还原反应NH3 + O2→NO + H2O配平后,各物质的系数正确的是()。
第1页/共6页 第2页/共6页班级: 学号: 姓名:线 装订本卷可能用到的原子量:O :16;Na: 23; Cl: 35.5 一、选择题(每题2分共60分)1、1mol 二氧化碳里含有二氧化碳的分子数为( )A 、3.01×1023个B 、6.02×1023个C 、6个D 、44个 2、1mol O 2的质量为( )A 、32B 、32gC 、16D 、16g 3、氯化钠的摩尔质量为( )A 、23B 、35.5C 、58.5g/molD 、46g/mol 4、标准状况下的1mol H 2的体积为( ) A 、11.2LB 、22.4LC 、33.6LD 、44.8L5、实验室中需要配制2mol/L 的NaCl 溶液950mL ,配制时应选用的容量瓶的规格和称取的NaCl 质量分别是( ) A 、950mL ,111.2g B 、500mL ,117g C 、1000mL ,117g D 、任意规格,111.2g6、实验向容量瓶转移液体操作中用玻璃棒,其用玻璃棒的作用是( )A 、搅拌B 、引流C 、加速反应D 、加快热量散失 7、下列溶液中,溶质的物质的量浓度为0.1mol/L 的是( ) A 、1L 溶液中含有4g NaOH B 、1L 水中溶解4gNaOHC 、0.5L 溶液中含有0.2mol H 2SO 4D 、9.8g H 2SO 4溶于1L 水配成溶液8、钠与水反应时产生的各种现象如下:①钠浮在水面上;②钠沉在水底;③钠熔化成小球;④小球迅速游动逐渐减小,最后消失;⑤发出嘶嘶的声音;⑥滴入酚酞后溶液显红色。
其中正确的一组是( ) A 、①②③⑥ B 、①②③④⑤ C 、①③④⑤⑥ D 、全部9、当钠、钾等金属不慎着火时,可以用来灭火的是( )A 、水B 、煤油C 、沙子D 、泡沫灭火剂 10、在实验室中,通常将金属钠保存在( )A 、水中B 、煤油中C 、四氯化碳中D 、汽油中 11、除去Na 2CO 3 固体中少量NaHCO 3的最佳方法是( )A 、加入适量盐酸B 、加入NaOH 溶液C 、加热D 、配成溶液后通入CO 2 12、下列哪种物质俗名与化学式是相对应的( )A 、NaOH 纯碱B 、Na 2CO 3 纯碱C 、NaHCO 3 纯碱D 、NaHCO 3 大苏打 13、下列各组物质中互为同素异形体的是( )A 、石墨、金刚石B 、河水、海水C 、纯碱、烧碱D 、干冰、二氧化碳 14、椐报道,科学家发现了一种新元素,它的原子核内有161个中子,质量数为272,该元素的质子数为( )A 、111B 、161C 、272D 、433 15、下列化合物中,属于强电解质的是( )。

第一章酸碱理论与非水溶液化学>>学习单元1 酸碱概念1、NH4+的共轭碱是(B)。
(A) OH-(B) NH3(C)NH2-(D) NH2-提示:由质子理论定义: NH4+(酸) H++NH3(碱),故选B。
2、在反应BF3 + NH3 F3BNH3中,BF3为(D)。
(A) Arrhenius碱(B) Br nsted酸(C) Lewis碱(D) Lewis酸提示:B具有缺电子性,可以接受孤对电子,故为Lewis酸。
3、根据酸碱的溶剂理论,在液态 SO2体系中的碱是( B )。
(A) SOCl2(B) Na2SO3(C) Na2SO4(D) PCl3 提示:2SO2 SO2+ SO32-,能生成溶剂阴离子的是Na2SO3,故选B。
为什么Fe3+与F-形成的配合物的稳定性大于Fe3+与Cl-形成的配合物的稳定性?酸碱定义:电负性较小的路易斯碱称为软碱;与软碱形成稳定配合物的路易斯酸为软酸。
电负性较大的路易斯碱称为硬碱硬”对应的是小的、高氧化态的粒子,这些粒子都很难被极化。
相反,“软”是指大的,低氧化态的粒子,很容易被极化。
软-软和硬-硬之间的酸碱反应最为稳定。
这个理论在有机化学和无;与硬碱形成稳定配合物的路易斯酸为硬酸。
硬”对应的是小的、高氧化态的粒子,这些粒子硬”对应的是小的、高氧化态的粒子,这些粒子都很难被极化。
相反,“软”是指大的,低氧化态的粒子,很容易被极化。
软-软和硬-硬之间的酸碱反应最为稳定。
这个理论在有机化学和无都很难被极化。
相反,“软”是指大的,低氧化态的粒子,很容易被极化。
软-软和硬-硬之间的酸碱反应最为稳定。
这个理论在有机化学和无机化学均有应用。
酸碱反应实质:硬酸倾向于与硬碱反应(硬亲硬),软酸倾向于软碱反应(软亲软)。
Fe3++6F–=[FeF6]3-(硬-硬)Hg2++4I-=[HgI4]2-(软-软)Fe4++4:Cl–=[FeCl4]–(硬-软),故[FeCl4]–不稳定第一章酸碱理论与非水溶液化学>>学习单元2 酸碱强度一、填空题1、判断相对Lewis碱性(1)(H3Si)2O和(H3C)2O;(2)(H3Si)3N和(H3C)3N ;其中较强的是(1)__(H3C)2O __,(2)__(H3C)3N___。

8:[单选题]下列元素第一电离能最大的是()。
A:BB:CC:ND:O参考答案:C9:[单选题]下列离子中,离子半径最小的是()。
A:Cl-B:Ca2+C:Sc3+D:Ti4+参考答案:D 10:[单选题]性质最相似的两个元素是()。
A:Zr 和HfB:Ru 和RhC:Mn 和MgD:Cu 和Cr 参考答案:A11:[多选题]下列性质相似的元素是()。
A:Al和BeB:B和AlC:B和SiD:Al和Ca参考答案:AC12:[单选题]估计Ru3(CO)12中共有()个M―M键A:1B:2C:3D:4参考答案:C1:[判断题]判断方程式B2H6 + 2N(CH3)3=2BH3N(CH3)3是否正确。
参考答案:正确2:[判断题]判断方程式SOCl2 +Cs2SO3=2CsCl+2SO2是否正确。
参考答案:正确3:[判断题]判断方程式SbF5 + KF= KSbF6 是否正确。
参考答案:正确4:[判断题]判断方程式Cr(CO)6 + C6H6=Cr(C6H6)(CO)3 + 3CO是否正确。
参考答案:正确5:[判断题] 判断方程式Mn2(CO)10 + Br2=2Mn(CO)5Br是否正确。
参考答案:正确6:[判断题]. 判断方程式Fe(CO)5 + 3KOH=K[Fe(CO)4H] + K2CO3 + H2O 是否正确。
参考答案:正确7:[判断题]判断方程式CrCl3 + 3Na + 6CO=3NaCl + Cr(CO)6是否正确。
参考答案:正确8:[判断题]判断方程式2CoCO3 + 8CO + 2H2=Co2(CO)8 + 2CO2 + 2H2O是否正确。
参考答案:正确9:[判断题]判断方程式Fe + 5CO=Fe(CO)5是否正确。
参考答案:正确10:[判断题]判断方程式BF3NMe3 + BCl3 = Cl3BNMe3 + BF3是否正确。
参考答案:正确11:[判断题].判断方程式F4SiNMe3 + BF3 = F3BNMe3 + SiF4 是否正确。

中级无机化学复习题08中级无机化学复习题一、选择题1、[Pt(NH3)2(OH)2Cl2]可能存在的几何异构体为() A)6 B)3 C)4 D)52、根据酸碱质子理论,下列物质可作为碱的有() A) H2SO4B)[Co(H2O)5(OH)]2+ C) [Fe(H2O)6]3+ D) H3O+ 3、下列物质属于软酸的是() A) Fe3+ B)Ag+ C)NH3 D)F-4、关于酸碱理论的描述,错误的是() A)阿仑尼乌斯提出酸碱电离理论 B)乌萨诺维奇提出酸碱质子理论 C)路易斯提出酸碱电子理论 D)皮尔逊提出软硬酸碱理论5、下列物质中不属于质子溶剂的是() A) NH3 B) HAc C ) SO2 D)NaCl6、下列配合物属于配位异构的是() A)[CoBr(NH3)5]SO4 和[CoSO4(NH3)5]BrB)[Cr(H2O)6]Cl3 和 [Cr(H2O)5Cl]Cl2・H2O C)[CoNO2(NH3)5]Cl2和[CoONO(NH3)5]Cl2 D)[Co(NH3)6][Cr(CN)6] 和 [Cr(NH3)6][Co(CN)6]7、根据软硬酸碱理论,下列卤化物中热稳定性最好的是() A) PH4FB)PH4Cl C) PH4Br D)PH4I8、在埃灵罕姆(Ellingham)图中,位于上方的金属氧化物的标准生成自由能比下方的金属氧化物的标准生成自由能()A)一定大 B)一定小 C)相等 D)有可能大,也有可能小9、根据鲍林对含氧质子酸强度的经验规则,HClO4属于很强的酸,这是因为该酸中m值为() A)0 B)1 C) 2 D) 3 10、下列氢酸酸性最强的是() A) H2Te B)H2Se C)H2S D) H2O11、下列氢化物相对于质子来说,最强的碱是()A) NH2- B)PH2- C)AsH2- D)NH312、下列不易生成多Pπ―Pπ重键的元素是() A)硅 B)碳 C)氧D)氮 13、在反应B F3 + NH3→ F3BNH3 中,BF3 为()(A) Arrhenius 碱(B) Brφnsted 酸 (C) Lewis 碱 (D) Lewis 酸 14、H2PO?4 的共轭酸是()(A) H??3PO4 (B) HPO4 2 (C)H?2PO3 (D) PO4 315、Fe3+具有d 5 电子构型,在八面体场中要使配合物为高自旋态,则分裂能△和电子成对能P 所要满足的条件是()(A) △和P 越大越好(B) △> P (C) (C)△< P (D) △= P 16、[Co(NH3)4(H2O)2]3+具有几何异构体的数目是() (A) 1 (B) 2 (C) 3 (D) 417、下列具有不同d x 电子构型的离子,在八面体弱场中具有最大的晶体场稳定能的是() (A) d 1 (B) d 2 (C) d 3 (D) d 418、由英国化学家N・Bartlett 发现的第一个稀有气体化合物是() (A) XeF2(B) XeF4 (C) XeF6 (D) XePtF6 19、下列碳酸盐中最难分解为氧化物的是()(A) CaCO3 (B) BaCO3 (C) MgCO3 (D) SrCO3 20、在[Ru(NH3)4Br2]+中,Ru 的氧化数和配位数分别是() (A) +2 和4 (B) +2 和6 (C) +3 和6 (D) +3 和422. 相同浓度的下列几种酸的水溶液中,酸性最弱的是() (A) HCl (B) HBr(C) HI (D) HF23. 0.01mol 氯化铬(CrCl3・6H2O)在水溶液中用过量AgNO3 处理,产生0.02molAgCl 沉淀,此氯化铬最可能为… ()(A) [Cr(H2O)6]Cl3 (B) [Cr(H2O)5Cl]Cl2・H2O(C) [Cr(H2O)4Cl2]Cl・2H2O (D) [Cr(H2O)3Cl3]・3H2O24.按晶体场理论,在八面体场中因场强不同有可能产生高自旋和低自旋的电子构型是() (A) d 1(B) d 3(C) d 5(D) d 825. 下列金属中,热力学金属活泼性最大的是() (A) Ca (B)Na(C)Mg (D) Li26.按酸碱质子理论考虑,在水溶液中既可作酸亦可作碱的物质是() (A) Cl?(B)NH4 + (C) HCO3- (D) H3O+ 27、根据Pauling 近似规则,HClO4的pKa大约为()(A)-2 (B)-4 (C)-6 (D) -828、下列物质中酸性最强的是()(A)H2Te (B) H2Se (C) H2S (D) H2O 29、NH3分子所属点群是()(A)C3 (B)C3v (C)D3 (D)D3h 30、对于CoF63-配离子,下列叙述正确的是()(A)CoF63-的晶体场分裂能大(B) F-为强场配体(C)CoF63-是顺磁性的(D)所有论述都不对 31、下列化合物中,服从18电子规则的是()(A)Fe(CO)5 (B)Mn(CO)5 (C)W(CH3)6 (D) Cr(C5H5)(C6H6) 32、二茂铁离子(η5-C5H5)2Fe+是( )(A) 强氧化剂(B)强还原剂(C)弱氧化剂(D)弱还原剂 33、运用Wade规则判断下列物种中属闭式构型的是()(A)B9C2H11 (B)B5H9 (C) B5H11 (D) B6H10 34、运用Wade规则判断下列物种中属巢式构型的是()(A)B9C2H11 (B)B5H9 (C) B5H11 (D) B6H10 35、下列离子半径最大的是()(A)Al3+ (B)Fe3+ (C) Y3+ (D) Co3+36、下列原中原子半径最小的是()(A)Rb (B)Sr (C)In (D)Te37、贵金属包括()(A)Pt、Pd、Rh (B)Os、Ir、Ru (C)Au、 Ag (D)上述全部 38、FeO42-在酸性溶液中()(A) 很稳定(B)很不稳定(C)比在碱性溶液中稳定(D)比在中性溶液中稳定39、镧系元素离子的颜色一般比过渡金属离子的颜色浅,是因为f-f电子跃迁能级较d-d电子跃迁能级()(A)高(B)低(C)差不多(D)与此无关40、下列离子的草酸盐在水中溶解度最小的是()(A)Ti2(C2O4)3 (B)Fe2(C2O4)3 (C)Ce2(C2O4)3 (D)Al2(C2O4)3二、填空题1、根据路易斯理论,----叫做碱;凡能――――――叫做酸。
第九章中级无机化学课后习题答案162 第9章习题1 计算下列化合物的价电子数,指出哪些符合FAN 规则。
解:(1) V(CO)6 V :5,6CO :12;共17。
不符合(2) W(CO)6 W :6,6CO :12;共18。
符合(3) Ru(CO)4H Ru +:7,4CO :8,H -:2;共17。
不符合(4) Ir(CO)(PPh 3)2Cl Ir +:8,CO :2,2PPh 3:4,Cl -:2;共16。
符合(5) Ni(η5-C 5H 5)(NO) Ni +:9,C 5H 5-:6,NO :3;共18。
符合(6) PtCl 3(η2-C 2H 4)- Pt 2+:8,3Cl -:6,C 2H 4:2;共16。
符合2 下列原子簇化合物中哪些具有M =M 双键?为什么?解:(1) Fe 3(CO)12 3×8 (Fe)+12×2 (CO)=48 (3×18-48)/2=3,三条键连接三个Fe ,三个Fe 按三角形排布,,故应该无M =M 键;(2) H +2[Os 3(CO)10]2-3×8 (Os)+10×2 (CO)+2(负电荷)=46 (3×18-46)/2=4,四条键连接三个Os ,三个Os 按三角形排布,,故应该有一条M =M 键;(3) H +4 [Re 4(CO)12]4-4×7 (Re)+12×2 (CO)+4(负电荷)=56 (4×18-56)/2=8,八条键连接四个Re ,四个Re 按四面体排布,,故应该有两条M =M 键;(4) [Re 4(CO)16]2-4×7 (Re)+16×2 (CO)+2(负电荷)=62 (4×18-62)/2=5五条键连接四个Re ,四个Re 按蝶形排布,,故应该无M =M 键。
3 [HFe 4(CO)13]-和H 3Os 4(CO)12I 具有怎样的结构?画图说明之。
中级无机化学习题第二章 对称性与群论基础1、利用Td 点群特征标表(右表)回答下列问题 (1)、群阶,对称操作类数,不可约表示数(2)、SO 42-离子中S 原子3p x 轨道及3d xy 轨道所属的不可约表示 (3)、可约表示Г(10,-2,2,0,0)中包括了哪些不可约表示?SO 42-离子是否表现为红外活性?SO 42-离子是否表现为拉曼活性的?解:(1)点群的阶h=8;对称操作类=5;不可约表示数=5(2)S 原子的P X 轨道所属不可约表示为T 2表示。
(3)()01231)2(811018111=⨯⨯+⨯-⨯+⨯⨯=⋅Γ⋅=∑iA g h a χ;同理 02=A a ;11=T a ;12=T a ;2=E a ;故可约表示E T T 221)0,0,2,2,10(⊕⊕=Γ-因T 2表示中包含(x,y,z )和 (xy,xz,yz),故既表现为红外活性又表现为拉曼活性。
2(1)、点群的阶,对称操作类数,不可约表示数(2)、NH 3分子中偶极矩所属的不可约表示(3)可约表示Г(6,0,2)中包括了哪些不可约表示? 解:(1)点群的阶h=6; 对称操作类=3;不可约表示数=3 (2)NH 3分子中偶极矩所属不可约表示为A 1表示 (3)()21231021616111=⨯⨯+⨯⨯+⨯⨯=⋅Γ⋅=∑iA g h a χ;同理 02=A a , 2=E a ; 故可约表示E A 221)2,0,6(⊕=Γ3.利用C 4v 点群特征标表(见下表)回答下列问题(1)、点群的阶,对称操作类数,不可约表示数 (2)、SF 5Cl 分子中S 原子Px 轨道所属的不可约表示 (3)、可约表示Г(4,0,0,-2,0)中包括了哪些不可约表示?4、 试用特征标表的分析MnO 4-的杂化方式。
(要求有分析的详细过程)。
第三章 配位化学基础1、配位体与中心金属离子的π 成键作用将影响配合物的分裂能,假定配位体的π 轨道能量低于中心金属离子的π 轨道,且已被电子所填满。
[0049]《中级无机化学》第一批次[单选题]H2PO4-的共轭碱为()。
A:HPO42-B:H3PO4C:PO43-参考答案:A[单选题]LiF、LiCl、LiBr、LiI在水中溶解度最小的为()A:LiFB:LiClC:LiBrD:LiI参考答案:A[单选题]按酸碱质子理论,下列分子或离子中为碱的是( )A:BF3B:HClC:HNO3D:Ac-参考答案:D[单选题]以HF为溶剂,醋酸为()。
A:酸B:碱C:盐参考答案:B[单选题]HOCl、HOBr、HOI的酸性最强的为()。
A:HOClB:HOBrC:HOI参考答案:A[多选题]实验室配制SnCl2溶液时,必须在少量盐酸中配制(而后稀释至所需浓度),才能得到澄清溶液,这是由于()A:形成缓冲溶液B:盐效应促使SnCl2溶解C:同离子效应D:阻止SnCl2水解参考答案:CD[论述题]1. 解释CF3COOH的酸性比CH3COOH的酸性强.2.判断Fe3+与X-形成配合物时稳定性最大的是[FeF]2+还是[FeBr]2+,为什么?参考答案:1. 是因为F是电负性最高的元素,F原子的极强的吸电子能力以及羰基的诱导作用,使CF3COOH分子中羰基O原子的正电性增强,从而对H原子的吸引减弱而使其易于解离。
当H 原子解离后,生成的阴离子CF3COO?中形成离域∏34,大大增加了该阴离子的稳定性。
因此CF3COOH具有很强的酸性。
2.是[FeF]2+。
因为Fe3+电荷高、半径小为硬酸,F-的半径小于Br-的半径,所以F-的硬度大于Br-的硬度,Fe3+易与F-结合形成稳定的配合物,故稳定性最大的是[FeF]2+。
[单选题]HCO3-的共轭酸为()。
A:CO32-B:H2CO3C:没有共轭碱参考答案:B[单选题]在水中TlBr的溶解度比TlBr3的溶解度()。
A:大B:小C:相等参考答案:B[单选题]硼酸H3BO3是一种()。
A:一元中强酸B:一元弱酸C:三元弱酸D:三元中强酸参考答案:B第二批次[单选题][Pt(NH3)2Cl2]有( ) 种几何异构体。