手性药物的拆分高效液相色谱HPLC
- 格式:ppt
- 大小:6.87 MB
- 文档页数:43

第一讲手性分离色谱手性药物常用的色谱分离方法有:高效液相色谱、气相色谱、毛细管电泳、超临界流体色谱。
手性药物给人类曾经带来过空前的灾难——反应停事件。
概念手性:指一种化合物分子由于其三维空间结构的原因所显示出的相互不能重合,但互为镜像关系,它形象的比喻为人的左右手,这叫手性。
对映体: 由于手性中心连接的四个基团在空间三维排列的不同,对偏振光产生的旋转方向不同,从而产生不能重叠的互为镜像的光学异构体,称对映体。
旋光性:手性药物对映体之间对偏振光的偏转程度相同,但偏转方向相反,即旋光性。
右旋体:能使偏振光按顺时针方向旋转的对映体称为右旋体以d-或(+)-表示。
左旋体:按逆时针方向旋转者称为左旋体以l-或(-)-表示。
外消旋体:等量的左旋体和右旋体构成外消旋体,没有旋光性,以(dl)或(±)表示。
内消旋体:分子中含有手性碳原子,但作为分子整体来说是非手性的。
内消旋化合物是纯净物。
外消旋体与内消旋体的共同之处是:二者均无旋光性。
外消旋体:是混合物,可拆分出一对对映体。
内消旋体:是化合物,不能拆分。
手性药物:是指由具有药理活性的手性化合物组成的药物。
手性药物的表示方法1.dl-或(±)-表示能使偏振光的偏振面按顺时针方向旋转的对映体称为右旋体(dextrotatory),在药名前用d-或(+)-表示;反之,称为左旋体(levorotatory),在药名前加l-或(-)-表示。
外消旋体(racemate)则是由等量的左旋体和右旋体构成,没有旋光性,在其药名前用dl-或(±)-表示。
2. D/L标记法(相对构型)1951年前,人们还无法确定化合物的绝对构型。
费歇尔(Fischer)人为地选定(D)-甘油醛为标准物,以标准参照物来确定药物的立体化学构型,相对构型。
由于D/L构型表示法它只适用与甘油醛结构类似的化合物,对多个手性碳的化合物使用不方便。
与表示旋光方向的d和l容易混淆,目前多限于糖和氨基酸的立体化学命名。

手性药物的分离在色谱法中的应用
手性药物是指具有手性结构的药物分子,即能够存在两种非重叠的立体异构体,分别为左旋体和右旋体。
左旋体和右旋体的生物学活性、药理学效应以及代谢动力学等方面可能存在显著差异。
对手性药物的分离具有重要的意义。
色谱法是一种常用的分离手性药物的方法,可通过多种不同的基质和条件实现手性药物的分离。
色谱法是通过样品在固定或移动相上的分配和传递行为实现分离的方法。
常见的色谱法包括高效液相色谱法(HPLC)、气相色谱法(GC)和超高效液相色谱法(UPLC)等。
高效液相色谱法(HPLC)是一种广泛应用于药物分析的方法。
在手性药物的分离中,HPLC常用的手性担子包括α-酮基-β-环糊精、β-环糊精、碘化环糊精等。
这些手性担子能够与手性药物形成包合物,从而实现手性药物的选择性分离。
还可以通过改变流动相的组成、pH值和温度等条件来调节手性药物与手性担子之间的相互作用,进一步优化分离效果。
HPLC分离后的手性药物可以通过光学旋光仪进行旋光度测定,以确定药物的手性纯度和相对含量。


手性药物的分离在色谱法中的应用手性药物是指具有手性结构的药物。
它们可以分为左旋和右旋两种类型,两者化学性质相同,但左右旋异构体对生物系统的影响却截然不同,这种现象被称为手性诱导失活效应。
因此,在制药过程中需要对手性药物进行分离,以确保药效和安全性。
色谱法是分离手性化合物的主要方法之一,其基本原理是利用不同化合物的物理、化学性质差异,通过分离柱将混合物中的目标物分离出来。
以下是一些色谱法在手性药物分离中的应用。
手性高效液相色谱法(HPLC)手性HPLC是目前最常用于手性药物分离的方法之一,它是利用手性固定相在悬浊液中对手性化合物进行分离。
具有手性结构的固定相与目标分子相互作用,从而实现分离。
手性HPLC可以分别采用手性固定相或手性混合物来进行分离。
此外,在手性HPLC中,主要可以采用簇列技术或化学反应转化手性方法来提高分离效率和选择性。
毛细管电泳(CE)毛细管电泳是一种基于电化学原理的分离技术,它利用电场将样品中的分子分离。
在毛细管电泳中,可以采用手性高分辨涂层来进行手性药物的分离。
在此基础上,还可以采用手性化合物作为毛细管填充剂,进一步提高分离效率和分离度。
气相色谱法(GC)气相色谱法是一种利用气体作为流动相的色谱法。
在处理手性药物时,通常需要使用手性柱和手性混合物。
与HPLC不同,该方法的分离依赖于分子间的“挤压”力。
因此,手性柱具有不同的式样,以保证灵敏度和选择性。
超临界流体色谱法(SFC)SFC是一种介于HPLC和GC之间的色谱法。
它使用超临界流体作为移动相,可以在温度和压力条件下实现高效率的手性药物分离。
通常使用手性柱和手性对映异构体混合物进行分离。
此外,还可以应用具有特定分子功能的催化剂来提高分离效率。
总之,手性药物分离是一项非常复杂的任务,需要使用不同的色谱技术和方法来实现。
无论是HPLC、CE、GC还是SFC,它们都有各自的优缺点和适用范围,因此在选择分离方法时需要综合考虑样品特性,实验设备和分离效率与成本等因素。



手性药物拆分技术及分析在药物研究和开发中,手性药物是一个非常重要的领域。
手性药物指的是分子结构中含有手性中心(手性碳原子)的化合物,左旋和右旋两种异构体具有不同的生物活性和体内代谢途径。
因此,正确地分析和分离手性药物对于药物研究和有效性的评估至关重要。
手性药物分析技术主要包括色谱法、光学活性法和核磁共振(NMR)法。
色谱法是一种常用的手性药物分析方法。
它基于手性药物的两种对映异构体在手性固定相上的不同吸附能力进行分离。
常见的色谱法包括高效液相色谱法(HPLC)和毛细管电泳法。
HPLC通常使用手性固定相柱,通过选择性地吸附左旋或右旋手性分子,实现对手性药物的分离。
毛细管电泳是一种高效的手性药物分析方法,基于对映异构体在电场中的迁移速率不同,通过毛细管中背景电解质的浓度和pH值调节来分离手性药物。
光学活性法是一种基于光学活性性质来分析和测定手性药物的方法。
光学活性手性药物由于具有旋光性,可以引起光的偏振方向发生旋转。
常用的光学活性法包括旋光仪法和圆二色光谱法。
旋光仪法是通过测定手性分子对光的旋转角度来判断手性药物的对映异构体的含量和比例。
圆二色光谱法则是测量手性分子对不同波长光的吸收性质,通过对波长的差异来判断手性药物的对映异构体。
核磁共振(NMR)是一种基于核磁共振现象来分析手性药物的方法。
NMR技术通过检测手性碳原子或核自旋的信号来确定手性药物的结构和对映异构体的比例。
通过对样品进行核磁共振实验后,通过解释谱图的峰位和峰形等信息,可以得到手性药物的分析结果。
此外,还有一些其他的手性药物分析方法,如质谱法、X射线衍射法和环光谱法等。
这些方法在手性药物分析中各有优劣,适用于不同类别和性质的手性药物。
总之,手性药物分析技术对于药物研究和评估的重要性不可忽视。
科学家们通过不断研究和发展新的手性分析技术,为新药开发和治疗提供了更可靠和准确的手性药物分析方法。

高效液相色谱法在手性药物拆分中的应用(word版可编辑修改)编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(高效液相色谱法在手性药物拆分中的应用(word版可编辑修改))的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为高效液相色谱法在手性药物拆分中的应用(word版可编辑修改)的全部内容。
高效液相色谱法在手性药物拆分中的应用摘要:外消旋化合物的手性分离是获得单一对映体的方法之一.随着人们对纯光学药物的需求日益增加,各种手性分离技术得以快速发展。
近几十年来,在这些手性分离技术中,高效液相色谱法( HPLC )被公认为是一种强大、快速、高效的分离技术,它已成功应用于对映体药物的分离分析和制备中。
HPLC用于对手性药物分离的研究已取得很大进展,并且研发了大量可应用于手性小分子和聚合物分离的手性固定相,大大提高HPLC的手性识别能力。
本文以HPLC的手性药物分离为焦点,介绍了近几年高效液相色谱法手性固定相的新发展和应用。
关键词:高效液相色谱法手性药物手性拆分Application of High Performance Liquid Chromatography in Chiral Separation of PharmaceuticalsAbstract:Resolution of racemic compounds is one of the potential ways of obtaining both enantiomers。
The increasing demand for enantiopure drugs has led to the development of a variety of stereoselective separation technologies。

如何应用高效液相色谱法进行手性药物对映异构体拆分对于市场上越来越多对目标物准确定性的要求,而手性产物是其中较为重要的一部分,因此对于手性目标物的检测就显得尤为重要。
一、什么是手性导构和对映异构体?当药物分子中碳原子上连接有4个不相同的基团时,该碳原子被称为不对称碳或手性碳(中心),会导致药物分子存在异构体,如果两个异构体之间的关系如同一个物体的立体结构在照镜子,这个立体结构和它在镜子中的像互为对映异构体(对映体)。
图1是手性对映异构体的图示。
图1 手性对映异构体图示对映体具有相同的物理性质(如熔点,沸点,溶解度,折射率,酸性,密度等),热力学性质(如自由能,焓、熵等)和化学性质。
除非在手性环境(如手性试剂,手性溶剂)中才表现出差异。
对映体对偏振光的作用不同,它们的比旋光度数值相同,但方向相反。
对映体的生物活性不相同,化学反应中表现出等速率。
等量的左旋体与右旋体的混合物构成外消旋体。
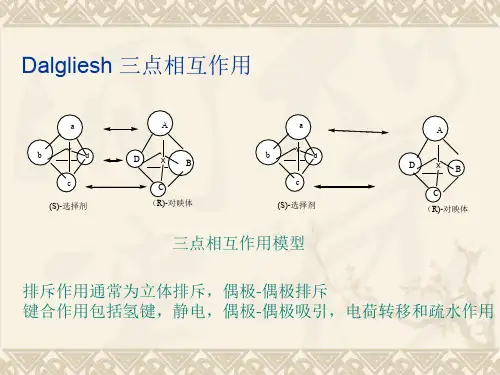
从对映体中分离出单纯一个光学异构体的方法称手性拆分。
最普通的手性拆分方法是消旋旋体与光学活性相反的离子(称拆分剂)作用生成非对映体。
手性药物对映体拆分的方法主要有非色谱法和色谱法。
非色谱法(主要包括结晶法、微生物消化法等)耗时长,过程繁琐不能制备高纯度对映体,色谱法是基于把对映体的混合物转换成非对映异构体,然后利用它们在化学或物理性质上的差异进行分离。
主要包括气相色谱(GC)、超临界流体色谱(SFC)、毛细管电泳(CE)和毛细管电色谱(CEC)等。
表1罗列了色谱手性拆分的发展史。
其中高效液相色谱(HPLC)因其独特的优势成为手性分析领域最常用的一种技术。
表1 色谱手性拆分发展史二、HPLC手性拆分方法手性药物拆分法通常分为直接法和间接法两大类。
间接法和直接法的共同特点是均以现代技术为基础并引人不对称中心或光活性分子;不同的是间接法是将其引入分子溶质内,而直接法则是引人分子间。
引人手性环境使对映异构体间呈现物理特征的差异是手性进行光学异构体拆分的基础。

手性药物拆分技术及分析手性药物(chiral drugs)是指分子内部有一个或多个不对称碳原子的药物,即具有手性结构的药物。
手性药物由于具有左右旋异构体,使得其药理学效应、药效学性质、药代动力学以及安全性能等方面出现差异。
因此,手性药物的拆分技术及分析对于药物的研发、生产和应用具有重要意义。
手性药物的拆分技术主要有下述几种方法:晶体化学方法、酶法、化学拆分、色谱法和光学活性检测。
首先是晶体化学方法,该方法是利用手性药物晶体的对称性差异完成拆分。
通过晶体中的尖、刃、拱等特征差异,将手性药物分离为晶体异构体。
其次是酶法,手性药物的拆分可以通过酶的催化作用实现。
酶是具有高选择性、高催化效率和高效底物转化率的催化剂。
通过选择合适的酶,可以将手性药物转化为对应的手性异构体或原生态精细化靶化合物。
化学拆分是指通过特定的化学反应将手性药物分解为不对称碳原子具有相反手性的产物。
该方法较为常用,但对于存储稳定性较差的手性药物较不适宜。
色谱法是利用不同手性列进行手性分离,如手性HPLC(高效液相色谱)和手性毛细管电泳等。
这些方法主要是利用手性固定相对手性药物进行分离,可达到手性药物的拆分效果。
光学活性检测是通过光学活性的手性试剂或手性染料,以手性化合物的吸光性能差异检测手性药物的拆分效果。
根据手性分析原理,通过手性分析仪器对手性药物进行检测和分析。
手性药物的分析对于药物研发、生产和应用非常重要。
分析手性药物的关键是确保其纯度和药效学性质,并且有助于合理掌握手性药物在体内的吸收、分布、代谢和排泄的信息。
以下是手性药物分析的一些常用方法。
首先是纳米液相色谱法,该方法是将分离的手性药物样品通过微量泵输送到纳米柱中,在极小的流速和流体容量下进行分离。
该方法对于手性药物样品的需求量很小,因此可以减少手性药物样品的消耗。
其次是循环偏振负压电流法,该方法通过测量手性药物样品对光的旋光性质,直接反应其手性结构。
该方法准确、快速,适用于灵敏度高的手性药物分析。
药物研究中手性分离分析方法及技巧药物研究中手性分离分析是指将手性药物中的手性异构体(也称为对映体)分离出来,并进行定量分析。
由于手性异构体具有不对称的结构,其物理化学性质和药理活性可能差异巨大,因此手性分离分析对于药物研究具有重要意义。
以下将介绍几种常用的手性分离分析方法及技巧。
1.气相色谱法(GC法):GC法是通过在手性固定相柱上进行气相色谱分析,分离手性异构体。
该方法基于手性碳氢化合物在手性固定相上的不同吸附能力来实现手性分离。
同时,通过合适的手性底物和手性固定相的选择,还可以更好地提高手性分离的选择性和灵敏度。
2.液相色谱法(HPLC法):HPLC法是手性分离分析中最常用的方法之一、常见的手性固定相有手性液相、手性离子对和手性硅胶等。
通过在手性固定相上进行液相色谱分析,利用手性化合物在固定相上的差异相互作用,实现手性分离。
此外,还可以结合负载式手性液相色谱法、手性离子对液相色谱法等技术,提高手性分离效果。
3.毛细管电泳法(CE法):CE法是一种高效、快速的分离技术,特别适用于分析手性药物。
通过在毛细管中施加电场,利用手性化合物在毛细管中的迁移速率差异实现分离。
此外,还可以通过改变运行缓冲液的组成、pH值等条件,调节手性分离的选择性和分离效果。
除了上述主要的手性分离分析方法外,还存在一些辅助技巧和方法,可以进一步提高手性分离的效果:1.共处理:将两个手性化合物混合在一起进行共处理,通过比较混合物中手性峰的相对峰度等信息,来判断手性分离的效果。
2.离子对调整:通过调整分析液中离子对的浓度和种类,来改变手性分离的效果。
一般来说,手性离子对可以提高手性分离的分辨率和选择性。
3.pH调控:通过改变液相色谱系统中溶液的pH值,可以影响毛细管电泳法和液相色谱法中手性分离效果。
pH值的改变可以调节化合物分子的电荷状态,从而影响手性分离的选择性。
总之,手性分离分析方法及技巧在药物研究中起着重要的作用。
通过合理选择合适的手性分离方法,并结合辅助技巧和方法,可以实现对手性异构体的高效、准确的分离和定量分析,从而为药物研究提供有价值的数据。
色谱技术在手性药物拆分中的应用分析【摘要】手性药物是一类具有对映体异构体的药物,其拆分对于保证药物的疗效和安全性至关重要。
色谱技术在手性药物拆分中发挥着关键作用,包括气相色谱、高效液相色谱和超临界流体色谱等。
这些色谱技术在手性药物拆分中具有显著优势,如高分辨率、高灵敏度和高选择性。
通过色谱技术,可以有效分离和鉴定手性药物的对映体,为药物研发和质量控制提供了重要支持。
未来,随着色谱技术的不断发展和完善,将为手性药物拆分提供更多的可能性和选择,推动手性药物研究领域的深入发展。
色谱技术在手性药物拆分中具有广阔的应用前景和发展空间,对提高药物质量和疗效具有重要意义。
【关键词】手性药物、拆分、色谱技术、手性药物分析、手性药物拆分方法、手性药物的特点、手性药物拆分的重要性、色谱技术优势、手性药物拆分未来发展1. 引言1.1 研究背景手性药物是指具有手性结构的药物,即它们的分子具有对映异构体。
对映异构体在化学结构上是镜像对称的,但在生物学活性上却可能截然相反。
手性药物的对映异构体可能呈现出截然不同的药理活性和药代动力学特性,造成对人体产生完全不同的影响。
手性药物的拆分和分离对于药物研究和临床应用至关重要。
正确拆分和分离药物的对映异构体,能够确保药物的疗效和安全性。
在药物研究和开发中,手性药物的拆分成为一个重要的技术难题。
1.2 研究意义色谱技术可以通过不同的分离机理,如手性站点选择性吸附、配体选择性吸附等,对手性药物进行有效拆分。
这种技术可以精准地分离出不同立体异构体,有助于进一步研究其药效和毒性,为临床用药提供重要参考。
研究手性药物的拆分也有助于推动新药研发领域的发展。
通过探索不同手性药物的拆分方法和机理,可以有效提高药物的纯度和活性,减少不良反应和代谢紊乱的风险。
深入研究色谱技术在手性药物拆分中的应用意义重大,将为药物分析和药物设计领域带来重要的科学进展和临床应用方面的贡献。
2. 正文2.1 手性药物的特点手性药物是指具有手性结构的药物分子,即分子具有非对称的手性中心。
色谱技术在手性药物拆分中的应用分析色谱技术是一种广泛应用于化学分析领域的分离和鉴定方法。
在手性药物的研究和开发过程中,色谱技术起着重要的作用。
本文将从手性药物的定义开始,介绍色谱技术在手性药物拆分中的应用分析。
手性药物是指分子结构中存在非对称中心,其分子构型可以存在两个立体异构体,即对映异构体。
这两种立体异构体被称为手性对,分别是左旋异构体和右旋异构体。
右旋异构体通常被称为R体,左旋异构体被称为S体。
在生物体内,由于手性药物与蛋白质、酶等分子的立体选择性相互作用,两个手性异构体的药效、药代动力学和毒理学性质可能存在差异。
拆分手性药物的目的是将其两个手性异构体分离出来,以便对它们进行独立的研究和评价。
色谱技术由于其高效、灵敏、准确和可靠的特点,成为了拆分手性药物的首选方法。
液相色谱技术(HPLC)是最常用的手性药物拆分方法之一。
HPLC通过对手性分子与手性固定相之间的相互作用进行分离。
手性固定相通常是由手性区分聚合物或小分子手性配体涂覆在硅胶微球上形成的。
选择合适的手性固定相和流动相,可以实现对手性药物的定量和定性分离。
气相色谱技术(GC)也可以用于手性药物的拆分。
在GC中,手性药物通常通过在毛细管柱上涂覆手性化合物实现分离。
毛细管柱上的手性化合物会与手性药物产生手性识别作用,从而使两个手性异构体分离。
超高效液相色谱技术(UHPLC)、离子色谱技术(IC)和凝胶渗透色谱技术(GPC)等也可以应用于手性药物的拆分分析。
这些技术可以进一步提高分离效率和灵敏度,并增加对手性药物性质的了解。
色谱技术是一种在手性药物拆分中广泛应用的分析方法。
通过选择合适的手性固定相和流动相,液相色谱和气相色谱都能有效地分离手性药物的两个手性异构体。
超高效液相色谱、离子色谱和凝胶渗透色谱等技术的应用,可以进一步提高分离效率和灵敏度。
这些研究为合理设计和开发手性药物提供了有力的支持。
对含有多个手性中心的药物使用含多糖类手性固定相的高效液相色谱法进行手性拆分摘要对含有多个手性中心的药物进行手性分离是一项具有挑战性的工作。
这篇文章介绍了用多糖类手性固定相对含有多个手性中心的药物进行分离。
并且,柱转换技术在这种化合物得分离中也被应用。
关键词: 回顾;对映体分离; 手性固定相, LC;多糖; 纳多洛尔; 吲多洛尔; 奈必洛尔;地尔硫卓目录1.介绍2.含两个手性中心的药物的手性分离实例3. 含多个手性中心(多于两个)的药物的手性分离实例4. 结论5. 参考文献1. 介绍手性是一个显著的生物学过程,一个生物活性分子的对映体通常具有不同的生物学特性。
生物学作用中的对映体选择性现象并不局限于药物学,它是所有生物活性试剂(杀虫剂、除草剂、香精香料、食物添加剂等)的一个共同特征。
来源于自然物质的药物通常是光学活性或纯形式的单一异构体。
然而,那些用化学方法合成的药物通常是根据不对称中心的数目由两个,四个或者更多异构体混合而成。
因此,立体选择性在手性药物的生物利用度、分配、与受体的相互作用、异构体活动中的代谢和消除过程中所产生的差异从不期望的毒性到毫无意义增大活性。
在过去的30年中,通过高效液相色谱法(HPLC)进行手性分离已经显得越来越重要。
这可以通过以下两个方面得出:(a)间接进行手性分离的方法,包括在色谱分析法中通过一个非手性柱用一个手性衍生物试剂合成非对映异构体;(b)直接进行手性分离的方法,包括用手性固定相(CSPs)将外消旋药物拆分成相应的对映体。
基于手性固定相(CSPs)的直接分离方法因其可以快速、合适的用于分离外消旋酸盐而深受分析和制备行业的喜爱。
自然形成和合成的手性固定相(CSPs)存在着广泛的多样性,绝大多数是用于商业(超过120种)。
这些手性固定相(CSPs)中的很多在应用方面具有局限性。
因此,多糖类固定相和其它固定相,如:化学键合的蛋白质、环糊精及其衍生物、Π-型和大环抗生素已经被证明是在高效液相色谱法进行手性药物的分离中最有用的固定相。