烷烃化学性质
- 格式:pptx
- 大小:982.24 KB
- 文档页数:82


烷烃的化学性质烷烃是一类简单的烃类化合物,由碳和氢元素组成,通式为CnH2n+2。
烷烃分为直链烷烃和环烷烃两种。
直链烷烃分子中碳原子通过单键连接,而环烷烃中存在环状结构。
物理性质烷烃是无色、无味的气体、液体或固体,随着碳原子数的增加,它们的物理性质也有所不同。
由于烷烃是非极性分子,所以它们的溶解度较低,常用作有机燃料。
烷烃的密度随分子的大小而增加,其沸点和凝固点也会随之增加。
化学性质燃烧烷烃是一类优良的燃料,能够在氧气的存在下发生完全燃烧反应。
在充分供氧的条件下,烷烃燃烧生成二氧化碳和水,释放大量热量。
烷烃燃烧的反应方程式如下:CnH2n+2 + (3n+1)/2 O2 → n CO2 + (n+1) H2O氧化反应烷烃还可以通过氧化反应获得相应的醇、醛、酮等化合物。
例如,在存在氧气的条件下,烷烃会发生部分氧化反应生成醛。
这种反应通常需要催化剂的存在来促进反应进行。
卤代反应烷烃可以与卤素发生取代反应,生成卤代烷。
这种反应是通过将卤素与烷烃在适当条件下加热反应得到的,反应过程中会释放一定能量。
裂解反应烷烃在高温条件下也能发生裂解反应,分解为较小的烃类分子。
这种裂解反应对烷烃的工业生产具有重要意义,可实现大分子烷烃的转化。
应用烷烃在化工、燃料等领域有着广泛的应用。
作为有机溶剂、燃料、润滑油等,烷烃在人类生产生活中扮演着不可或缺的角色。
同时,烷烃作为原料还能够提炼出更多有用的化合物,为化工工业的发展做出贡献。
总的来说,烷烃作为一类简单的烃类化合物,具有重要的化学性质,对于我们的工业生产和生活具有重要意义。
我们需要深入研究其性质和应用,以发挥其最大的潜力。
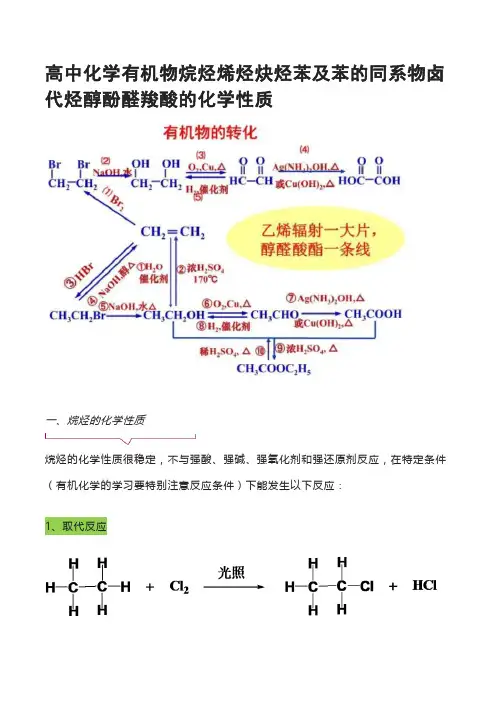
高中化学有机物烷烃烯烃炔烃苯及苯的同系物卤代烃醇酚醛羧酸的化学性质一、烷烃的化学性质烷烃的化学性质很稳定,不与强酸、强碱、强氧化剂和强还原剂反应,在特定条件(有机化学的学习要特别注意反应条件)下能发生以下反应:1、取代反应2、氧化反应3、裂化和裂解大分子烷烃通过高温分解为小分子物质,如小分子烷烃、烯烃以及氢气。
二、烯烃的化学性质碳碳双键C=C是烯烃的官能团,烯烃化学性质比较活泼,容易发生加成、氧化还原,聚合:1、加成反应(1)1,2-加成A、丙烯和溴单质加成B、丙烯和溴化氢加成(马氏规则:H越多,越加H)(2)1,4-加成【注意】:发生1,2-加成或1,4-加成,取决于反应条件,一般低温倾向于发生1,2-加成,高温倾向于发生1,4-加成。
由此可见,相同的反应物在不同的条件下会生成不同的产物,因此要特别注意反应的条件,记准,记对!(3)环加成2、氧化反应(1)燃烧反应(2)高锰酸钾氧化书写步骤:A、碳碳双键断开变碳氧双键;B、双键碳上的氢原子变羟基。
(3)臭氧氧化只进行高锰酸钾氧化的第一步,C=C双键断裂变碳氧双键。
3、聚合反应4、烯烃的顺反异构两个双键碳原子上都连接两个不同的原子或原子团,就会有顺反异构。
顺式结构:两个相同原子或原子团在双键同一侧。
反式结构:两个相同原子或原子团在双键两侧。
三、炔烃的化学性质炔烃的官能团是碳碳三键,具有活泼的化学性质:1、加成反应炔烃可以和溴的四氯化碳溶液、卤素单质、氢气、氯化氢、水等发生加成反应。
2、氧化反应(1)燃烧:(2)能和高锰酸钾和臭氧反应(方程式不需要掌握)3、聚合反应聚乙炔中掺入某些物质,可以使其导电性显著增强,聚乙炔又叫做导电塑料。
四、苯及其同系物的化学性质1、取代反应(2)苯不能使酸性高锰酸钾溶液褪色,也不能与溴水发生加成反应使溴水褪色,但苯能将溴从溴水中萃取出来。
(3)苯的同系物的氧化反应五、卤代烃的化学性质1、NaOH的水溶液发生取代反应变成醇2、NaOH的醇溶液发生消去反应变成烯(札依采夫规则)【注意】:札依采夫规则:H越少,越减H。


烷烃的化学性质烷烃(Alkanes)是一类碳氢化合物,通式为CnH2n+2,是碳氢化合物中最简单的一类。
它们的化学性质主要是通过碳碳键和碳氢键的化学反应来反映。
烷烃的化学性质涉及到其物理性质,比如燃烧性质、氧化、卤素取代反应等一系列的反应过程,以及其它的有机化学反应。
1. 燃烧性质:烷烃的燃烧是指把烷烃与氧气反应,产生二氧化碳和水。
烷烃在空气中燃烧会产生明亮的火苗,有一定的热值。
燃烧反应是烷烃常见的化学反应之一,也是在日常生活中使用的常见性质。
例如,将天然气(主要成分是甲烷)用作燃料时,燃烧产生的热可以用于加热。
2. 氧化反应:烷烃一般很难被氧气氧化,因为它们的分子中所有的碳氢键都已饱和,分子结构稳定。
但是,在存在良好的氧化剂的情况下,烷烃可以发生氧化反应。
氧化剂会断裂分子中的碳氢键,形成碳氧和氢氧。
最典型的氧化反应是烷烃的燃烧,也会发生部分氧化反应。
3. 卤素取代反应:烷烃中的氢可以被卤素原子取代,形成卤代烷烃。
取代反应是在有机化学中常见的一类反应,可以发生在很多种有机化合物中。
在烷烃中,氢会被卤素原子取代产生卤代烷烃。
典型的卤素取代反应包括氯代反应和溴代反应等。
4. 加成反应:烷烃可以与分子中的其他化合物发生加成反应,形成新的共价键。
在炼油、石油化工行业中,烷烃可以通过加成反应形成不同的烃类,例如烯烃和芳香族化合物等。
5. 烷基化反应:烷基化反应是一种有机化学反应,可以为一个有机分子合成新的烷基。
在烷基化反应中,烃分子中某个碳原子的烷基被迁移或注入其他化学物质,形成新的烷基化合物。
在工业上,烷基化反应主要是用来合成高级烃类,例如烷基锂和烷基钠等。
总而言之,烷烃的化学性质中,燃烧性质、氧化反应、卤素取代反应、加成反应以及烷基化反应等的反应过程,都是烷烃常见的化学反应。
它们可以被用作燃料,或者在工业、化学实验和科研中进行各种有机化学反应,对经济、生活和学术等方面都有着重要的作用和意义。

烷烃化学性质总结
烷烃是一类包含氢、碳框架的有机化合物,它们具有重要的化学性质以及在产业应用方面的重要意义。
首先,烷烃可按其碳原子链长度分类,如烷烃链中碳原子数多于五个成分被称为长链烷烃,而碳原子数少于等于五个成分则称为短链烷烃。
其次,烷烃的含烃量往往衡量它们的物理特性,而其熔点、折射率、质量数等均与含烃量以及碳链长度有关。
此外,烷烃可发生异构化变化,烷烃异构化变化在复合有机化学反应中起着重要作用。
通过混合某些特定的共价催化剂,烷烃可以进行多个不同的反应,如加成反应、加氧反应、代换反应和减分反应等,从而利用烷烃来制备具有重要功能的合成物。
最后,烷烃也可以产生挥发性气体,这可以帮助消除空气中的污染物,从而减少空气污染的危害。
综上所述,烷烃是一种重要的有机化合物,在化学性质方面可以按碳原子链长度的不同进行分类,含烃量可以衡量它们的物理特性,它们可以进行异构化变化,是一种重要的有机反应物,以及可以帮助消除空气中污染物。
烷烃也在工业上有着广泛的应用,它们被广泛用于日用品、电子、纺织、化工等领域,为我们构建工业化新生活提供便利。

烃的化学性质烷烃是最简单的芳香烃,也称烷烃。
烷烃包括直链烷烃和支链烷烃两类。
分子中只有碳碳双键交替排列的链状结构化合物。
烷烃包括正构烷烃、异构烷烃和新烷烃三种。
烷烃分子中都含有碳碳双键交替排列,这使得分子具有一定的极性。
其分子中存在着未成键电子对,所以能够与其他分子或原子形成氢键。
由于具有未成键电子对,使得烷烃在紫外线下具有光敏性。
化学性质稳定。
(1)取两支试管,向每支试管中加入少量固体氢氧化钠,再滴入少量酚酞溶液,振荡,观察现象,记录实验数据。
(3)将铁丝的一端固定在试管内,用玻璃棒蘸取少量蒸馏水滴到火柴头上,观察现象,记录实验数据。
分析:因为氢氧化钠碱性强,所以酚酞试液变红,而石蕊试液不变色。
注意:实验现象要完整、清晰、明亮,并且尽可能多地进行实验。
(4)乙炔(气体)在氧气(气体)中燃烧。
1.将试管固定在铁架台上,再向试管里放入少量酒精。
2.点燃酒精灯。
3.试管口要对准酒精灯,使酒精灯火焰的外焰部分接触到试管内的酒精。
4.用燃着的木条放在试管口,移去酒精灯,试管里的酒精剧烈燃烧,发出淡蓝色的火焰。
5.用湿润的红色玻璃纸片盖住试管口,熄灭酒精灯,待试管冷却后打开。
1.取两个大小相同的试管,向试管中分别滴加等量的硝酸钾、高锰酸钾固体。
2.取两个试管分别在酒精灯上灼烧。
在它们之间形成的是液态混合物。
1.取两个试管,分别往两个试管中加入少量浓硫酸、无色酚酞溶液。
2.加热,充分反应后,分别取等量固体到试管中。
观察颜色,写出有关的化学方程式。



引言概述:有机化学烷烃是一类重要的有机化合物,具有简单的化学结构和广泛的应用。
烷烃是碳氢化合物,其分子由碳、氢原子组成。
在本文中,将详细介绍有机化学烷烃的概念、结构、性质以及常见的应用。
正文内容:一、烷烃的概念与分类1.定义及基本结构:烷烃是一类仅由碳和氢原子组成的有机化合物,其分子由碳原子通过单键相连而成。
2.分类:根据碳原子的连接方式,烷烃可分为直链烷烃、支链烷烃和环烷烃三类。
二、烷烃的物理性质1.沸点与熔点:烷烃的沸点和熔点随碳原子数的增加而增加。
直链烷烃的沸点和熔点一般高于相同碳原子数的支链烷烃。
2.密度:烷烃的密度一般较小,随着碳原子数的增加,密度逐渐增加。
3.溶解性:烷烃一般不溶于水,但可以溶于非极性溶剂。
三、烷烃的化学性质1.燃烧性质:烷烃是易燃物质,可以通过燃烧产生大量热能。
2.氧化性质:烷烃可以通过氧化反应得到相应的醇、酮等官能团。
3.卤素取代反应:烷烃可以与卤素发生取代反应,相应的卤代烷烃。
4.加成反应:烷烃可以通过加成反应相应的烯烃或环烷烃。
四、烷烃的应用1.燃料:由于烷烃易于燃烧,因此广泛用作燃料,如汽油、柴油和天然气等。
2.溶剂:烷烃可以作为有机溶剂,常用于涂料、清洁剂等领域。
3.化学原料:烷烃是许多化学合成的重要原料,可制备醇类、酮类、醚类等有机化合物。
4.制冷剂:一些烷烃具有较低的沸点,被用作制冷剂,如氟利昂等。
5.生物医药:部分烷烃可以作为药物的活性部分,如烷烃类抗生素等。
五、烷烃的环境影响和安全性1.燃烧产生的污染物:烷烃的燃烧会产生二氧化碳和氮氧化物等温室气体和大气污染物。
2.化学品的安全性:某些烷烃具有易燃、爆炸性和刺激性等危险特性,需要妥善存储和使用。
总结:有机化学烷烃是碳氢化合物的重要代表,具有简单的结构和广泛的应用。
本文详细介绍了烷烃的概念与分类、物理性质、化学性质以及常见的应用。
同时,也指出了烷烃在环境和安全方面的相关问题。
研究和应用烷烃化合物对于理解有机化学的基本原理和推动现代科技发展具有重要意义。
烷烃的化学性质烷烃是由碳(C)和氢(H)两种元素组成的有机化合物,其化学性质主要与碳氢键的稳定性相关。
本文将探讨烷烃的燃烧性质、卤代反应性、氧化性以及其他一些重要的化学性质。
一、烷烃的燃烧性质烷烃是一类高度易燃的化合物,其主要反应是与氧气(O2)发生燃烧反应。
燃烧反应通常需要外部能量的供应,例如点火或加热。
在此之后,烷烃会与氧气相结合,生成二氧化碳(CO2)和水(H2O),同时释放大量的能量。
此过程可用以下方程式表示:烷烃 + 氧气→ 二氧化碳 + 水 + 能量例如,甲烷(CH4)燃烧生成如下:CH4 + 2O2 → CO2 + 2H2O + 能量烷烃的燃烧不仅释放能量,还会产生火焰和烟雾等可见的特征。
二、烷烃的卤代反应性烷烃与卤素(如氯、溴等)发生卤代反应,生成相应的卤代烷。
在这种反应中,某个或多个氢原子被卤素取代。
这种反应一般需要紫外线或热能的激发。
举个例子,乙烷(C2H6)与氯气(Cl2)发生卤代反应得到氯乙烷(C2H5Cl):C2H6 + Cl2 → C2H5Cl + HCl这种反应十分重要,因为卤代烷是许多重要有机化合物的前体。
三、烷烃的氧化性质烷烃可以与氧气和其他氧化剂发生氧化反应。
在此过程中,烷烃的碳氢键被氧化剂断裂,形成碳氧化物。
烷烃氧化反应的最常见例子是酒精的氧化。
乙醇(C2H5OH)可以被氧气氧化为乙醛(C2H4O):C2H5OH + [O] → C2H4O + H2O烷烃的氧化反应通常需要催化剂的参与,以降低反应温度和提高反应效率。
四、烷烃的其他化学性质除了上述的燃烧、卤代反应和氧化反应外,烷烃还具有其他一些重要的化学性质。
1. 氢化反应:烷烃可以与氢气进行催化加氢反应,生成饱和烃。
这种反应常用于工业催化裂化和有机合成反应中。
2. 氧化脱氢:在高温、高压和催化剂的作用下,烷烃可以发生氧化脱氢反应,生成烯烃和芳香烃。
这种反应广泛应用于烃烃转化和石油加工工业。
3. 反应活性:由于烷烃分子中只含有碳氢键,缺乏其他活性基团,因此烷烃在与其他有机化合物发生相互转化的反应中的活性较低。
烷烃类的化学性质与化学反应烷烃是指由碳和氢组成,只含有单键的碳氢化合物。
它们的分子式为CnH2n+2。
烷烃分为直链烷烃和支链烷烃两种,其中直链烷烃结构简单,化学性质活泼,而支链烷烃分子结构复杂,化学性质相对不活泼。
1.化学性质的概述烷烃是一类较为稳定的化合物,但它们并不是完全的不活泼。
由于烷烃中的碳和氢原子之间的键比较弱,容易被各种化学试剂进攻,产生各种化学反应。
由于烷烃结构简单,因此它们的化学反应多是比较规律的,具有一定的可预见性。
2.烷烃的氧化反应烷烃的氧化反应是指烷烃分子与氧气分子进行反应,生成氧化产物的化学反应。
这种反应可以分为完全氧化和不完全氧化两种。
完全氧化是指烷烃分子与氧气分子充分反应,生成的产物只含有碳和氧两种元素。
例如,甲烷与氧气反应,可以完全氧化生成二氧化碳和水。
CH4 + 2O2 → CO2 + 2H2O不完全氧化是指烷烃分子和氧气分子反应时,由于反应条件的不同,反应产物并不完全是二氧化碳和水,还可能包括一些碳氧化物、碳烷化合物等。
例如甲烷在着火点以上的温度下与氧气反应,生成一氧化碳和水。
2CH4 + 3O2 → 2CO + 4H2O3.烷烃的卤素化反应烷烃的卤素化反应是指烷烃分子与卤素分子(氯、溴、碘)进行反应,产生相应的卤化烷。
这种反应需要在紫外线的照射下进行,因为紫外线能够使卤素分子裂解成自由基,从而引发反应。
例如,甲烷和氯气进行反应,可以生成氯甲烷和氢气。
CH4 + Cl2 → CH3Cl + HCl4.烷烃的加氢反应烷烃的加氢反应是指烷烃分子与氢气分子进行反应,产生较为稳定的烷基化合物。
这种反应常常需要使用金属催化剂,例如镍、铂等金属,才能有效进行。
例如,乙烯可以通过加氢反应生成乙烷。
C2H4 + H2 → C2H65.烷烃的裂解反应烷烃的裂解反应是指烷烃分子在高温下发生聚合分解反应,产生较小的碳烷化合物和氢气分子。
由于烷烃中碳碳键比较弱,因此在高温下容易发生分解反应。
烷烃的化学性质
烷烃性质很稳定,因为C-H键和C-C双键相对稳定,难以断裂。
烷烃的化学性质不活泼,难于氧化,不能使溴水或酸性高锰酸钾溶液褪色,其主要反应是取代反应。
最小的烷烃是甲烷。
烷烃
烷烃即饱和烃,是只有碳碳单键的链烃,是最简单的一类有机化合物。
由于烷烃的稳定结构,所有的烷烃都能稳定存在。
烷烃的相互特性是:比水轻,可以点燃,而且基本上也不溶解水。
这类质的导向性,更是因为他们全是由碳、氢元素构成的,而且在总数上具备一定的占比(详细同系物)。
另一方面,因为各化学物质碳、氢原子构成的肯定总数不一样,因此又各自主要表现出分别的特点。
它是质量互变规律造成了一部分变质。
如甲烷气体是汽体,要冻到零下161.6℃オ会凝固成液體,多了一个氧原子和两个氢原子的己烷冷到零下88.6℃就变为液體了,它的汽
化溫度比甲烷气体高于了七十多度。
而丁烷要是冷到0℃上下就汽化了。
假如碳氢原子的总数再次提升,当化学物质含5~11个氧原子时,他们就变成车用汽油的主要成分;含10~17个氧原子的化学物质是煤油的成分;柴油机和润滑油成分则是含16~20个氧原子的化学物
质;20个氧原子之上的化学物质通称为石腊,他们在一般情况下全是固体。
不难看出,“化学式的这类量的转变,每一次都造成一个质上不一样的物件的产生。